Содержание
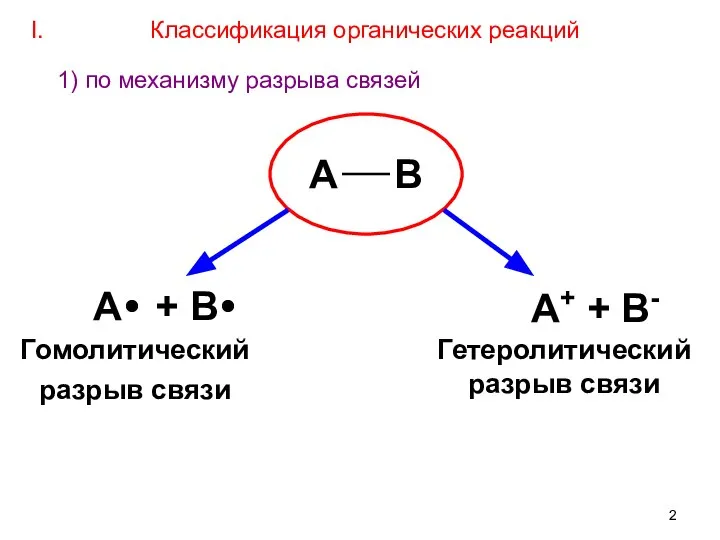
- 2. А В А+ + В- Гомолитический разрыв связи А + В Гетеролитический разрыв связи I. Классификация
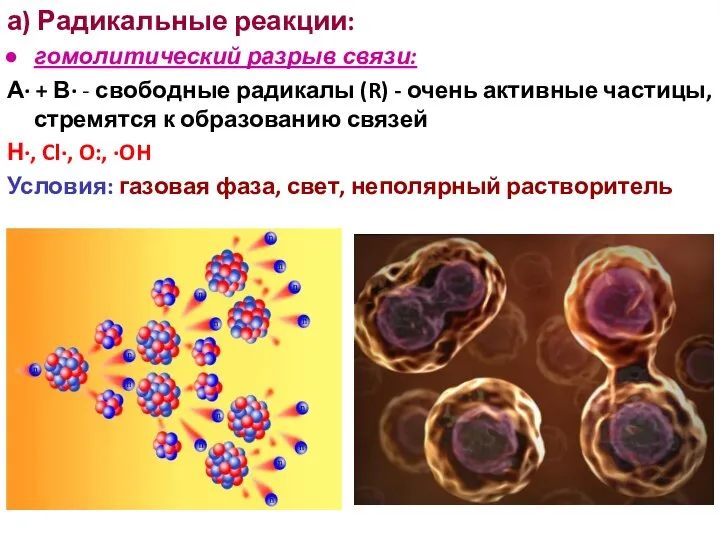
- 3. а) Радикальные реакции: гомолитический разрыв связи: А· + В· - свободные радикалы (R) - очень активные
- 4. Н.Н. Семенов (1896-1986г.) Лауреат Нобелевской премии (1956 г.) Создатель теории механизма свободно-радикальных(цепных) реакций
- 5. б) Ионные реакции: гетеролитический разрыв связи образуются положительные частицы- электрофилы Е (ε) (Н+, NO2+, Br+, SO3
- 6. в) Синхронные реакции – разрыв старых и образование новых связей происходят одновременно.
- 7. S: (реакции замещения, англ. Substitution) SR - алканы SE - арены SN - галогенпроизводные, спирты, карбоновые
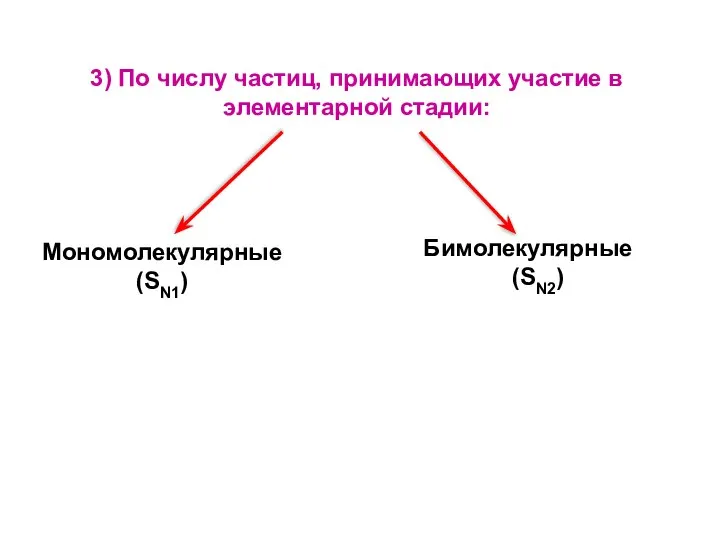
- 8. Мономолекулярные (SN1) Бимолекулярные (SN2) 3) По числу частиц, принимающих участие в элементарной стадии:
- 9. II. Электронные эффекты заместителей. Участок молекулы, где ē - плотность максимальная или минимальная является самым реакционноспособным.
- 10. Электронные эффекты заместителей. Любой атом или группа атомов, замещающая H в исходном соединении, называется заместителем. Влияние
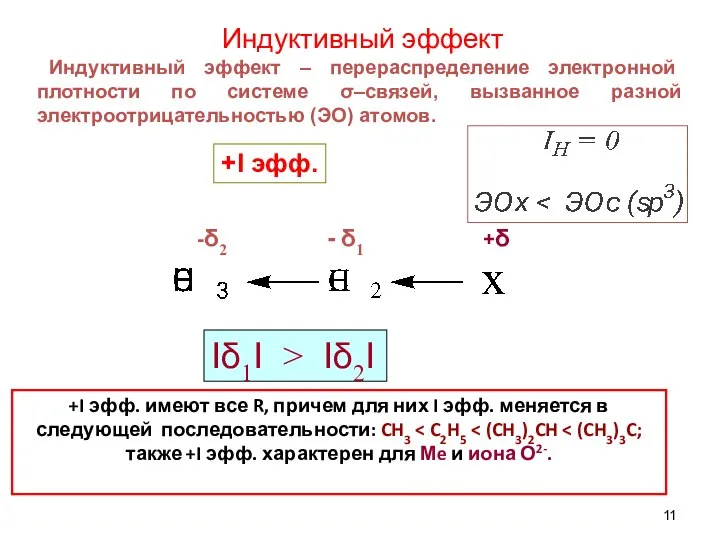
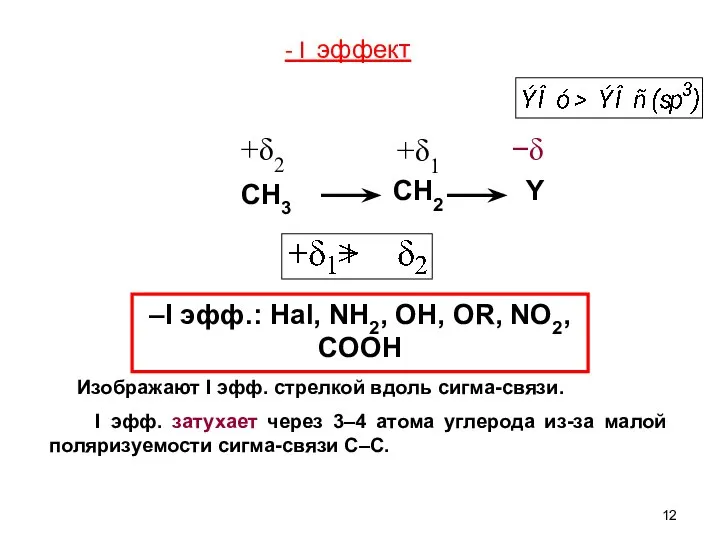
- 11. Индуктивный эффект Индуктивный эффект – перераспределение электронной плотности по системе σ–связей, вызванное разной электроотрицательностью (ЭО) атомов.
- 12. Изображают I эфф. стрелкой вдоль сигма-связи. I эфф. затухает через 3–4 атома углерода из-за малой поляризуемости
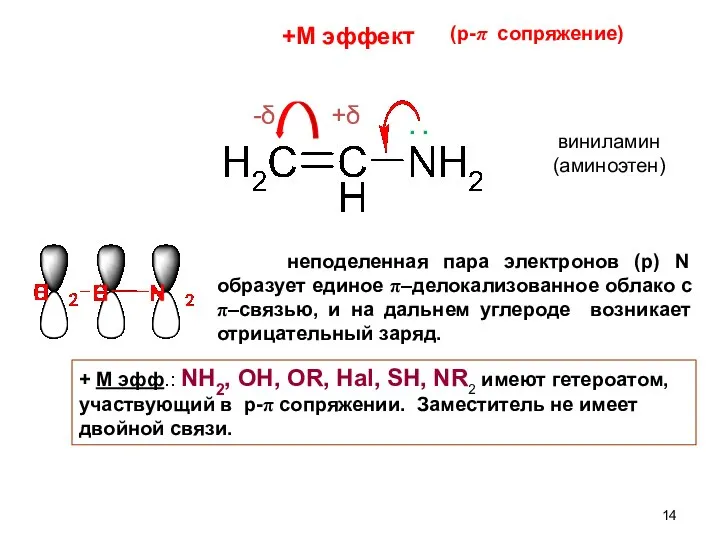
- 13. МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ) Мезомерный эффект (М) – перераспределение электронной плотности по системе π–связей. М эфф.,
- 14. неподеленная пара электронов (р) N образует единое π–делокализованное облако с π–связью, и на дальнем углероде возникает
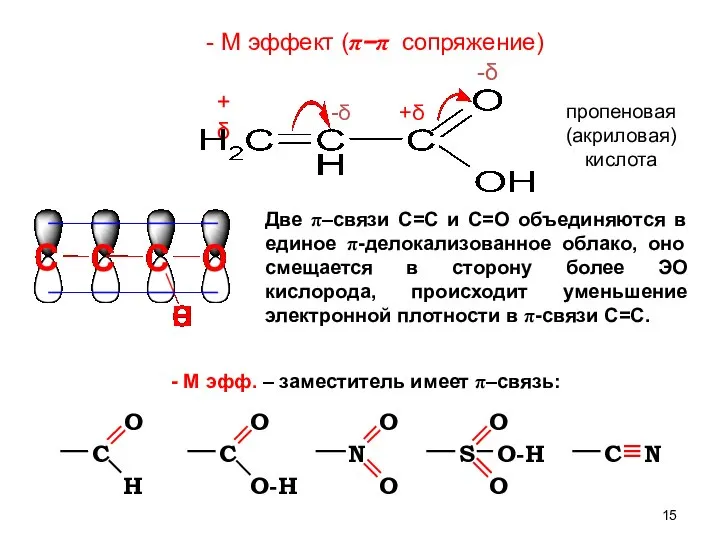
- 15. - М эфф. – заместитель имеет π–связь: Две π–связи С=С и С=О объединяются в единое π-делокализованное
- 16. Суммарный эффект заместителей складывается из I и М эффектов. В результате заместители делятся на: 1) электронодонорные
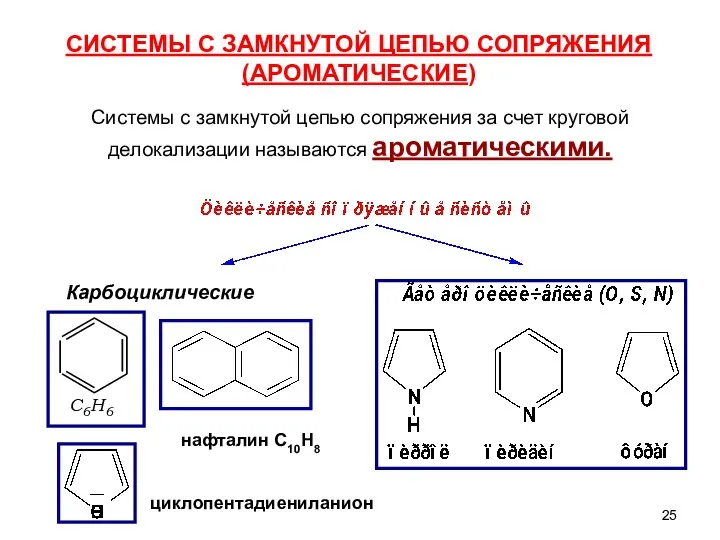
- 17. Сопряженные системы С открытой цепью сопряжения имеют начало и конец сопряжения Представители: - бутадиен-1,3 - изопрен
- 18. Системы с открытой цепью сопряжения СОПРЯЖЕНИЕ – это выравнивание связи по энергии и по длине, вызванное
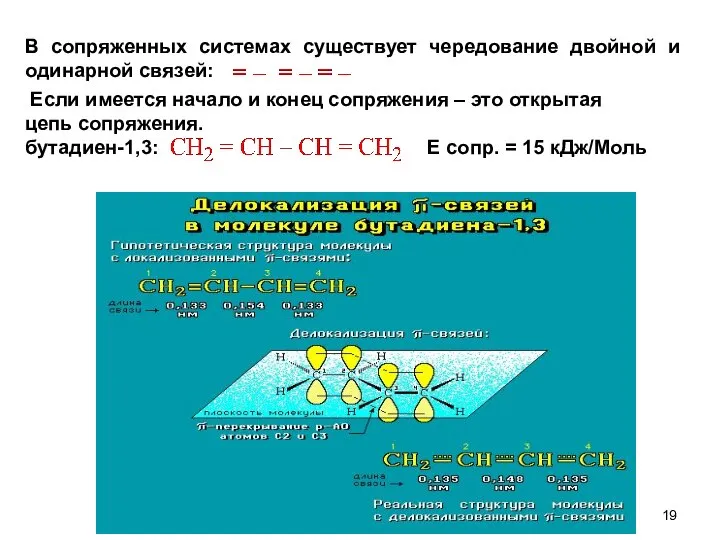
- 19. В сопряженных системах существует чередование двойной и одинарной связей: Если имеется начало и конец сопряжения –
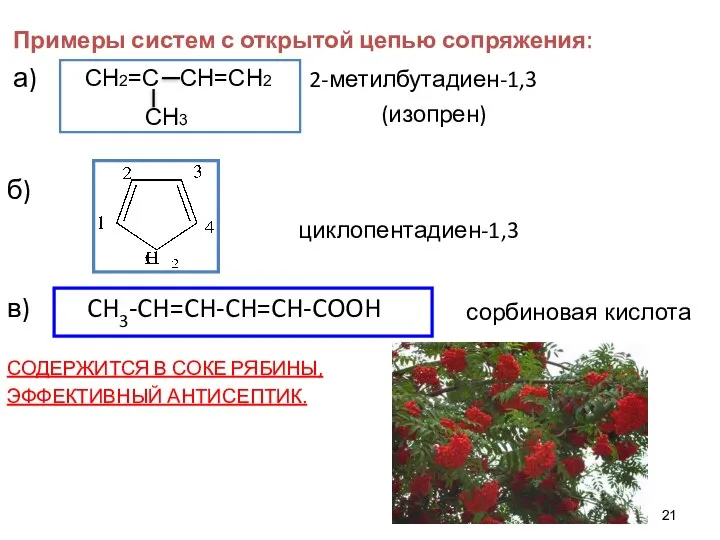
- 21. Примеры систем с открытой цепью сопряжения: а) 2-метилбутадиен-1,3 (изопрен) б) циклопентадиен-1,3 в) CH3-CH=CH-CH=CH-COOH СОДЕРЖИТСЯ В СОКЕ
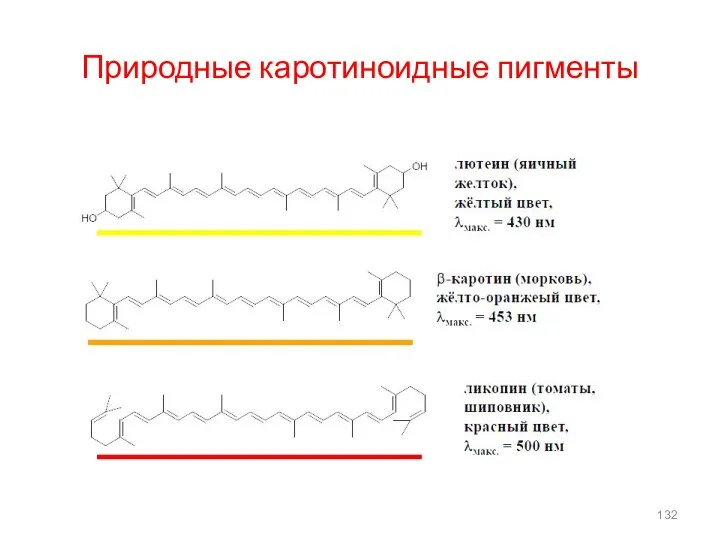
- 22. β–каротин – провитамин А, обуславливает окраску моркови,томатов, масла; имеет сопряженную систему из 11двойных (=) связей. В
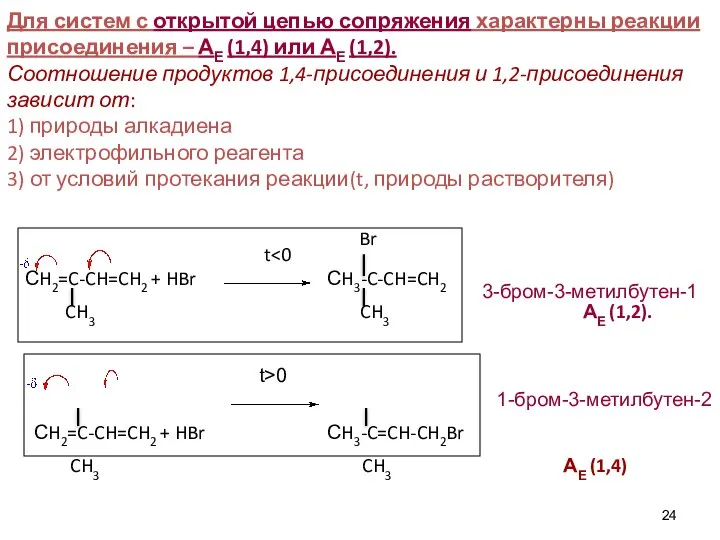
- 23. ОСОБЕННОСТИ РЕАКЦИОННОЙ СПОСОБНОСТИ СОПРЯЖЕННЫХ СИСТЕМ С ОТКРЫТОЙ ЦЕПЬЮ СОПРЯЖЕНИЯ Химическое поведение молекулы обусловлено природой химической связи,
- 24. Br t СH2=C-CH=CH2 + HBr СH3-C-CH=CH2 CH3 CH3 АЕ (1,2). СH2=C-CH=CH2 + HBr СH3-C=CH-CH2Br CH3 CH3
- 25. циклопентадиениланион Системы с замкнутой цепью сопряжения за счет круговой делокализации называются ароматическими. СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ
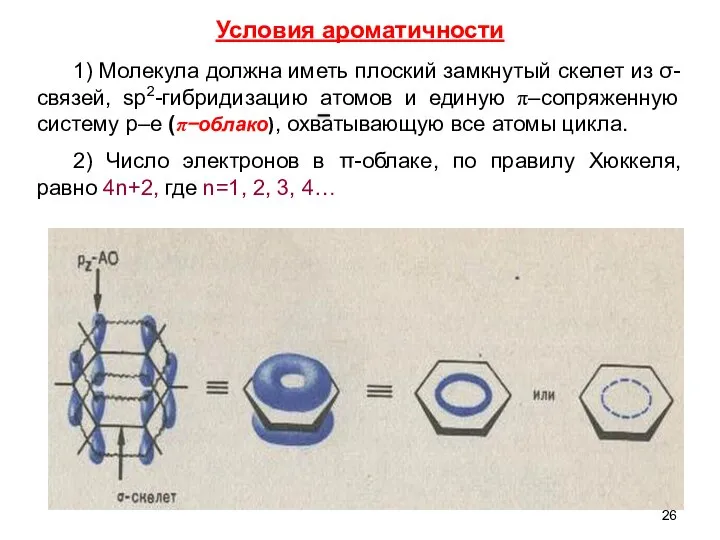
- 26. 1) Молекула должна иметь плоский замкнутый скелет из σ-связей, sp2-гибридизацию атомов и единую π–сопряженную систему р–е
- 27. ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
- 28. Для ароматических УВ характерны реакции, обусловленные замкнутой цепью сопряжения. Устойчивость к окислению (энергия сопряжения =150 кДж/моль)
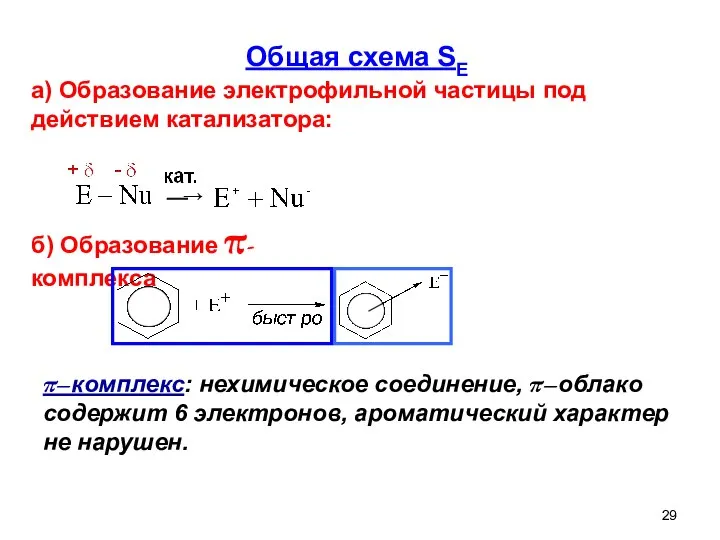
- 29. Общая схема SE а) Образование электрофильной частицы под действием катализатора: ⎯→ б) Образование π-комплекса π–комплекс: нехимическое
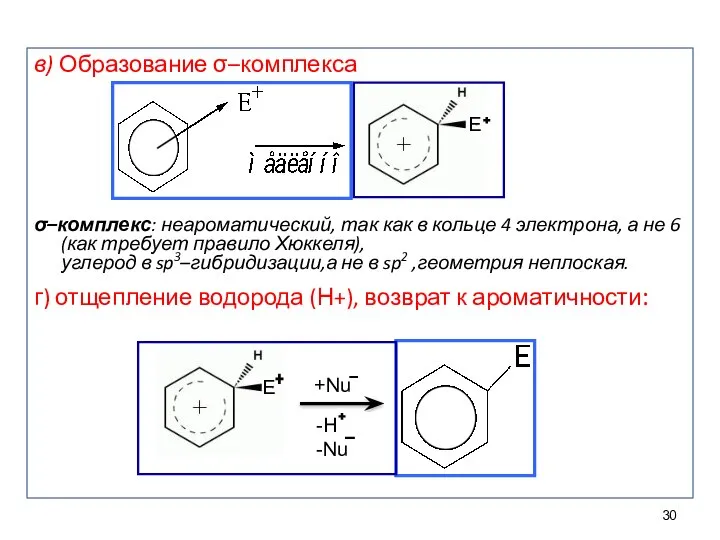
- 30. в) Образование σ–комплекса σ–комплекс: неароматический, так как в кольце 4 электрона, а не 6 (как требует
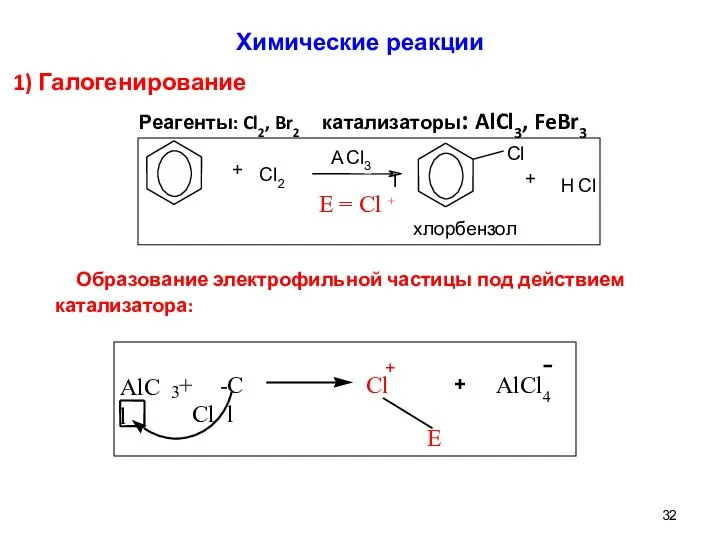
- 31. 1) Галогенирование: Реагенты: Cl2, Br2;катализаторы: AlCl3,FeBr3 2) Нитрование: Реагент: HNO3 (конц.); УСЛОВИЯ: H2SO4 (конц.) 3) Сульфирование:
- 32. 1) Галогенирование Реагенты: Cl2, Br2 катализаторы: AlCl3, FeBr3 Образование электрофильной частицы под действием катализатора: Химические реакции
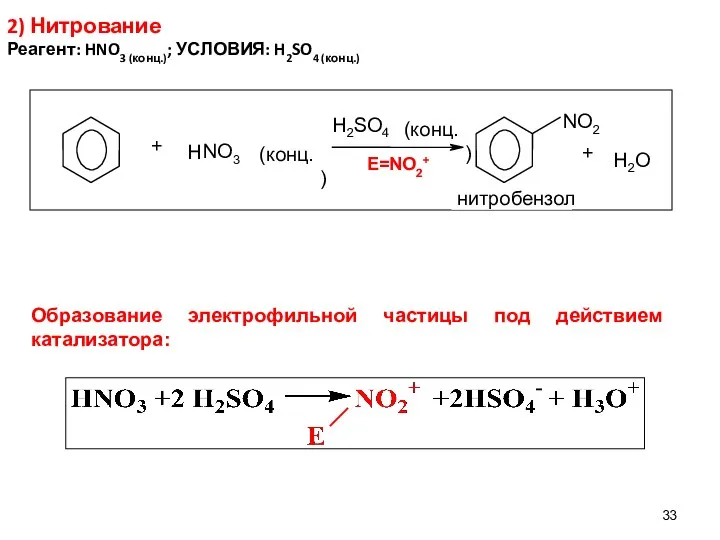
- 33. 2) Нитрование Реагент: HNO3 (конц.); УСЛОВИЯ: H2SO4 (конц.) E=NO2+ Образование электрофильной частицы под действием катализатора:
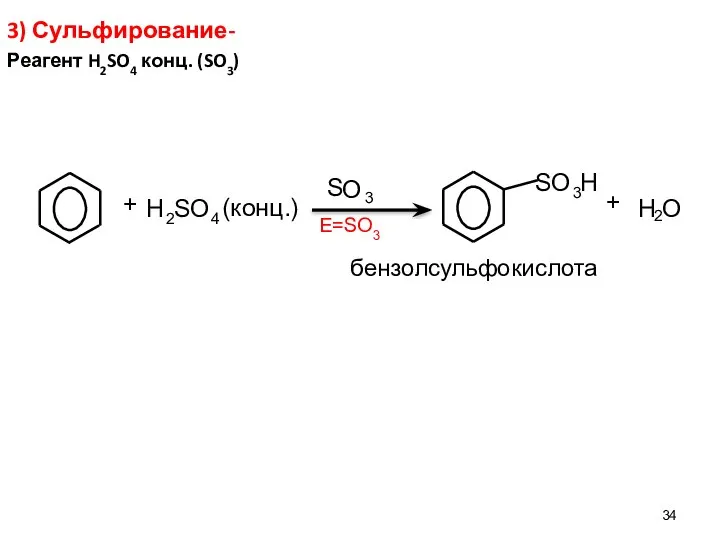
- 34. 3) Сульфирование- Реагент H2SO4 конц. (SO3) E=SO3 H 2 S O 4 S О 3 S
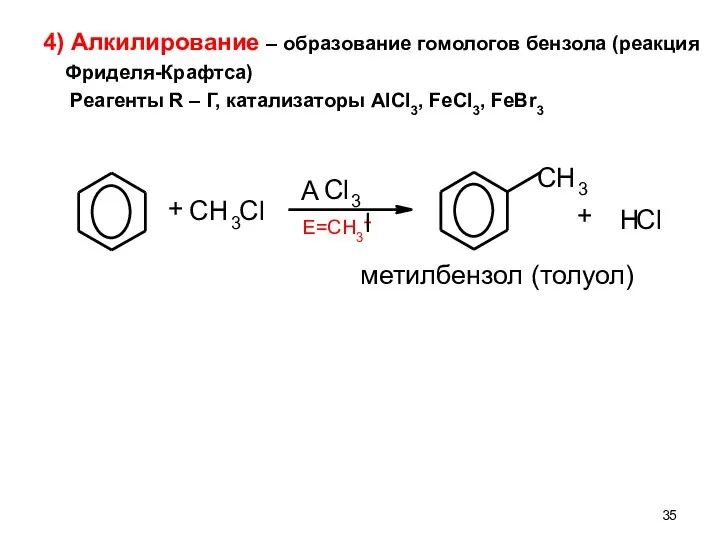
- 35. 4) Алкилирование – образование гомологов бензола (реакция Фриделя-Крафтса) Реагенты R – Г, катализаторы AlCl3, FeCl3, FeBr3
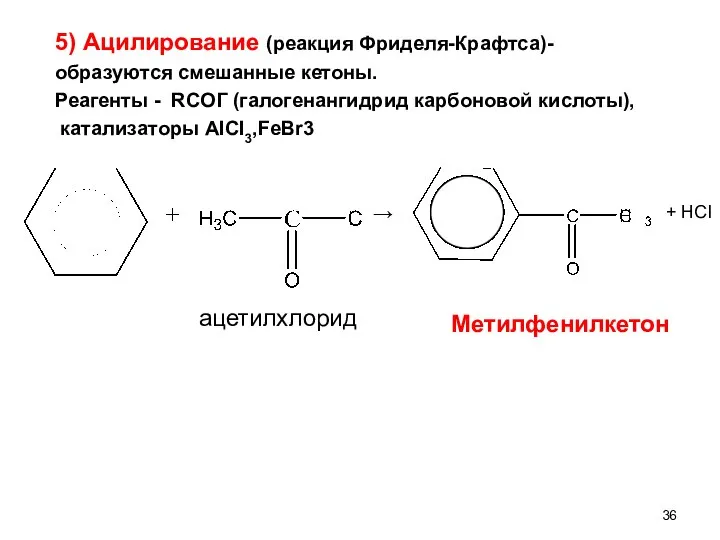
- 36. 5) Ацилирование (реакция Фриделя-Крафтса)- образуются смешанные кетоны. Реагенты - RCOГ (галогенангидрид карбоновой кислоты), катализаторы AICI3,FeBr3 →
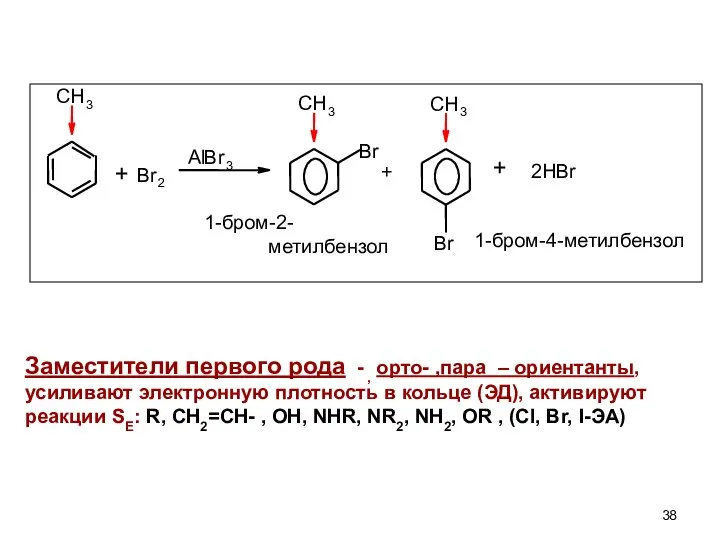
- 37. ПРАВИЛА ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ Первый заместитель встает в любое положение и влияет на распределение электронной
- 38. C H 3 B r 2 Al B r 3 C H 3 C H 3
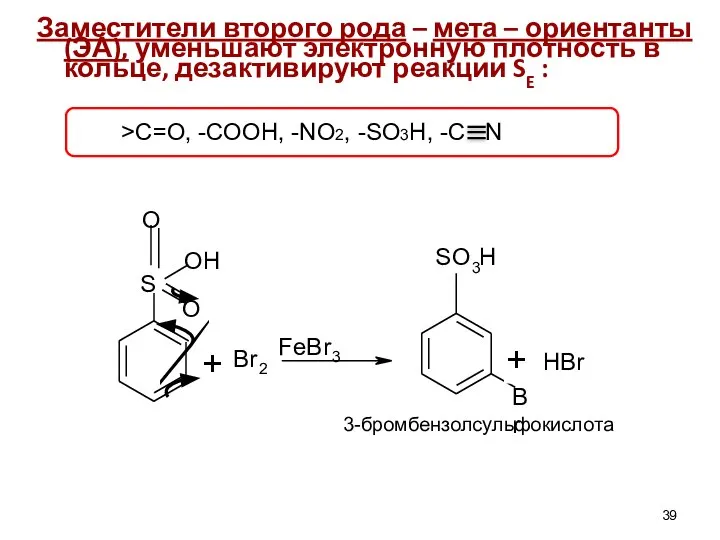
- 39. Заместители второго рода – мета – ориентанты (ЭА), уменьшают электронную плотность в кольце, дезактивируют реакции SE
- 40. ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ БЕНЗОЛА
- 41. Фенолокислоты Фенолокислоты — это ароматические кислоты, в молекуле которых одновременно с карбоксильной группой имеется фенольный гидроксил.
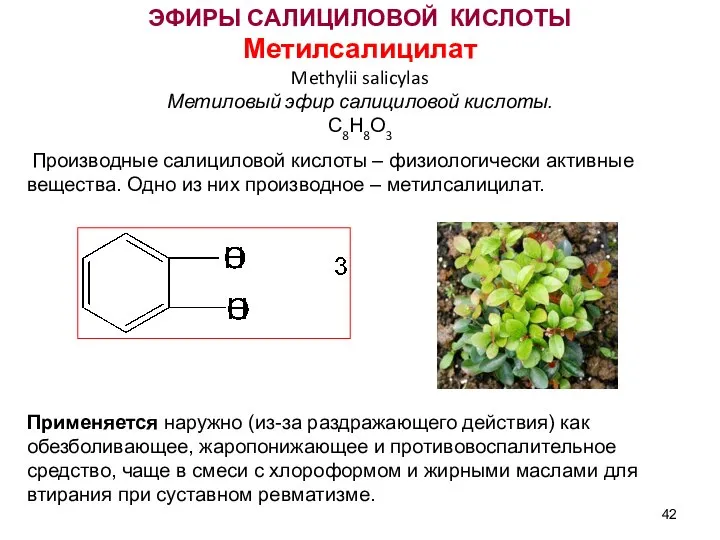
- 42. ЭФИРЫ САЛИЦИЛОВОЙ КИСЛОТЫ Метилсалицилат Methylii salicylas Метиловый эфир салициловой кислоты. С8Н8О3 Производные салициловой кислоты – физиологически
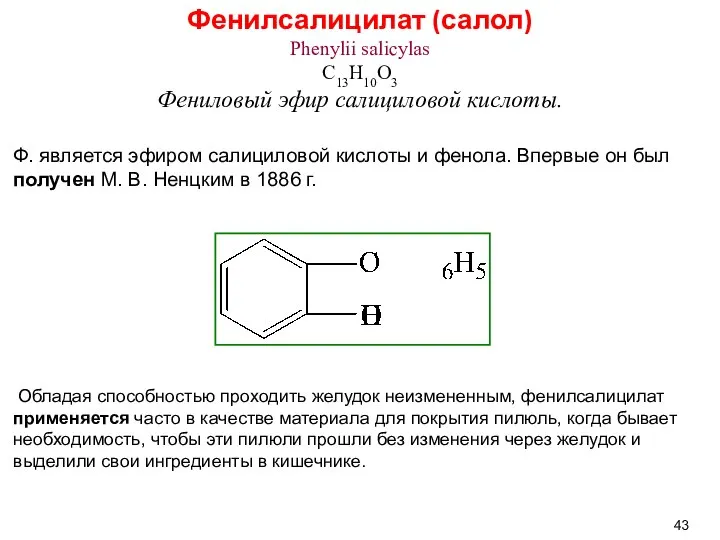
- 43. Фенилсалицилат (салол) Phenylii salicylas C13H10O3 Фениловый эфир салициловой кислоты. Ф. является эфиром салициловой кислоты и фенола.
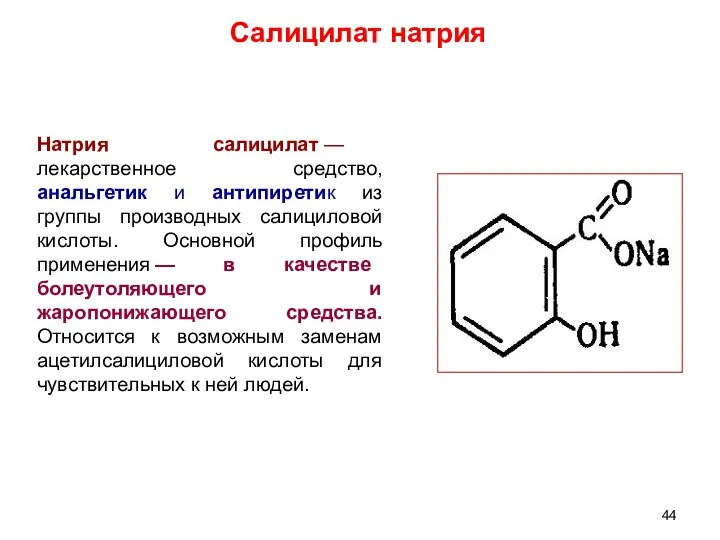
- 44. Натрия салицилат — лекарственное средство, анальгетик и антипиретик из группы производных салициловой кислоты. Основной профиль применения
- 45. Ацетилсалициловая кислота (аспирин) Acidum acetylsalicylicum C9H8O4 2-(ацетилокси)-бензойная кислота. Салициловая кислота впервые была получена путем окисления салицилового
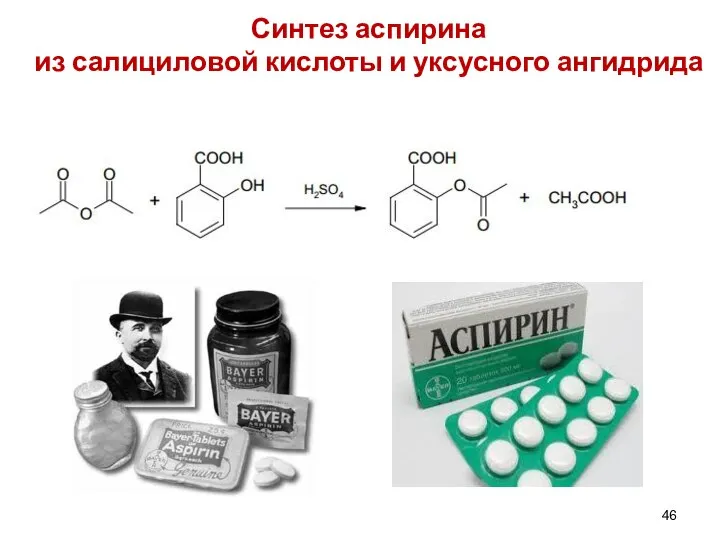
- 46. Синтез аспирина из салициловой кислоты и уксусного ангидрида
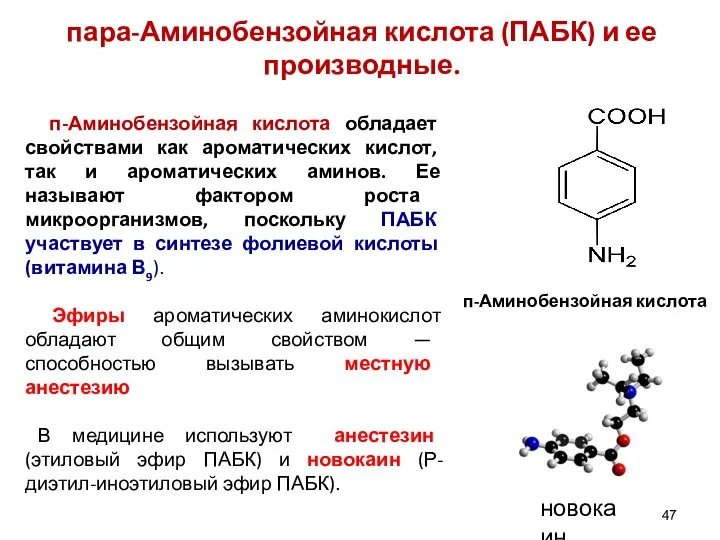
- 47. п-Аминобензойная кислота обладает свойствами как ароматических кислот, так и ароматических аминов. Ее называют фактором роста микроорганизмов,
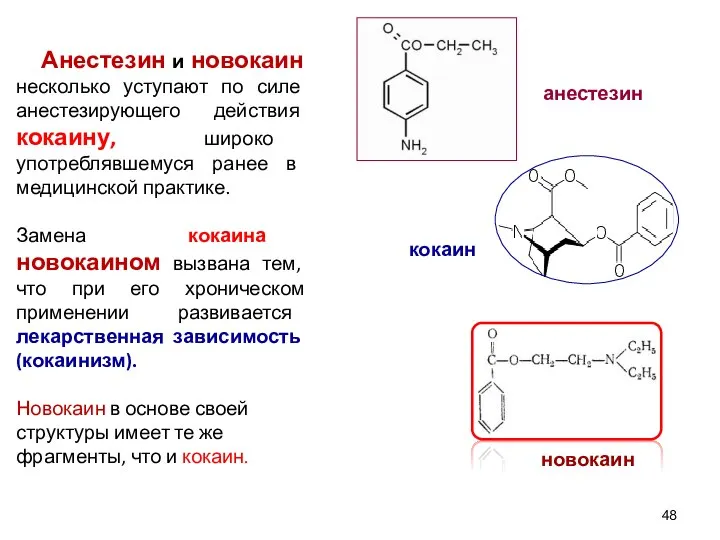
- 48. Анестезин и новокаин несколько уступают по силе анестезирующего действия кокаину, широко употреблявшемуся ранее в медицинской практике.
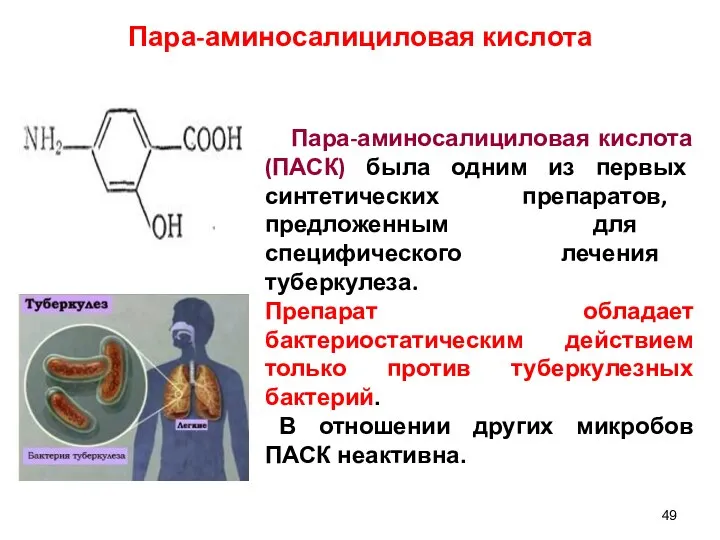
- 49. Пара-аминосалициловая кислота Пара-аминосалициловая кислота (ПАСК) была одним из первых синтетических препаратов, предложенным для специфического лечения туберкулеза.
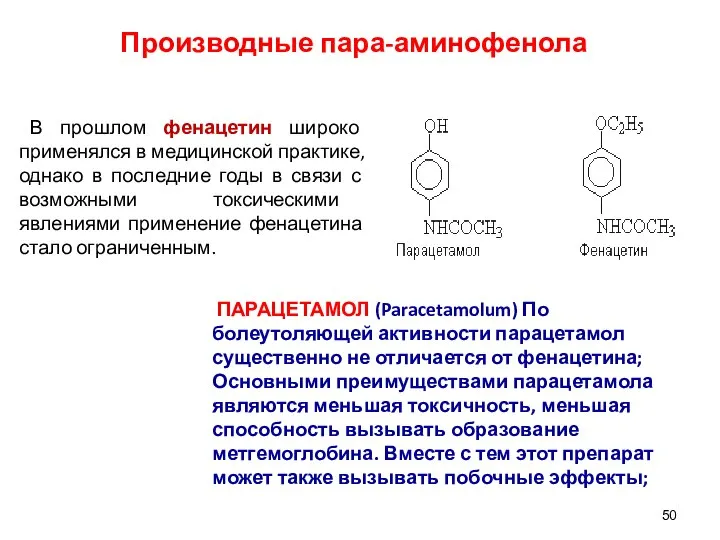
- 50. Производные пара-аминофенола В прошлом фенацетин широко применялся в медицинской практике, однако в последние годы в связи
- 51. Анальгин Анальгин (Метамизол натрия) -лекарственное средство, анальгетик и антипиретик из группы пиразолонов. Синтезирован Людвигом Кнорром в
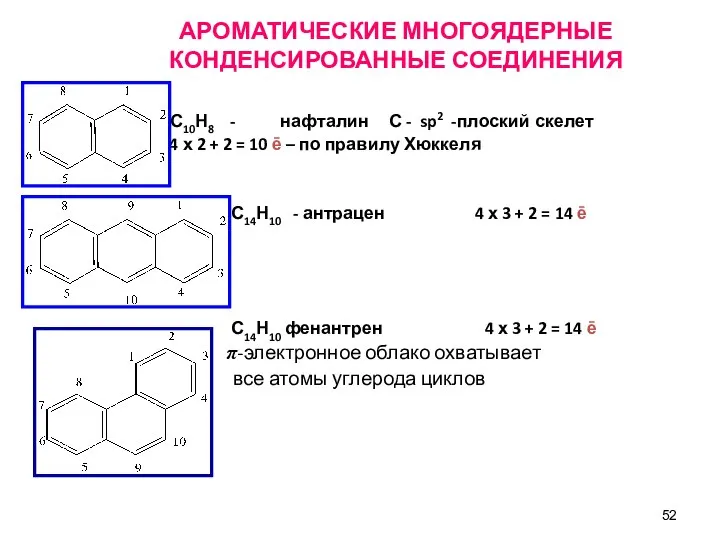
- 52. АРОМАТИЧЕСКИЕ МНОГОЯДЕРНЫЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ С10Н8 - нафталин С - sp2 -плоский скелет 4 х 2 +
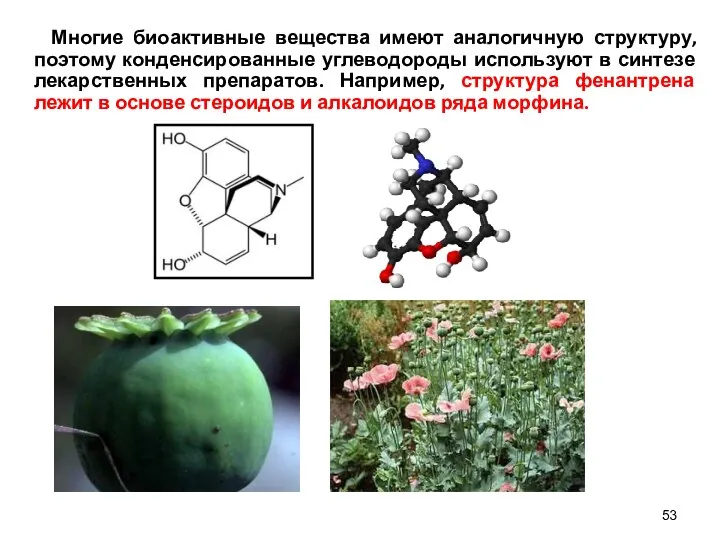
- 53. Многие биоактивные вещества имеют аналогичную структуру, поэтому конденсированные углеводороды используют в синтезе лекарственных препаратов. Например, структура
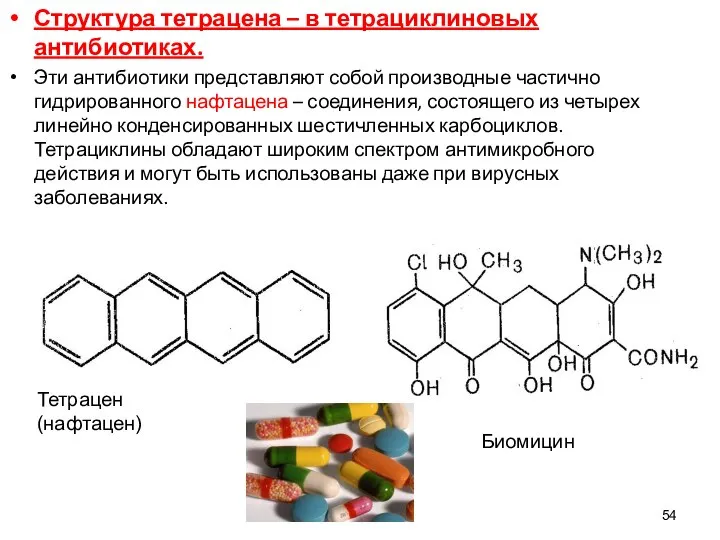
- 54. 54 Структура тетрацена – в тетрациклиновых антибиотиках. Эти антибиотики представляют собой производные частично гидрированного нафтацена –
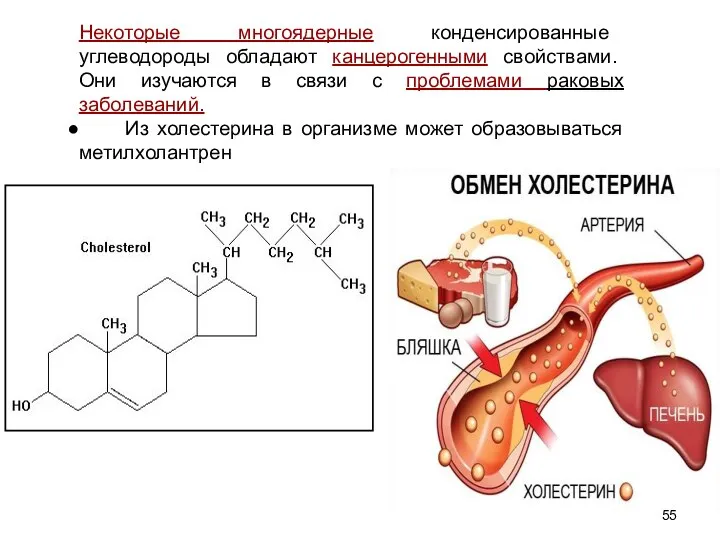
- 55. Некоторые многоядерные конденсированные углеводороды обладают канцерогенными свойствами. Они изучаются в связи с проблемами раковых заболеваний. Из
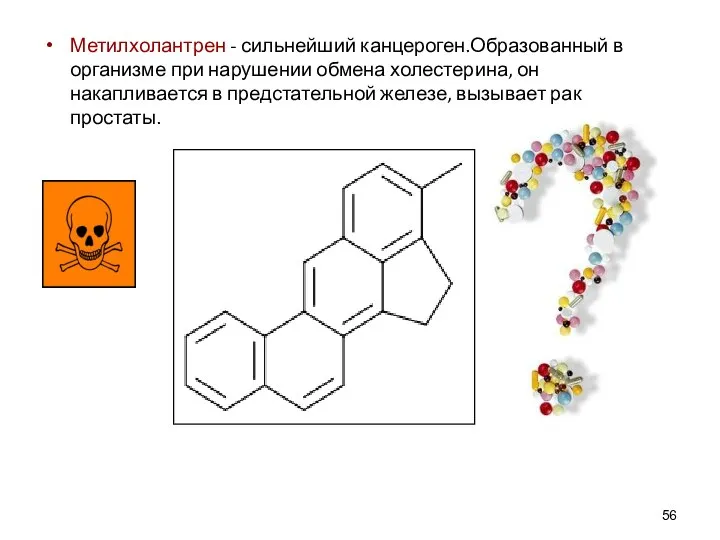
- 56. Метилхолантрен - сильнейший канцероген.Образованный в организме при нарушении обмена холестерина, он накапливается в предстательной железе, вызывает
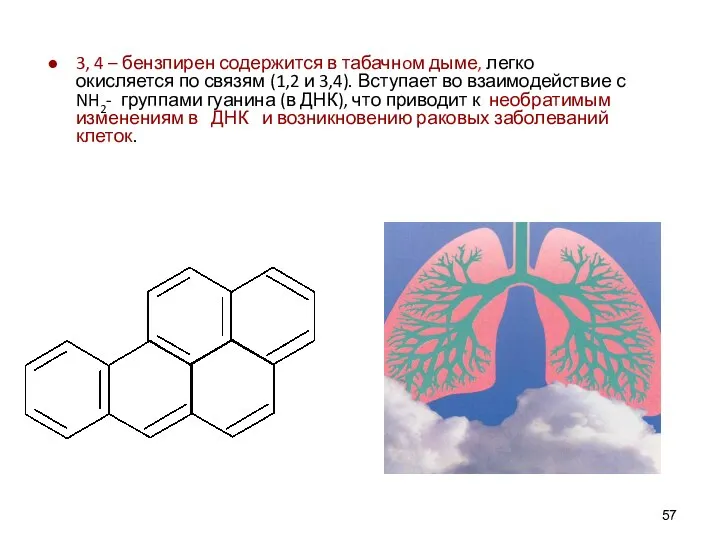
- 57. 3, 4 – бензпирен содержится в табачнoм дыме, легко окисляется по связям (1,2 и 3,4). Вступает
- 58. Химические свойства конденсированных систем Химические свойства подобны свойствам бензола, но в связи с неполной выравненностью электронной
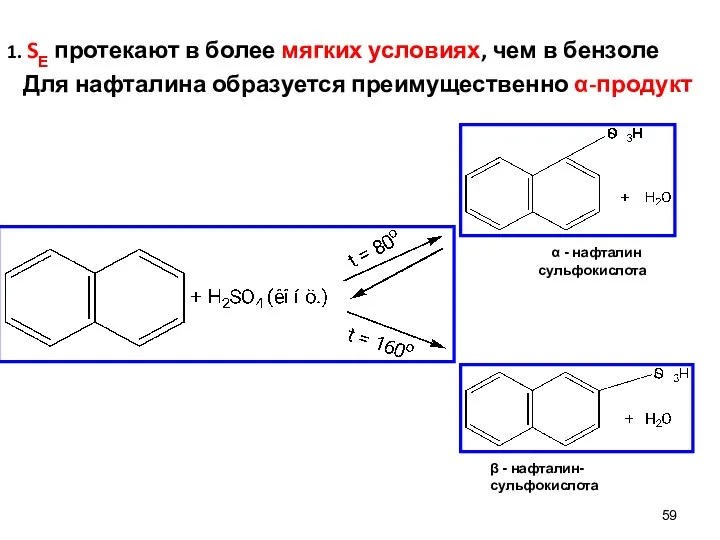
- 59. 1. SЕ протекают в более мягких условиях, чем в бензоле Для нафталина образуется преимущественно α-продукт β
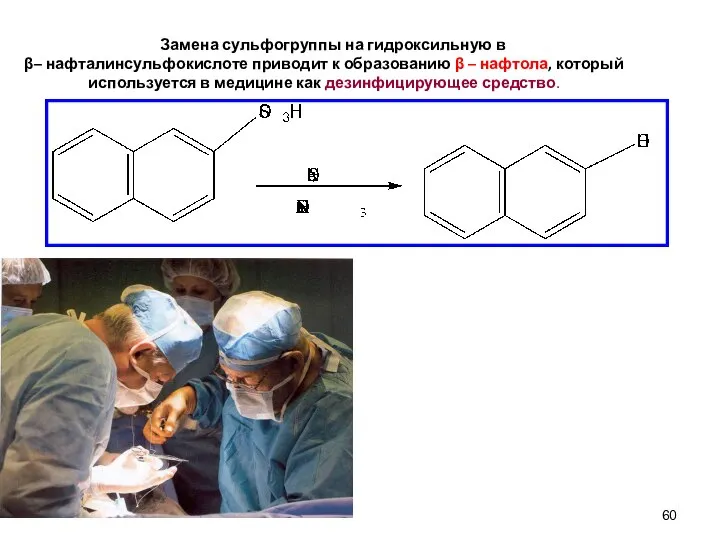
- 60. Замена сульфогруппы на гидроксильную в β– нафталинсульфокислоте приводит к образованию β – нафтола, который используется в
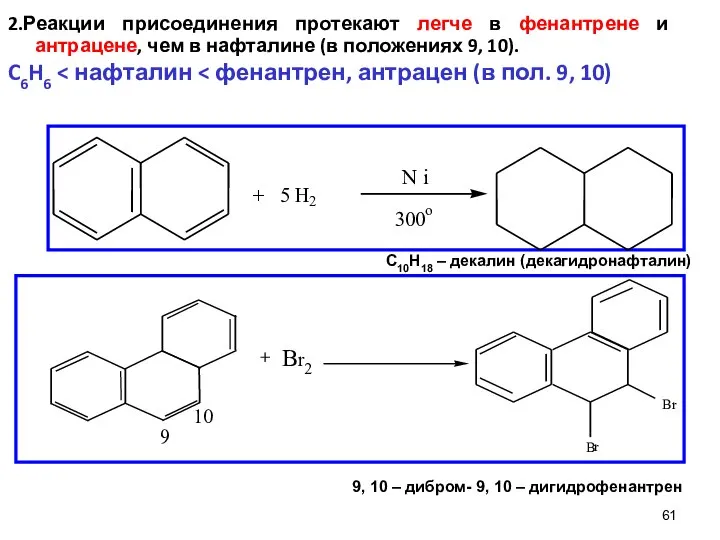
- 61. 61 2.Реакции присоединения протекают легче в фенантрене и антрацене, чем в нафталине (в положениях 9, 10).
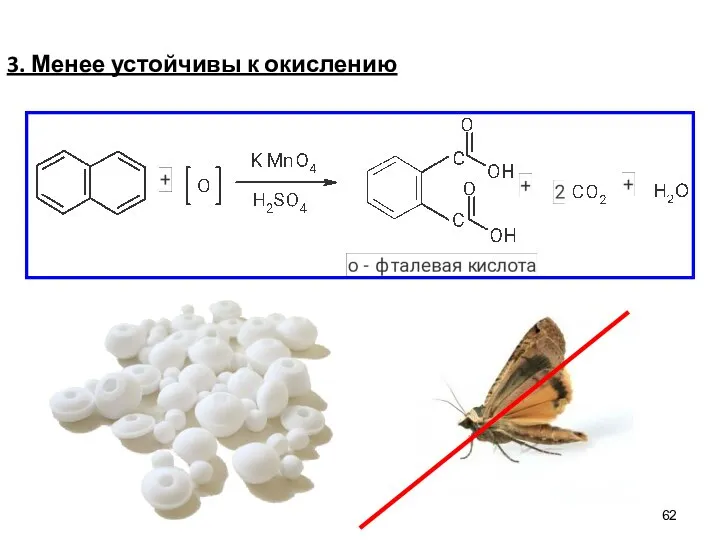
- 62. 3. Менее устойчивы к окислению
- 63. Биологически важные гетероциклические соединения
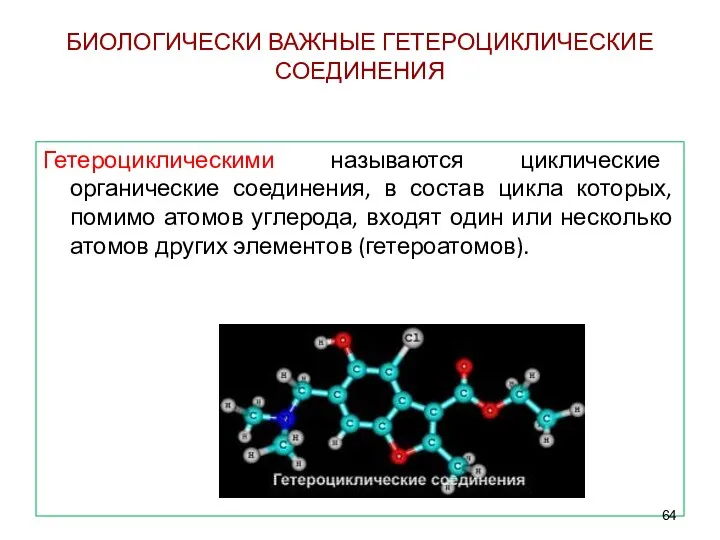
- 64. БИОЛОГИЧЕСКИ ВАЖНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ Гетероциклическими называются циклические органические соединения, в состав цикла которых, помимо атомов углерода,
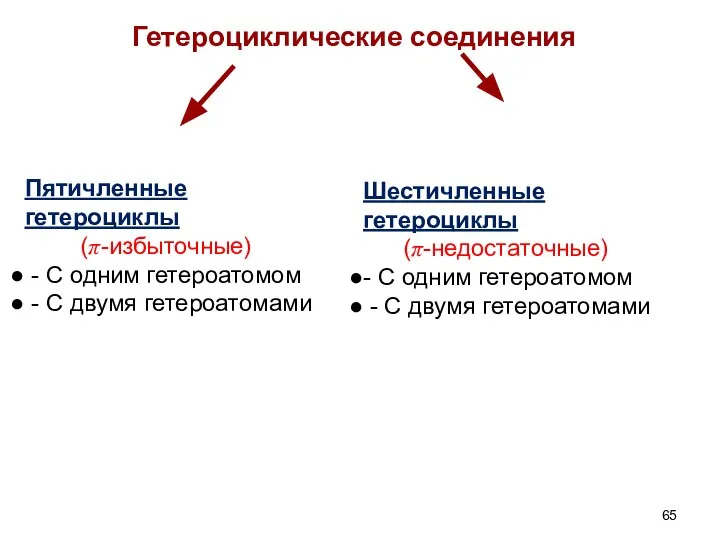
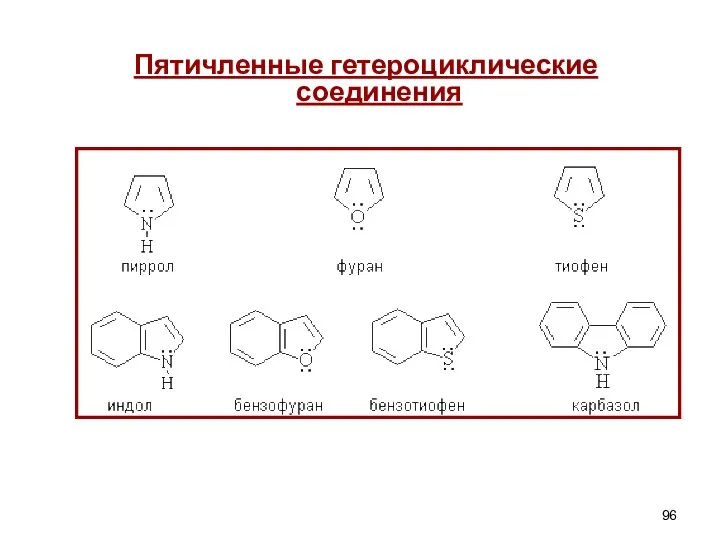
- 65. Гетероциклические соединения Пятичленные гетероциклы (π-избыточные) - С одним гетероатомом - С двумя гетероатомами Шестичленные гетероциклы (π-недостаточные)
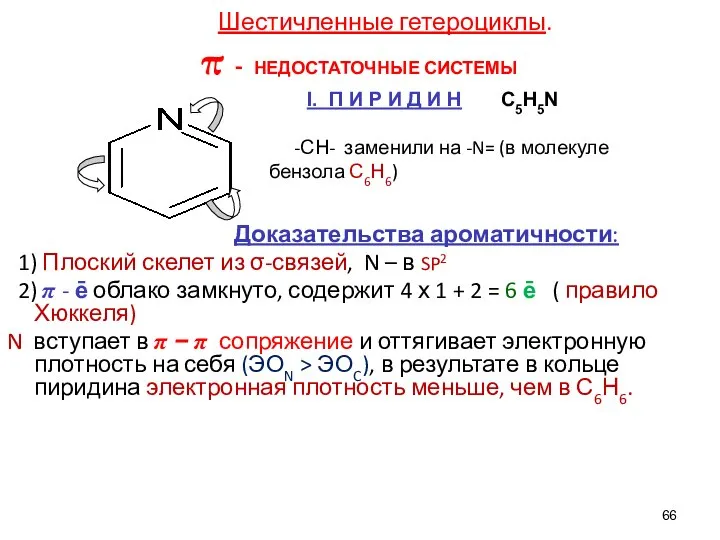
- 66. Шестичленные гетероциклы. π - НЕДОСТАТОЧНЫЕ СИСТЕМЫ -СН- заменили на -N= (в молекуле бензола С6Н6) Доказательства ароматичности:
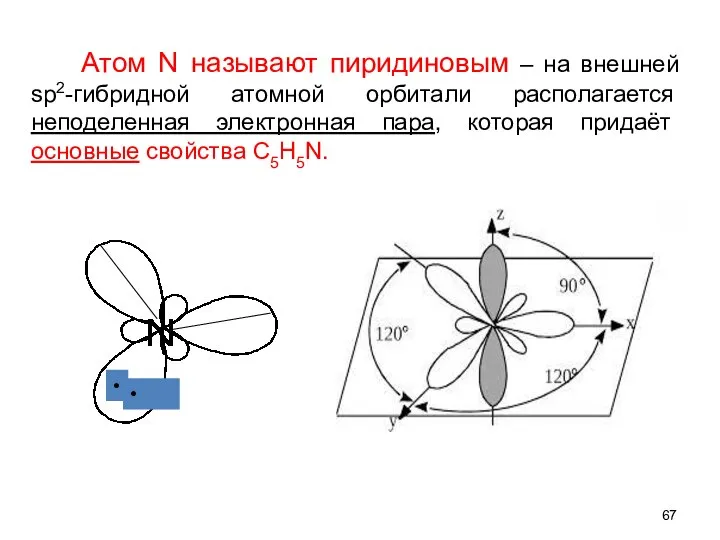
- 67. Атом N называют пиридиновым – на внешней sp2-гибридной атомной орбитали располагается неподеленная электронная пара, которая придаёт
- 68. ХИМИЧЕСКИЕ СВОЙСТВА π-недостаточных систем Реакции SЕ. Меньшая реакционная способность, новый заместитель встает в β-положение. Основные свойства
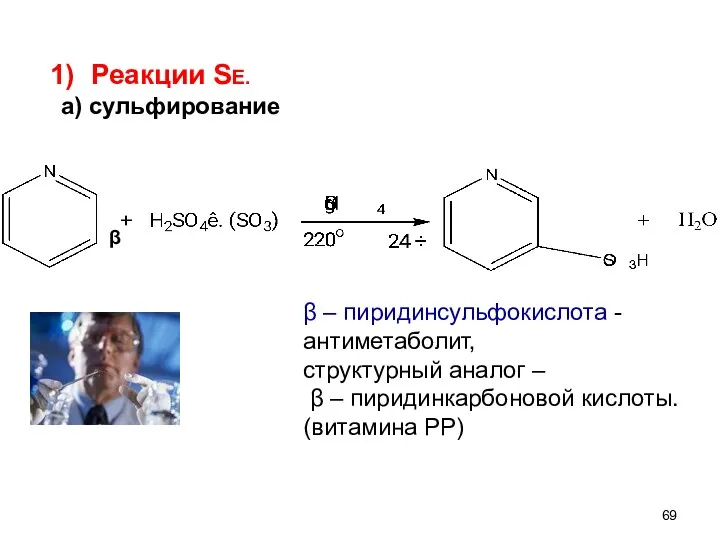
- 69. β β – пиридинсульфокислота - антиметаболит, структурный аналог – β – пиридинкарбоновой кислоты. (витамина РР) Реакции
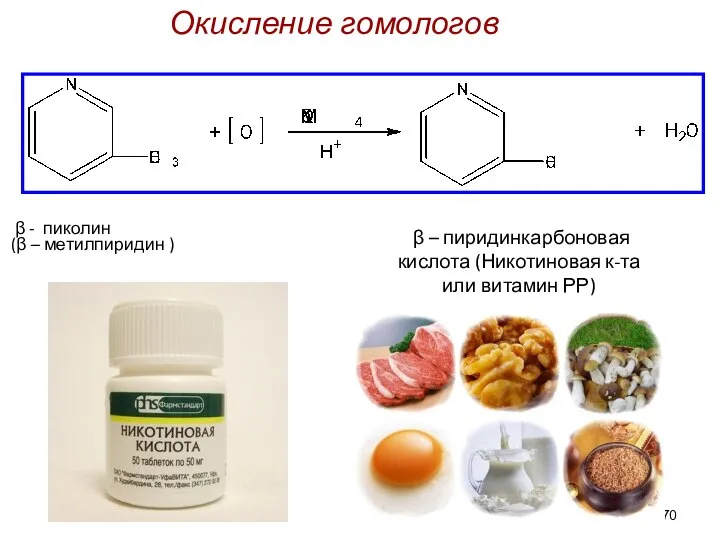
- 70. β – пиридинкарбоновая кислота (Никотиновая к-та или витамин РР) β - пиколин (β – метилпиридин )
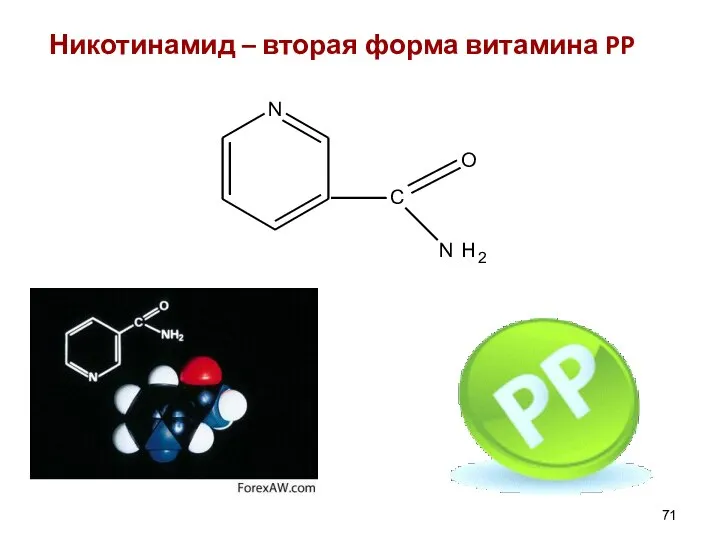
- 71. Никотинамид – вторая форма витамина PP
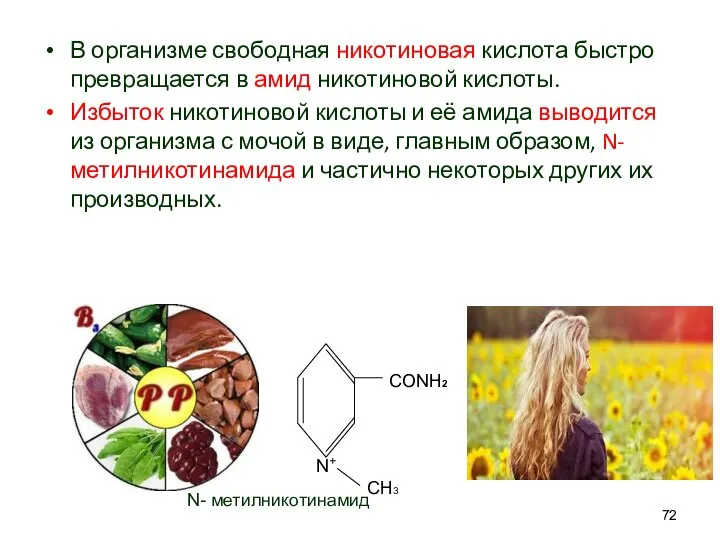
- 72. В организме свободная никотиновая кислота быстро превращается в амид никотиновой кислоты. Избыток никотиновой кислоты и её
- 73. Амид никотиновой кислоты применяется в медицине как лекарственное средство при таких заболеваниях как: Диабет. Способно в
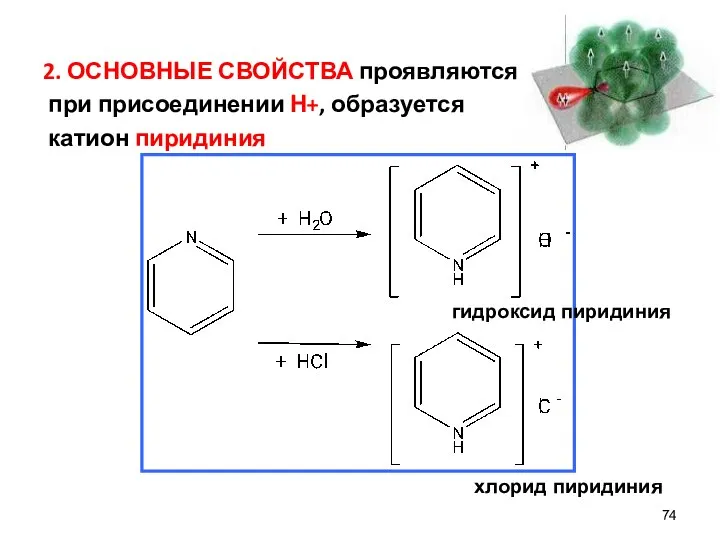
- 74. 2. ОСНОВНЫЕ СВОЙСТВА проявляются при присоединении Н+, образуется катион пиридиния гидроксид пиридиния хлорид пиридиния
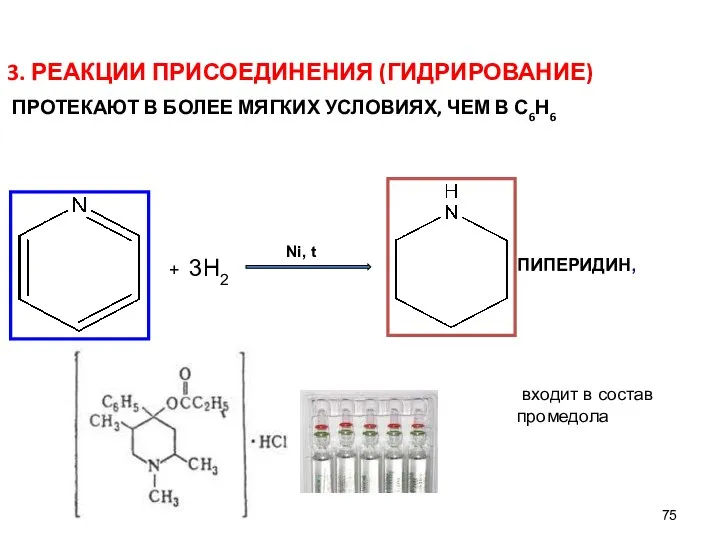
- 75. 3. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (ГИДРИРОВАНИЕ) ПРОТЕКАЮТ В БОЛЕЕ МЯГКИХ УСЛОВИЯХ, ЧЕМ В С6Н6 ПИПЕРИДИН, входит в состав
- 76. Пиперидин и пиридин Встречаются во многих алкалоидах: никотин, кониин Алкалоиды – гетероциклические азотсодержащие основания растительного происхождения,
- 77. Кониин-производное пиперидина яд, выделенный из болиголова: этим веществом был отравлен Сократ
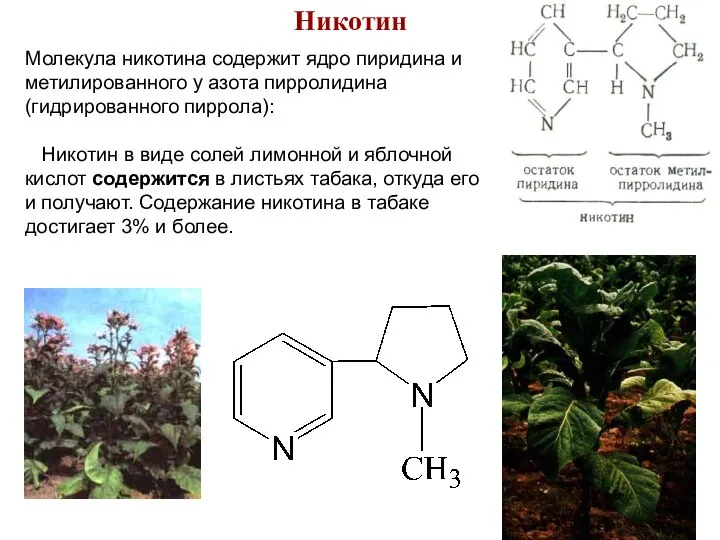
- 78. Никотин Молекула никотина содержит ядро пиридина и метилированного у азота пирролидина (гидрированного пиррола): Никотин в виде
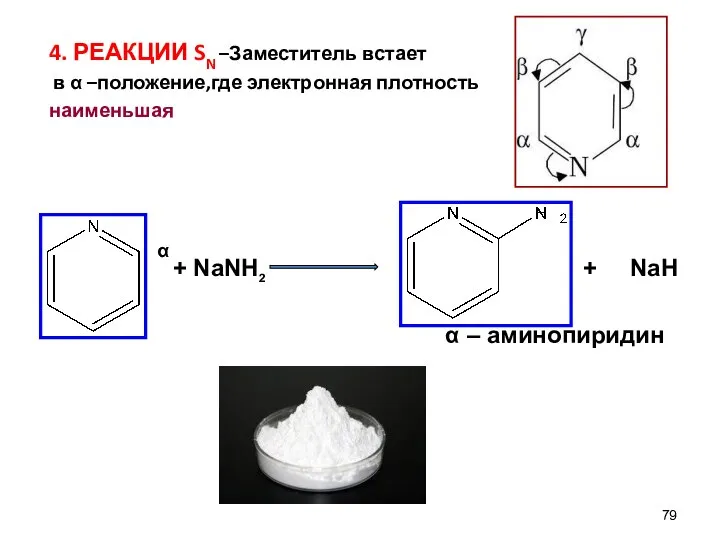
- 79. 4. РЕАКЦИИ SN –Заместитель встает в α –положение,где электронная плотность наименьшая α + NaNH2 + NaH
- 80. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВДЫХАНИЕ ПАРОВ ПИРИДИНА МОЖЕТ ПРИВЕСТИ К ТЯЖЕЛОМУ ПОРАЖЕНИЮ НЕРВНОЙ СИСТЕМЫ ГОМОЛОГ ПИРИДИНА β –
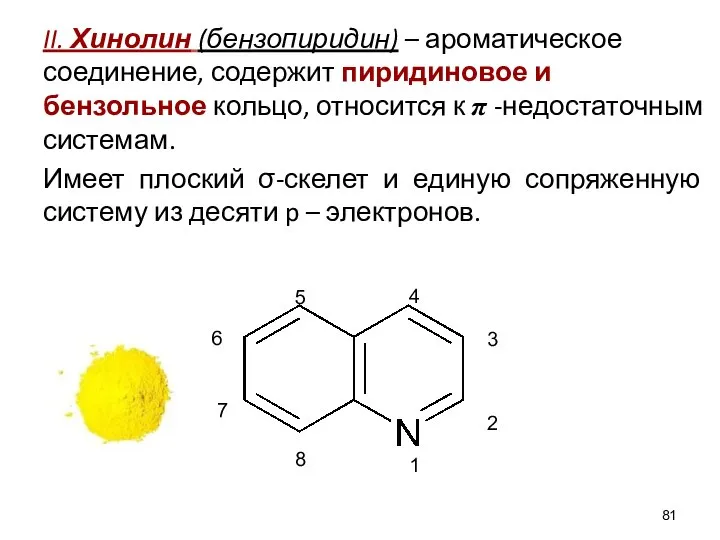
- 81. II. Хинолин (бензопиридин) – ароматическое соединение, содержит пиридиновое и бензольное кольцо, относится к π -недостаточным системам.
- 82. ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ХИНОЛИНА В реакциях SE атаке подвергается бензольное кольцо (кольцо пиридина является π –
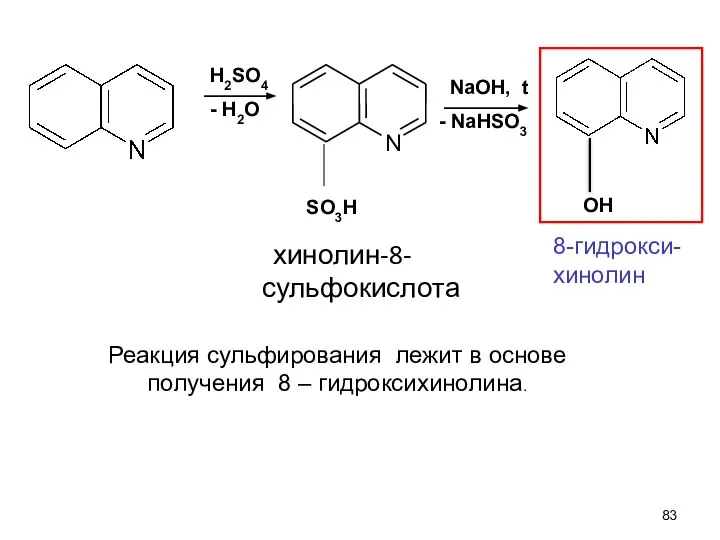
- 83. хинолин-8-сульфокислота H2SO4 - H2O NaOH, t - NaHSO3 Реакция сульфирования лежит в основе получения 8 –
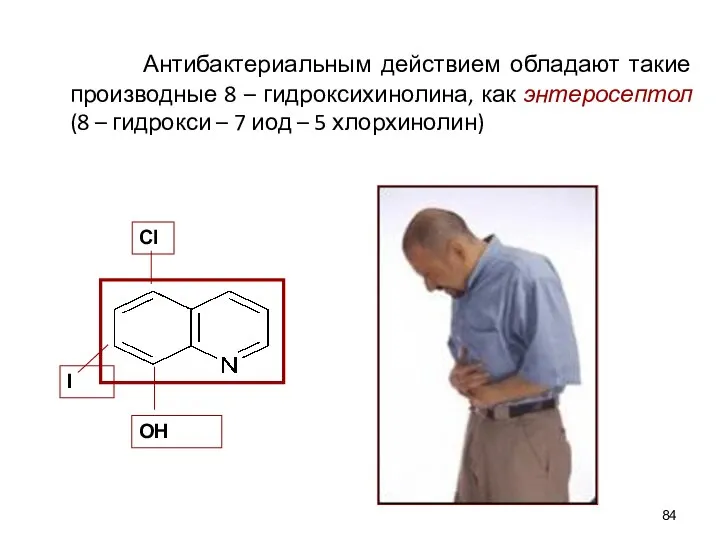
- 84. Антибактериальным действием обладают такие производные 8 – гидроксихинолина, как энтеросептол (8 – гидрокси – 7 иод
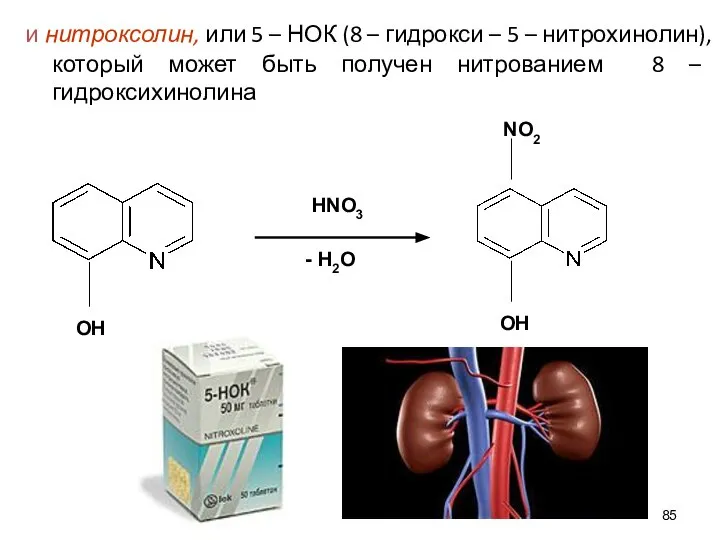
- 85. и нитроксолин, или 5 – НОК (8 – гидрокси – 5 – нитрохинолин), который может быть
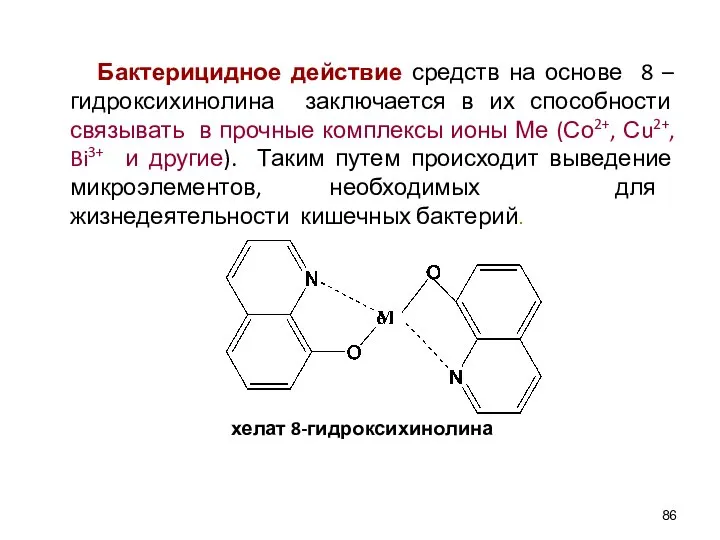
- 86. Бактерицидное действие средств на основе 8 – гидроксихинолина заключается в их способности связывать в прочные комплексы
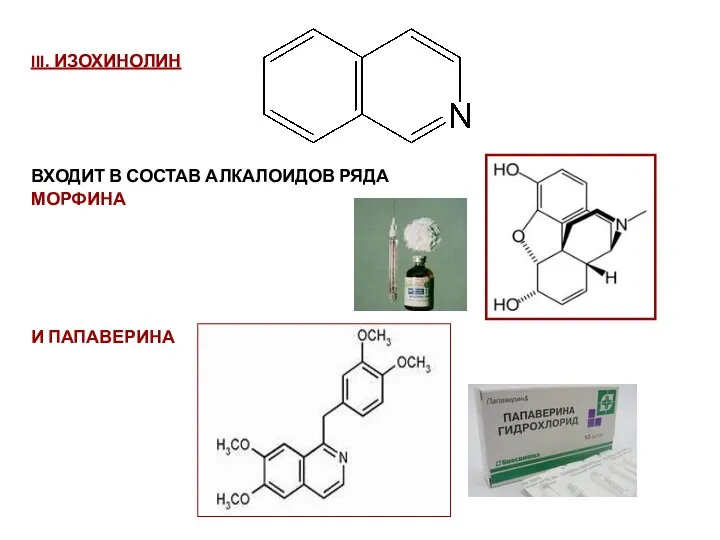
- 87. III. ИЗОХИНОЛИН ВХОДИТ В СОСТАВ АЛКАЛОИДОВ РЯДА МОРФИНА И ПАПАВЕРИНА
- 88. Применяют морфин как болеутоляющее средство при травмах и различных заболеваниях, сопровождающихся сильными болевыми ощущениями.
- 89. А так же при подготовке к операции, при бессоннице, иногда при сильном кашле.
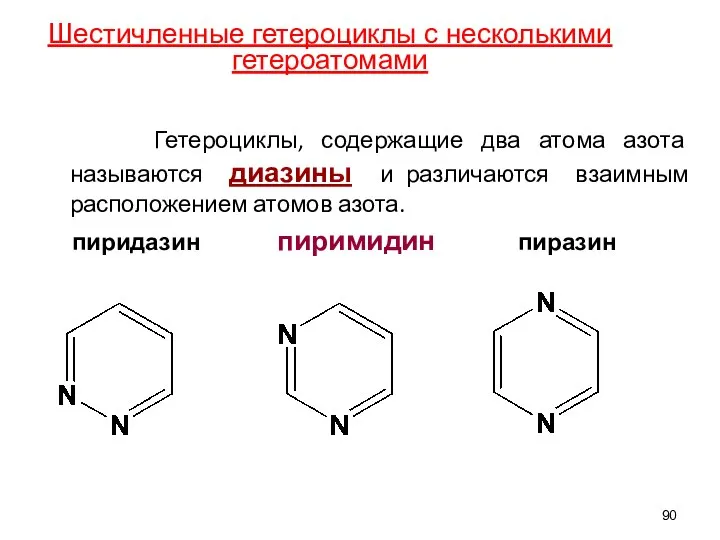
- 90. Гетероциклы, содержащие два атома азота называются диазины и различаются взаимным расположением атомов азота. пиридазин пиримидин пиразин
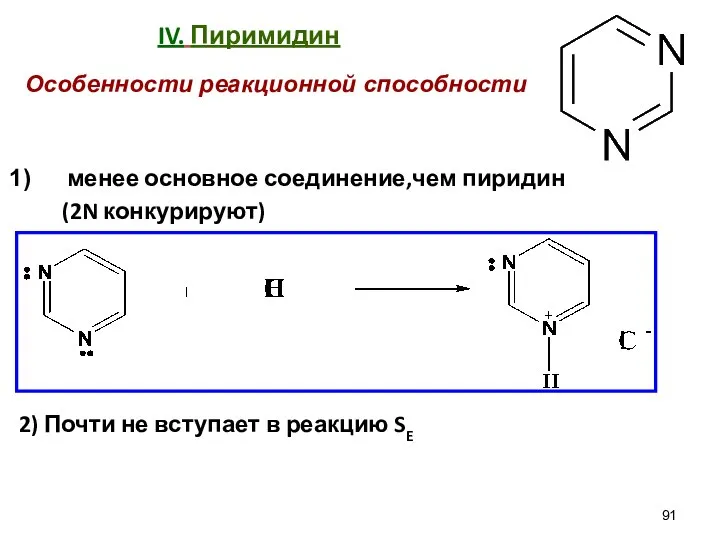
- 91. IV. Пиримидин менее основное соединение,чем пиридин (2N конкурируют) 2) Почти не вступает в реакцию SE Особенности
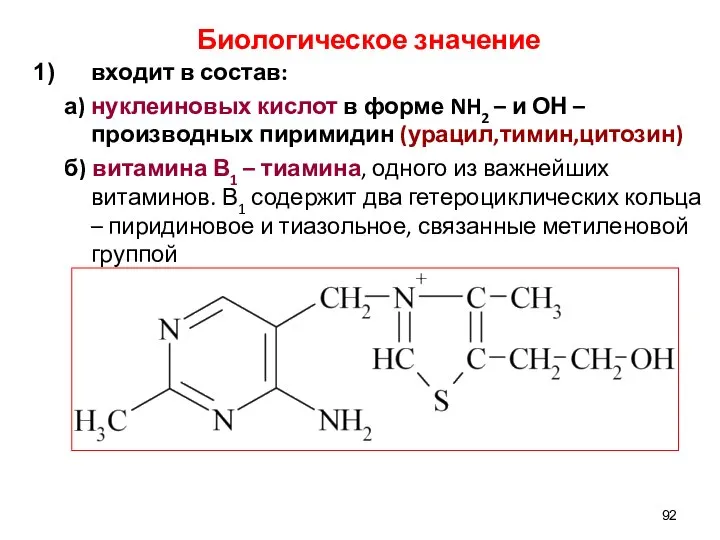
- 92. Биологическое значение входит в состав: а) нуклеиновых кислот в форме NH2 – и ОН –производных пиримидин
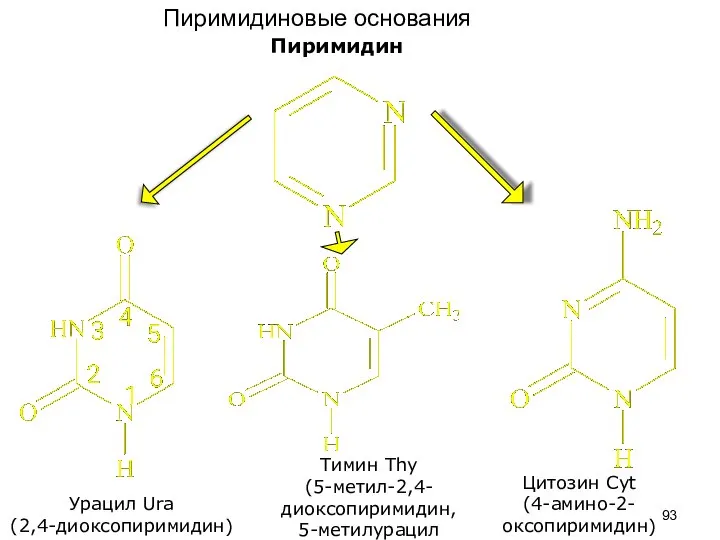
- 93. Пиримидин Урацил Ura (2,4-диоксопиримидин) Тимин Thy (5-метил-2,4-диоксопиримидин, 5-метилурацил Цитозин Cyt (4-амино-2-оксопиримидин) Пиримидиновые основания
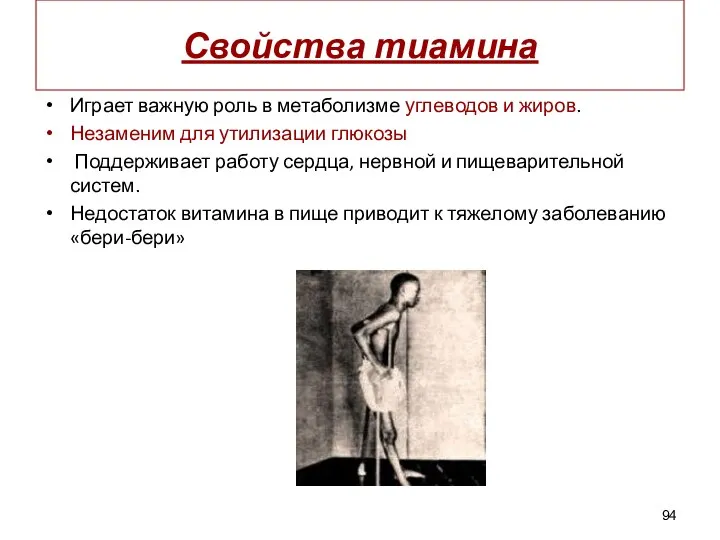
- 94. Свойства тиамина Играет важную роль в метаболизме углеводов и жиров. Незаменим для утилизации глюкозы Поддерживает работу
- 95. Источники витамина тиамина
- 96. Пятичленные гетероциклические соединения
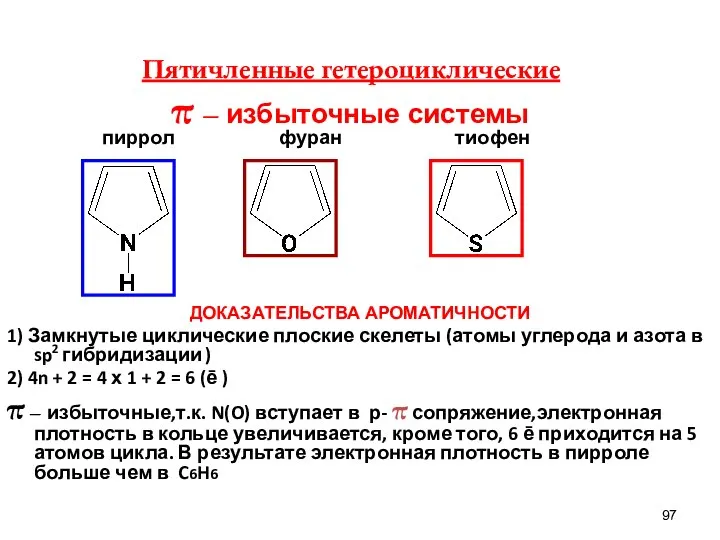
- 97. пиррол фуран тиофен ДОКАЗАТЕЛЬСТВА АРОМАТИЧНОСТИ 1) Замкнутые циклические плоские скелеты (атомы углерода и азота в sp2
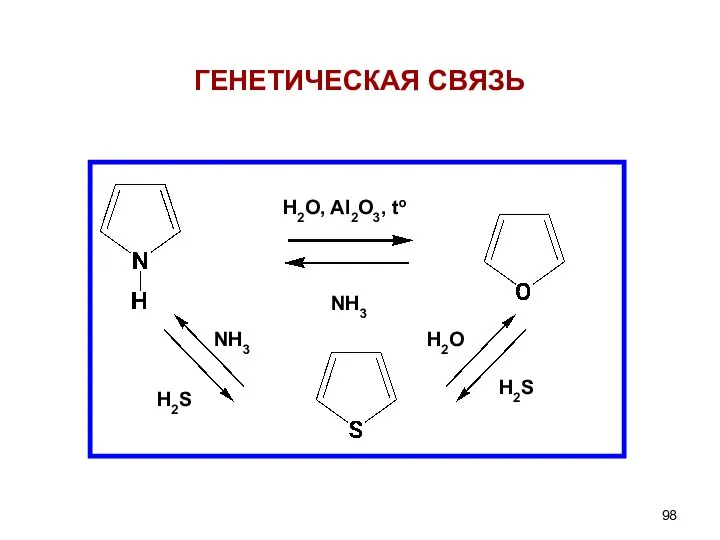
- 98. H2O, Al2O3, to NH3 H2О H2S H2S NH3 ГЕНЕТИЧЕСКАЯ СВЯЗЬ
- 99. I. ФУРАН
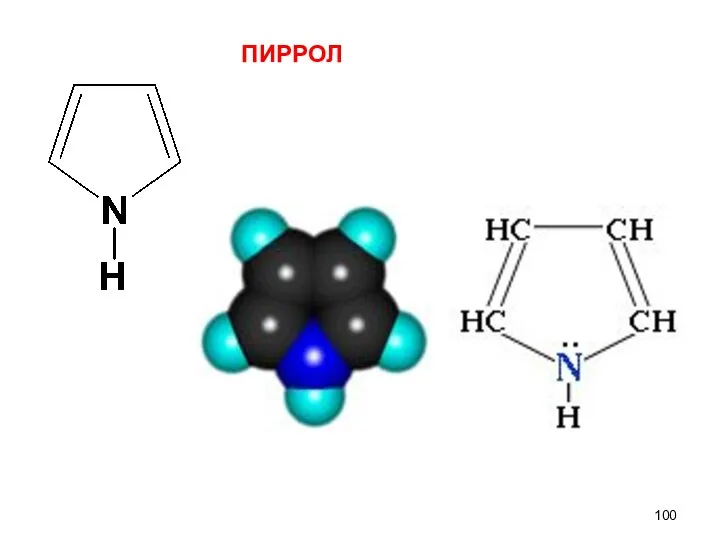
- 100. ПИРРОЛ
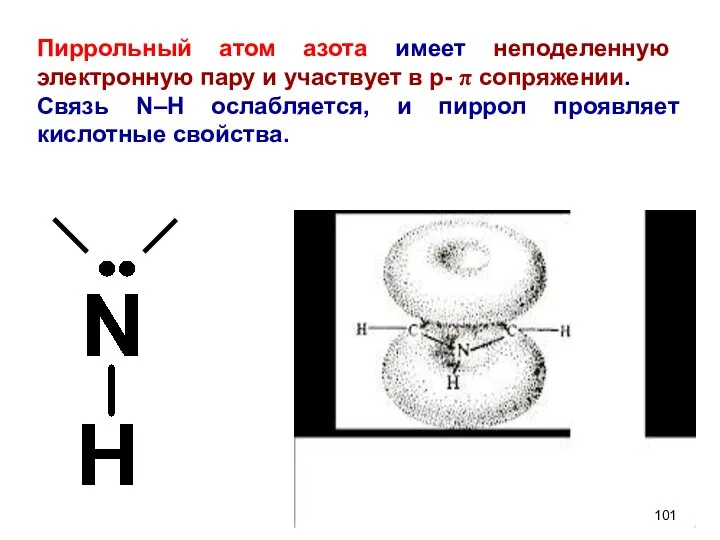
- 101. Пиррольный атом азота имеет неподеленную электронную пару и участвует в р- π сопряжении. Связь N–Н ослабляется,
- 102. ХИМИЧЕСКИЕ СВОЙСТВА π-избыточных систем 1) Реакции SЕ. Большая реакционная способность, чем у С6Н6, заместитель встает в
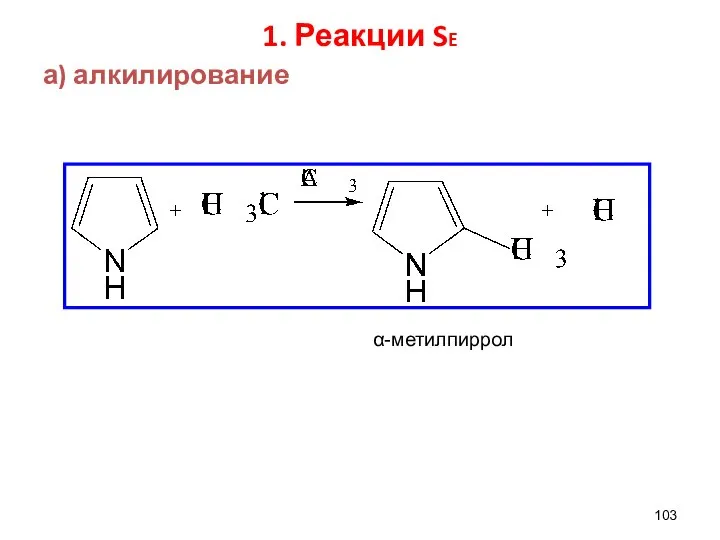
- 103. 1. Реакции SE а) алкилирование α-метилпиррол
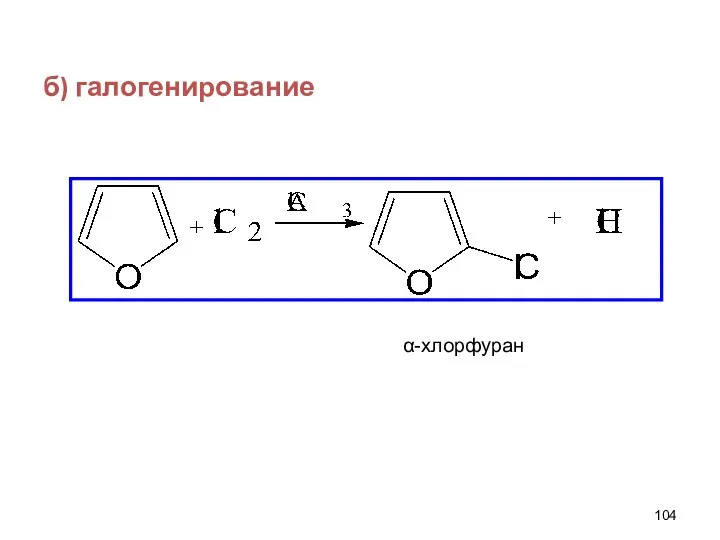
- 104. б) галогенирование α-хлорфуран
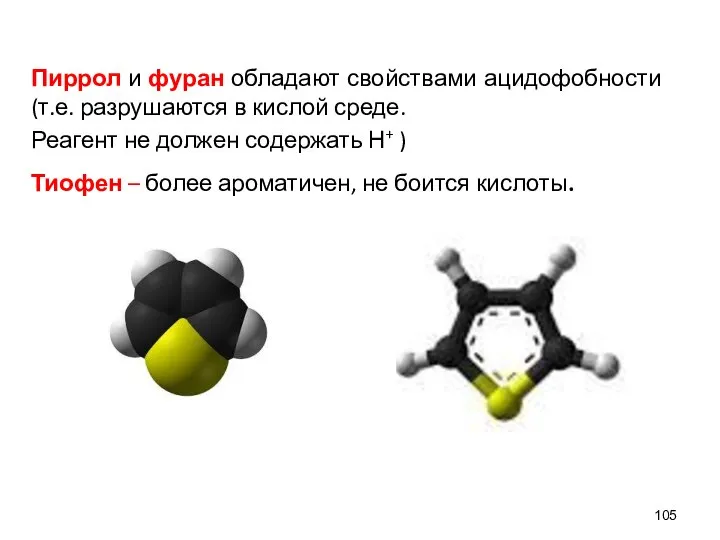
- 105. Пиррол и фуран обладают свойствами ацидофобности (т.е. разрушаются в кислой среде. Реагент не должен содержать Н+
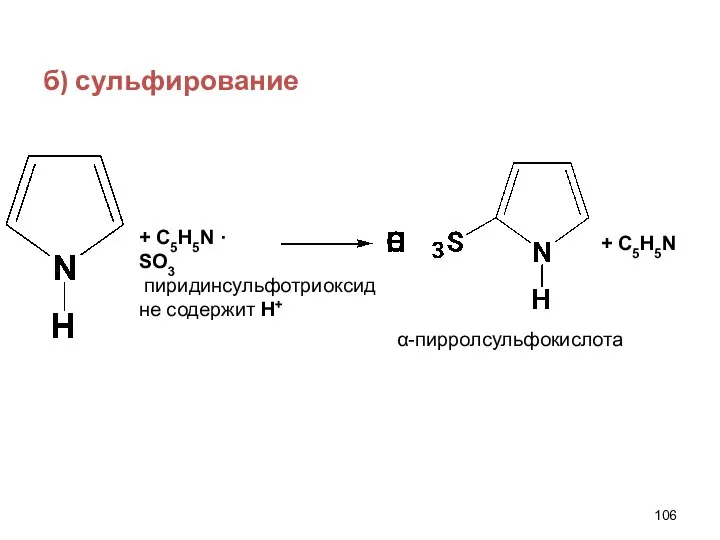
- 106. б) сульфирование + С5Н5N · SO3 + С5H5N пиридинсульфотриоксид не содержит Н+ α-пирролсульфокислота
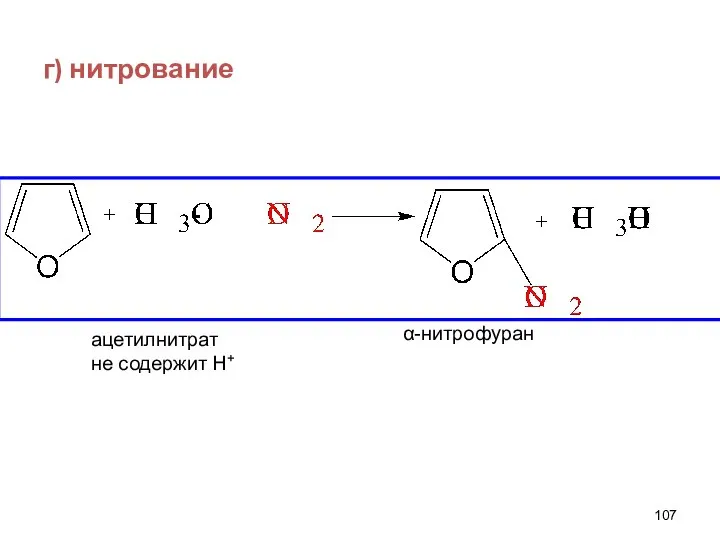
- 107. г) нитрование α-нитрофуран ацетилнитрат не содержит Н+
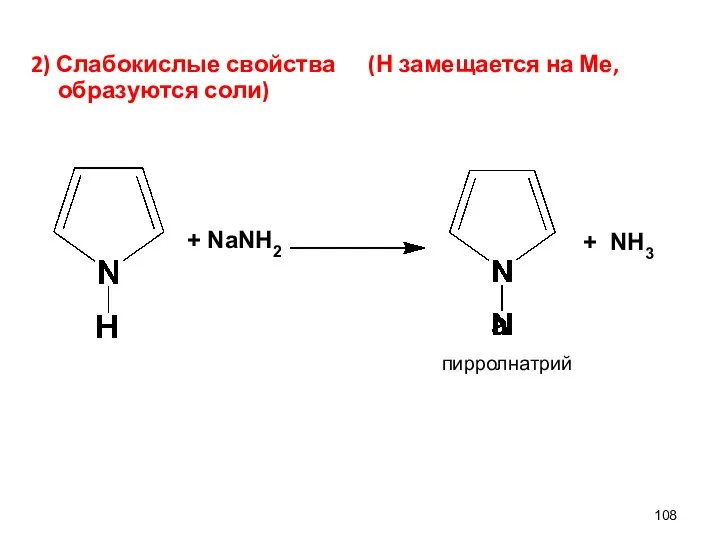
- 108. 2) Слабокислые свойства (Н замещается на Ме, образуются соли) + NaNH2 + NH3 пирролнатрий
- 109. 3) восстановление пиррола: пирролидин Входит в состав лекарственных средств, некоторых алкалоидов,α-аминокислоты пролина. 4[H]
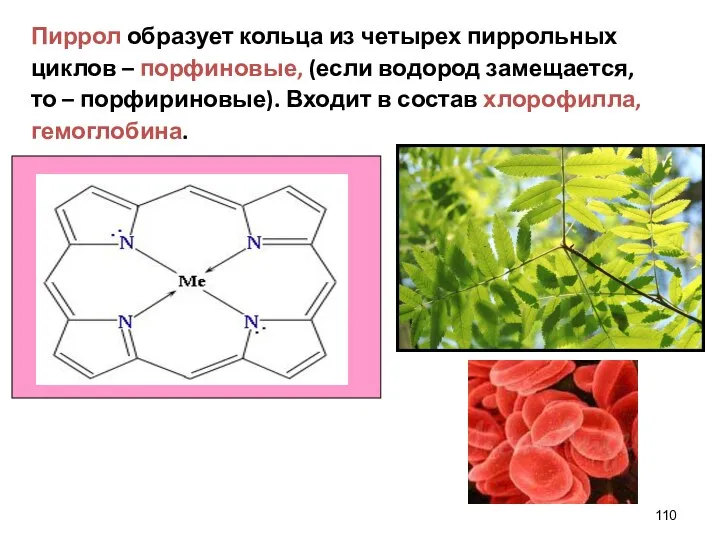
- 110. Пиррол образует кольца из четырех пиррольных циклов – порфиновые, (если водород замещается, то – порфириновые). Входит
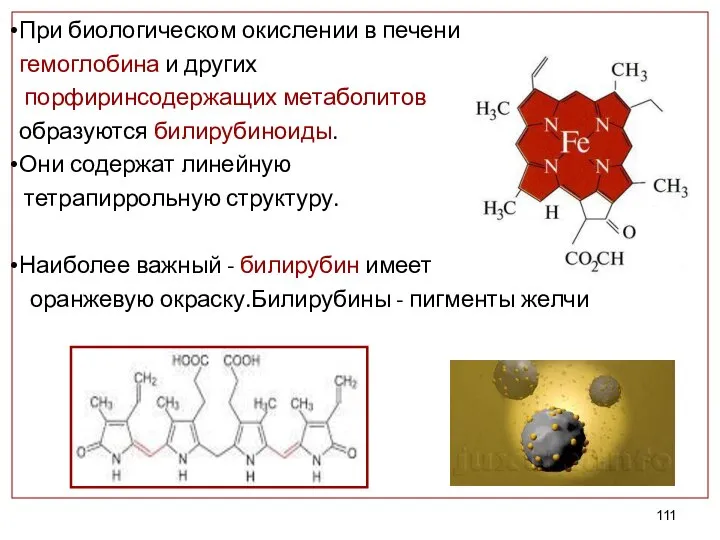
- 111. При биологическом окислении в печени гемоглобина и других порфиринсодержащих метаболитов образуются билирубиноиды. Они содержат линейную тетрапиррольную
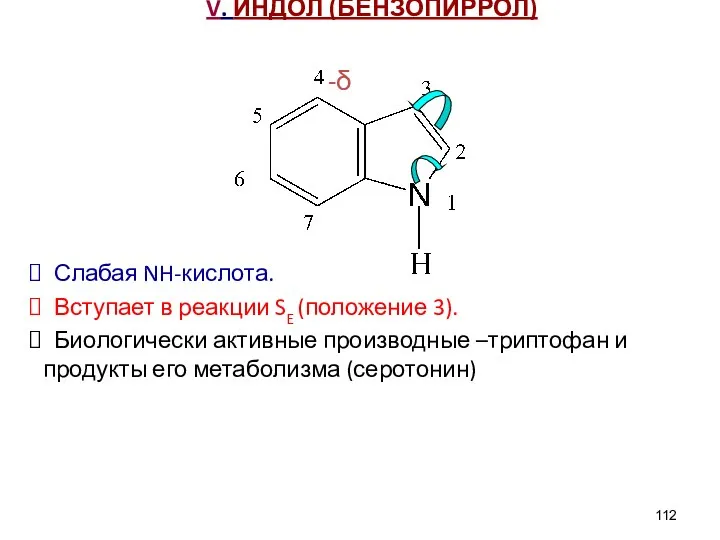
- 112. V. ИНДОЛ (БЕНЗОПИРРОЛ) -δ Слабая NH-кислота. Вступает в реакции SE (положение 3). Биологически активные производные –триптофан
- 113. БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ИНДОЛА Триптофан – α-амино-β-(β‘-индолил) пропионовая кислота. Входит в состав полипептидов растительных и животных
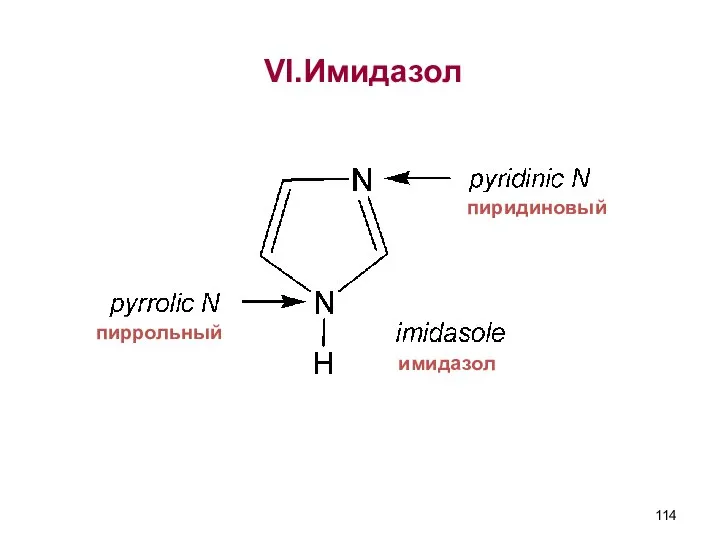
- 114. пиридиновый имидазол VI.Имидазол пиррольный
- 115. Имидазол - амфотерное соединение 1. Проявляет слабокислотные свойства за счет пиррольного N 2. Слабоосновные – за
- 116. Биологически активные производные имидазола Гистидин - α-амино-β-(4(5)‘-имидазолил) пропионовая кислота. Входит в состав многих белков-глобина Участвует в
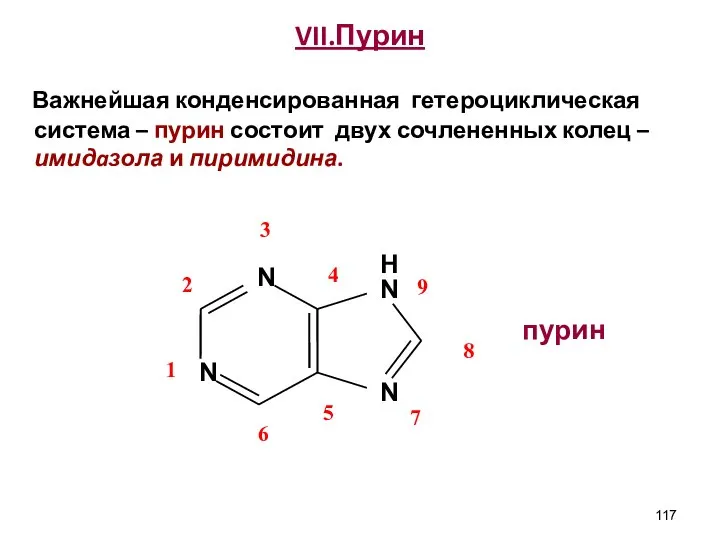
- 117. VII.Пурин Важнейшая конденсированная гетероциклическая система – пурин состоит двух сочлененных колец – имидaзола и пиримидина. пурин
- 118. Свойства пурина Устойчив к действию окислителей Хорошо растворяется в воде Амфотерен, образует соли не только с
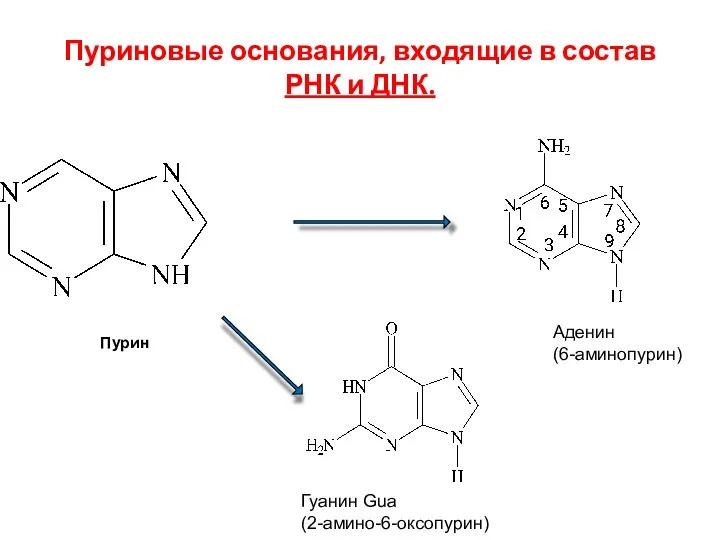
- 119. Пуриновые основания, входящие в состав РНК и ДНК. Аденин (6-аминопурин) Гуанин Gua (2-амино-6-оксопурин) Пурин
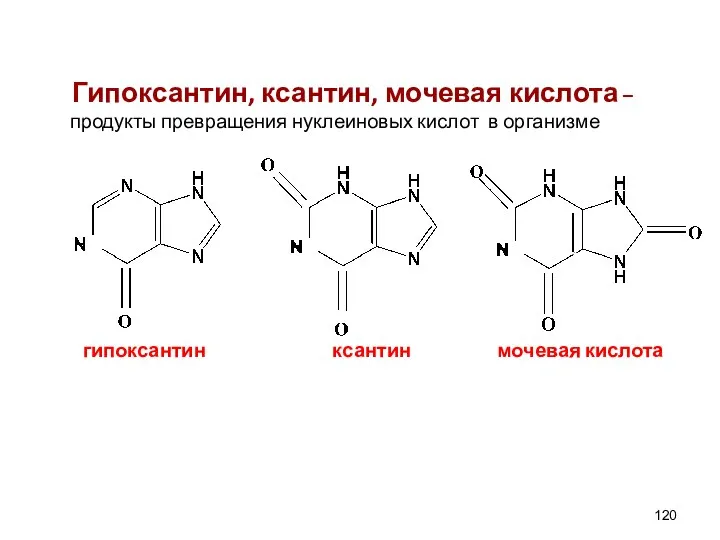
- 120. Гипоксантин, ксантин, мочевая кислота – продукты превращения нуклеиновых кислот в организме гипоксантин ксантин мочевая кислота
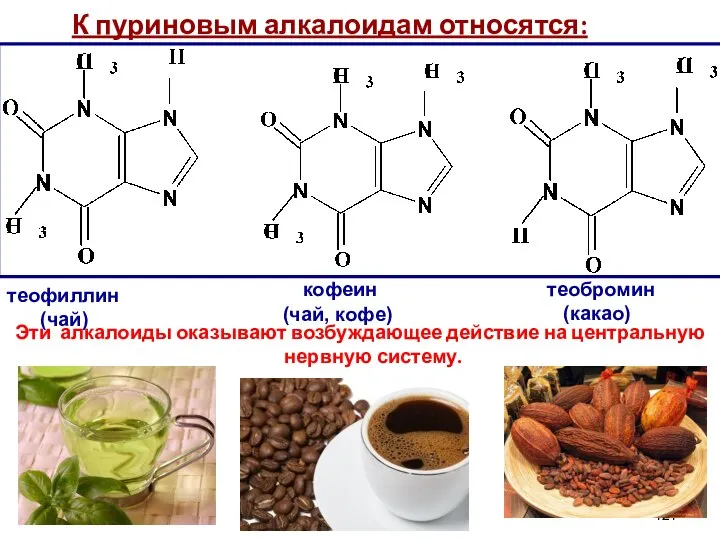
- 121. К пуриновым алкалоидам относятся: Эти алкалоиды оказывают возбуждающее действие на центральную нервную систему. теофиллин (чай) кофеин
- 122. Электронная спектроскопия (ультрафиолетовая)
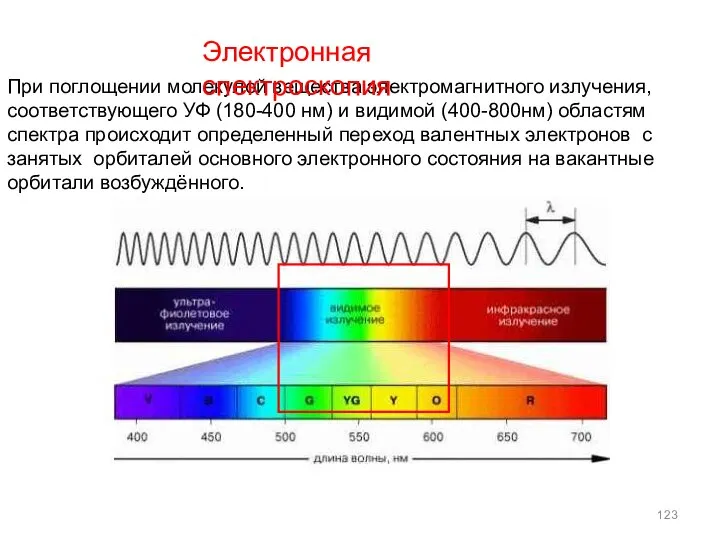
- 123. При поглощении молекулой вещества электромагнитного излучения, соответствующего УФ (180-400 нм) и видимой (400-800нм) областям спектра происходит
- 124. Большинство электронных переходов в молекулах проявляются в диапазоне 200-750 нм, который подразделяется на два поддиапазона 200-400
- 125. Энергия электронного перехода ΔЕ связана с частотой электромагнитного излучения ν и длиной волны λ соотношением ΔЕ=
- 126. σ, σ* - уровни простых σ -связей: О-Н, N-Н, С-Н, С-С, С-О, С-N, С-НаI и др.
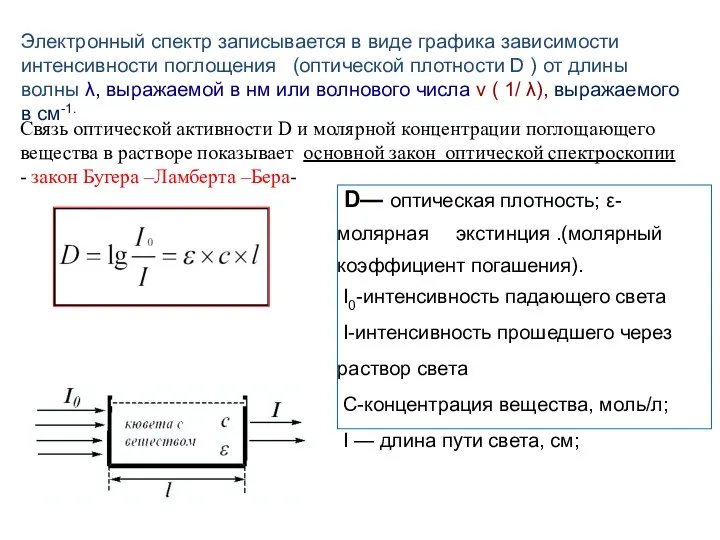
- 127. Электронный спектр записывается в виде графика зависимости интенсивности поглощения (оптической плотности D ) от длины волны
- 128. Электронные спектры поглощения в УФ- и видимой областях (называемые просто УФ-спектрами) характеризуются графиком в координатах D
- 129. Связь УФ-спектров со строением молекул Положение полос поглощения в УФ- спектре зависит от строения молекул Структурные
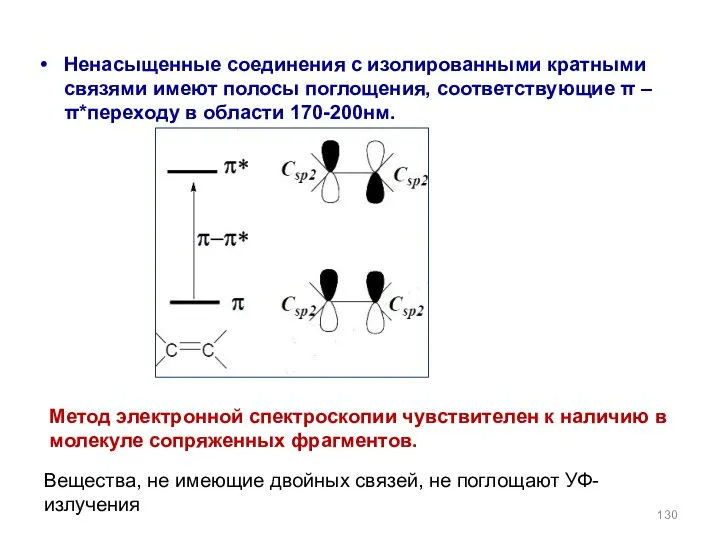
- 130. Ненасыщенные соединения с изолированными кратными связями имеют полосы поглощения, соответствующие π –π*переходу в области 170-200нм. Вещества,
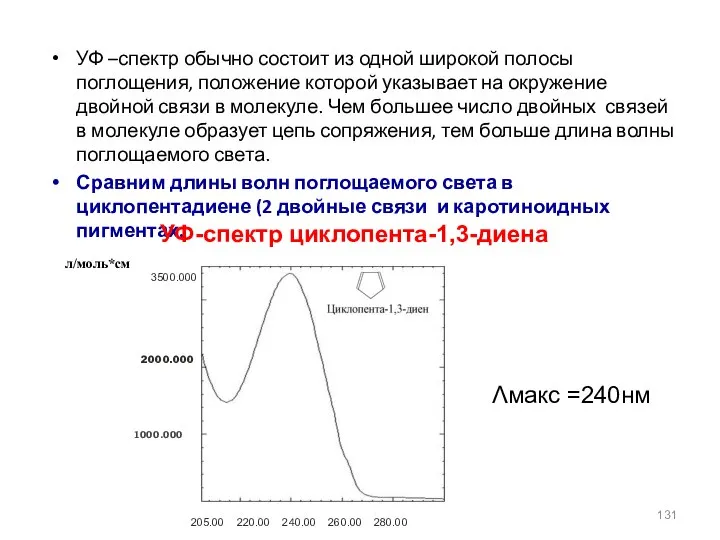
- 131. УФ –спектр обычно состоит из одной широкой полосы поглощения, положение которой указывает на окружение двойной связи
- 132. Природные каротиноидные пигменты
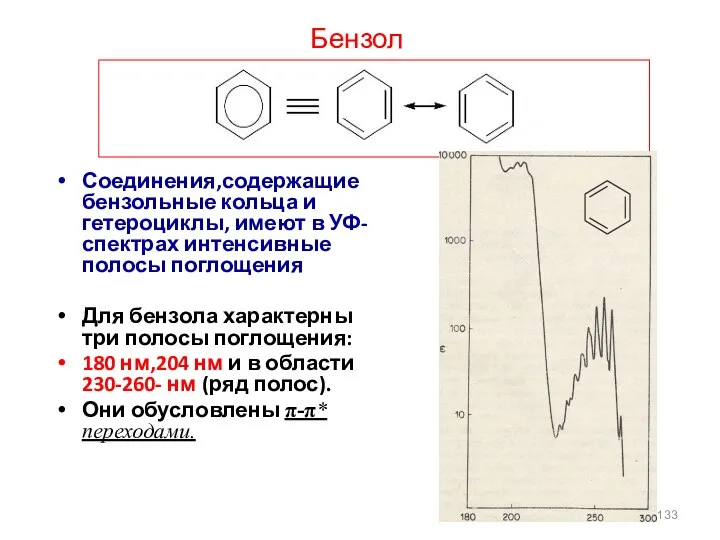
- 133. Бензол Соединения,содержащие бензольные кольца и гетероциклы, имеют в УФ-спектрах интенсивные полосы поглощения Для бензола характерны три
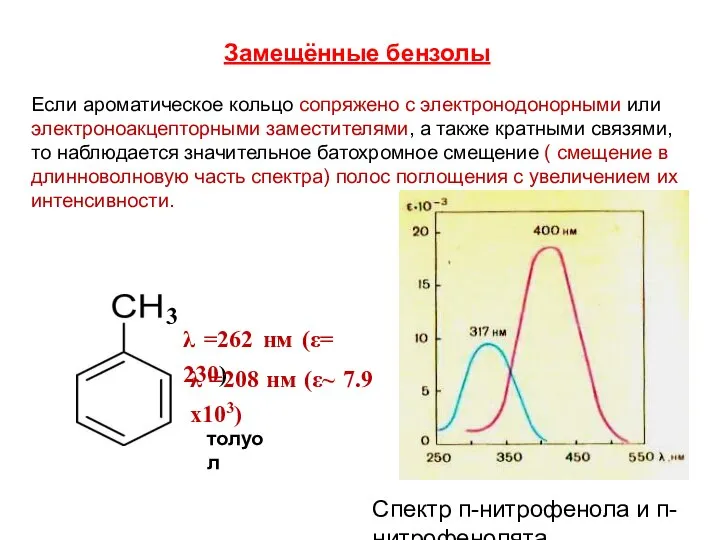
- 134. Замещённые бензолы Если ароматическое кольцо сопряжено с электронодонорными или электроноакцепторными заместителями, а также кратными связями,то наблюдается
- 135. Кроме того, возможно появление полос поглощения, обусловленных электронным переходом с вкладом внутримолекулярного переноса заряда (ВПЗ). В
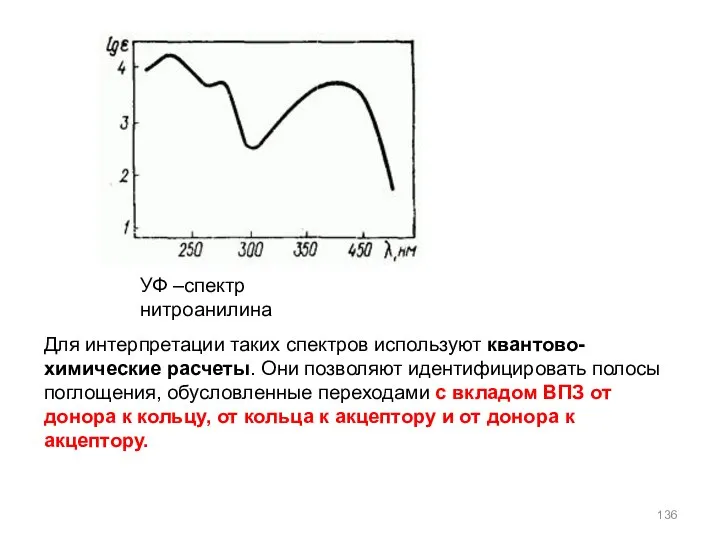
- 136. УФ –спектр нитроанилина Для интерпретации таких спектров используют квантово-химические расчеты. Они позволяют идентифицировать полосы поглощения, обусловленные
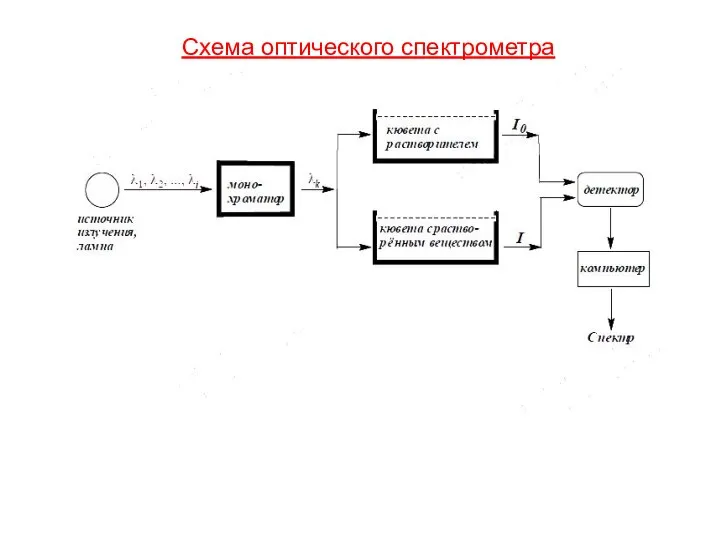
- 137. Схема оптического cпектрометра
- 138. УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр
- 139. Однолучевой спектрофотометр ЮНИКО 2800, диапазон 190-1100 нм,
- 140. Регистрация электронных спектров Рабочий диапазон спектрометров 200-750 нм. Можно регистрировать спектры газов, жидкостей и твердых тел.
- 141. Применение метода электронной спектроскопии Идентификация органических соединений-сравнение спектра исследуемого соединения со спектрами соединений известной структуры. Изучение
- 143. Скачать презентацию



























![3) восстановление пиррола: пирролидин Входит в состав лекарственных средств, некоторых алкалоидов,α-аминокислоты пролина. 4[H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1370255/slide-108.jpg)















 Ешьте, дети, йогурты. Будете здоровы?
Ешьте, дети, йогурты. Будете здоровы? Аморфные сплавы
Аморфные сплавы Александр Михайлович Бутлеров Михайлов Михаил 9 «Б»
Александр Михайлович Бутлеров Михайлов Михаил 9 «Б» Lektsia_9_Elektrokineticheskie_svoystva
Lektsia_9_Elektrokineticheskie_svoystva Цирконий. Схема получения чистого циркония
Цирконий. Схема получения чистого циркония Неметаллы. Общая характеристика и свойства неметаллов
Неметаллы. Общая характеристика и свойства неметаллов Si и силикатная промышленность
Si и силикатная промышленность Презентация по химии Введение в биоорганическую химию
Презентация по химии Введение в биоорганическую химию  Химический состав организмов
Химический состав организмов Изменения свойств химических элементов и их соединений в группах и периодах
Изменения свойств химических элементов и их соединений в группах и периодах Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям
Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям Ауыр металлдар
Ауыр металлдар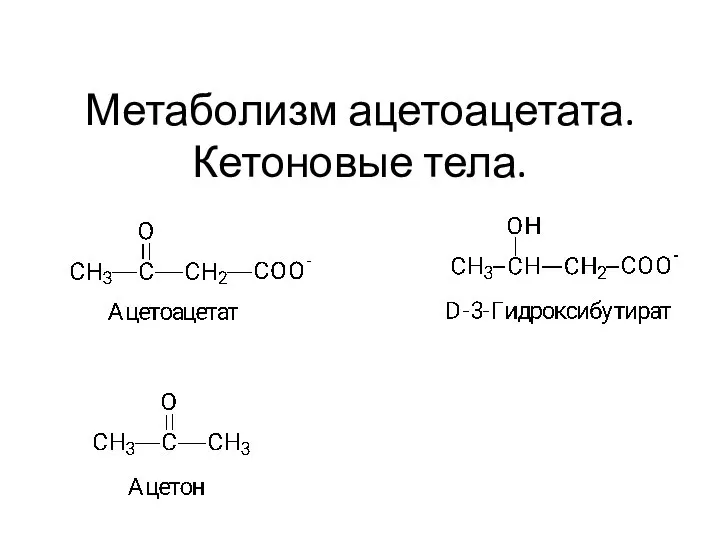 Метаболизм ацетоацетата. Кетоновые тела.Тема 10
Метаболизм ацетоацетата. Кетоновые тела.Тема 10 Факторы, влияющие на скорость ферментативных реакций
Факторы, влияющие на скорость ферментативных реакций Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер
Күрделі липидтер.Сабынданбайтын липидтер (стериндер, стероидтар) және олардың биологиялық маңызы. Терпендер Витамины и их производные-коферменты ферментов
Витамины и их производные-коферменты ферментов Алкадиены
Алкадиены Охорона довкілля від забруднень під час переробки вуглеводневої сировини
Охорона довкілля від забруднень під час переробки вуглеводневої сировини  Матриксные металлопротеиназы
Матриксные металлопротеиназы Электролитическая диссоциация. (Лекция 14)
Электролитическая диссоциация. (Лекция 14) Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Презентация по Химии "Жири" - скачать смотреть бесплатно
Презентация по Химии "Жири" - скачать смотреть бесплатно Химическая кинетика
Химическая кинетика Окислительно-восстановительное равновесие
Окислительно-восстановительное равновесие Водород
Водород Атомы, молекулы, химические элементы. Формы существования элементов в природе
Атомы, молекулы, химические элементы. Формы существования элементов в природе Теория коррозии и защиты металлов
Теория коррозии и защиты металлов