Содержание
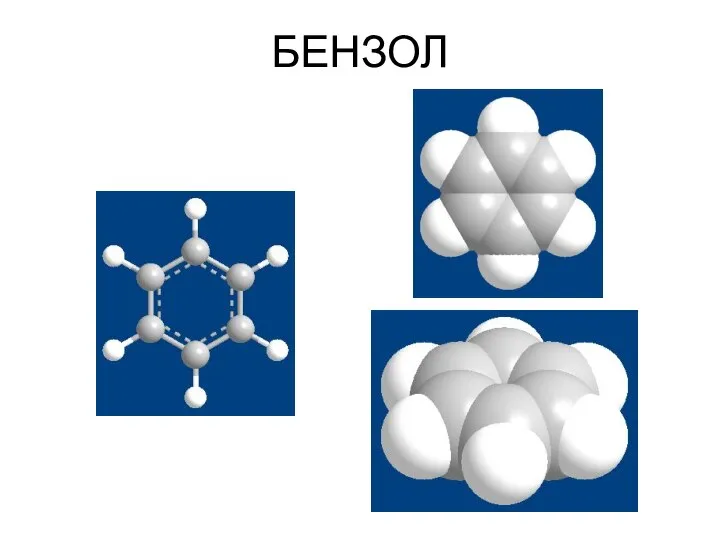
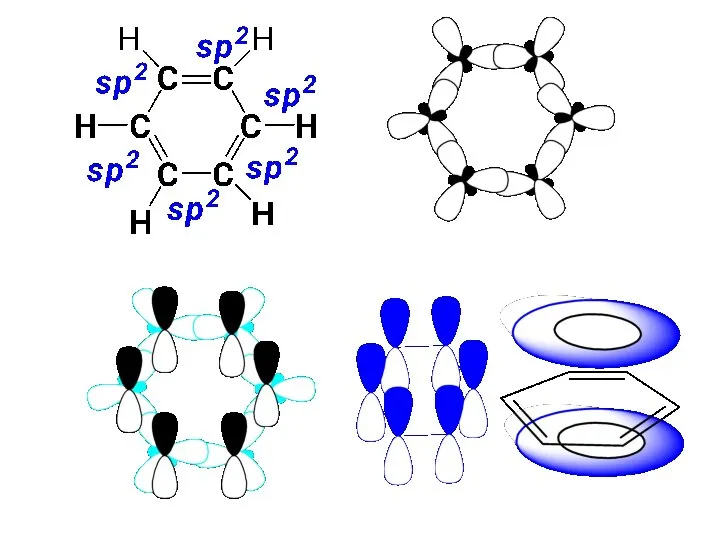
- 2. БЕНЗОЛ
- 4. Ароматичность как особое химическое качество характерно не только для бензола. Существуют соединения, не относящиеся к ряду
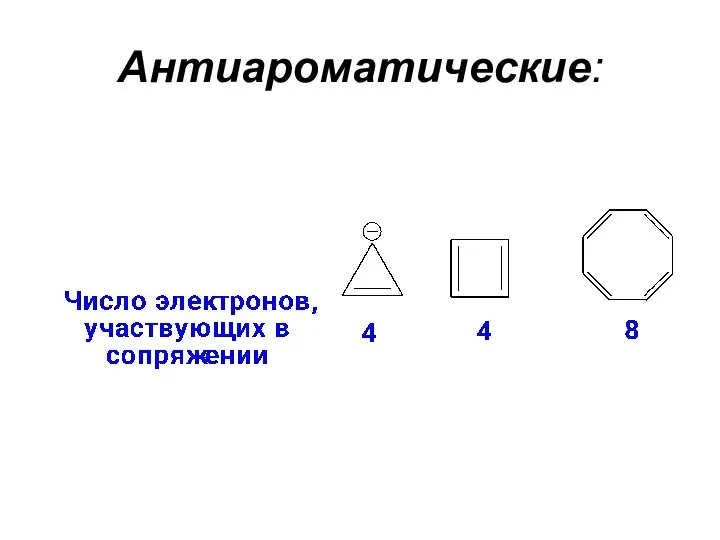
- 5. Соединения, содержащие 4n π-электронов в такой сопряженной системе , являются антиароматическими. Соединения, в которых отсутствует система
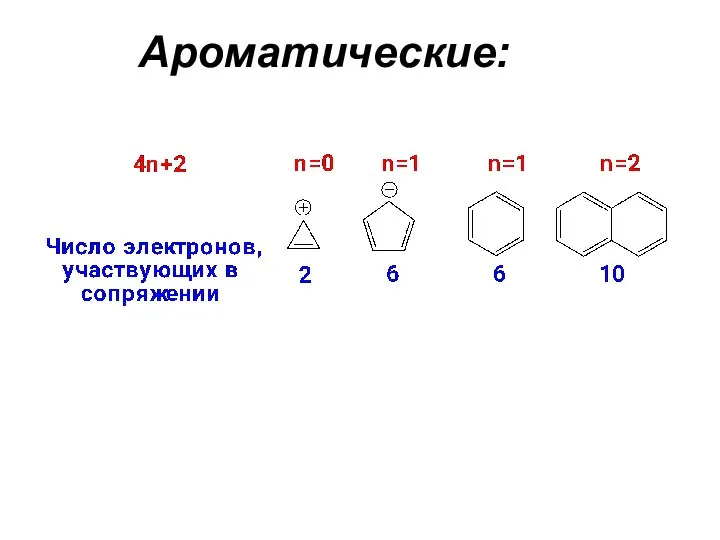
- 6. Ароматические:
- 7. Антиароматические:
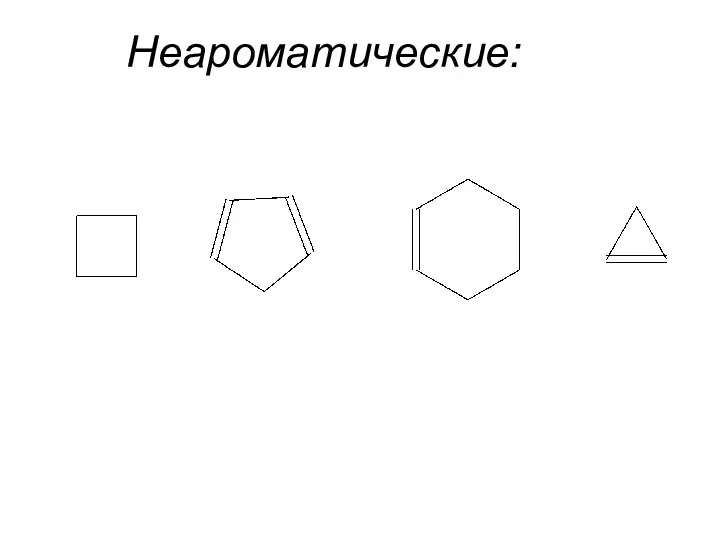
- 8. Неароматические:
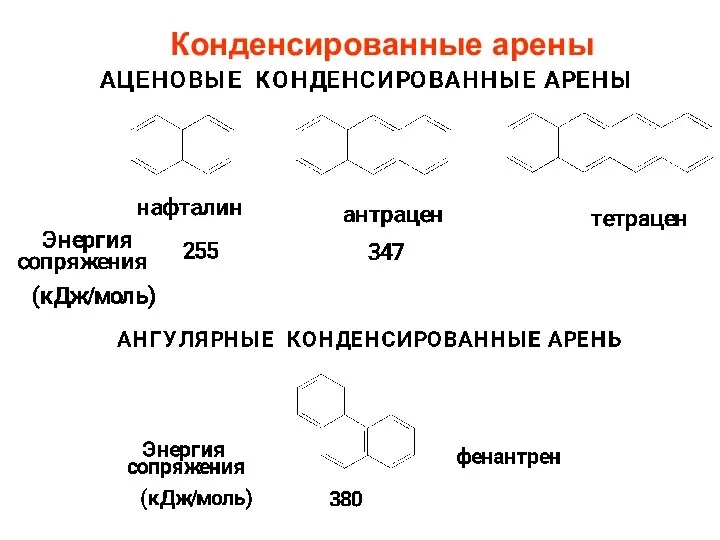
- 9. Конденсированные арены
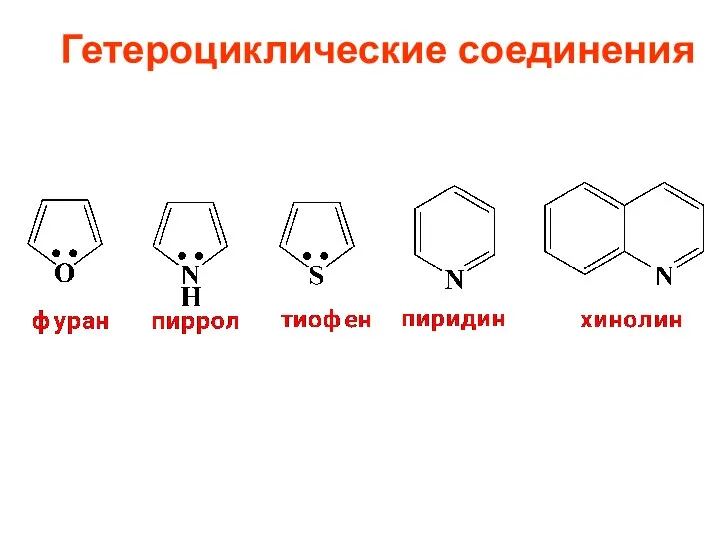
- 10. Гетероциклические соединения
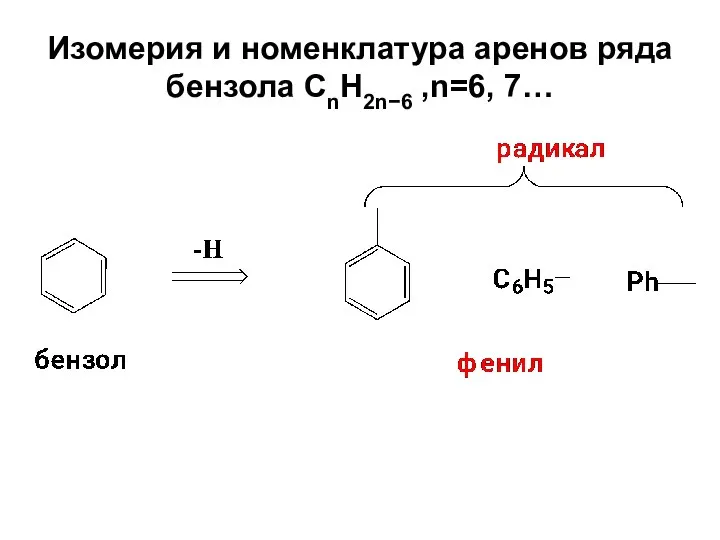
- 11. Изомерия и номенклатура аренов ряда бензола СnH2n−6 ,n=6, 7…
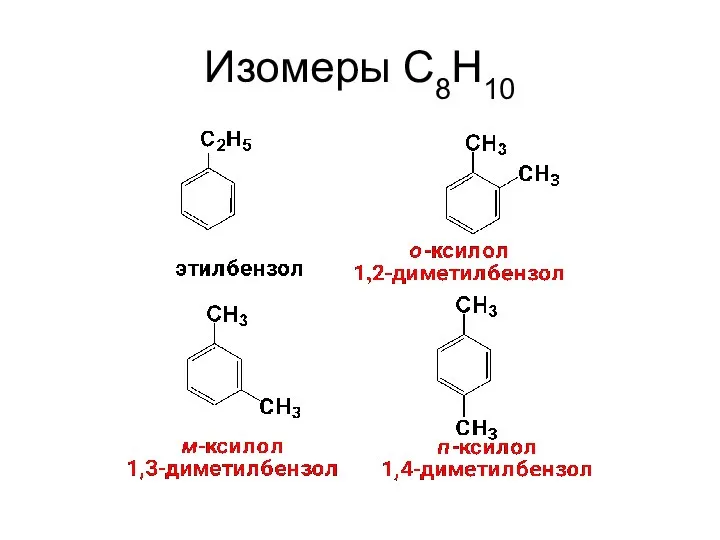
- 13. Изомеры С8Н10
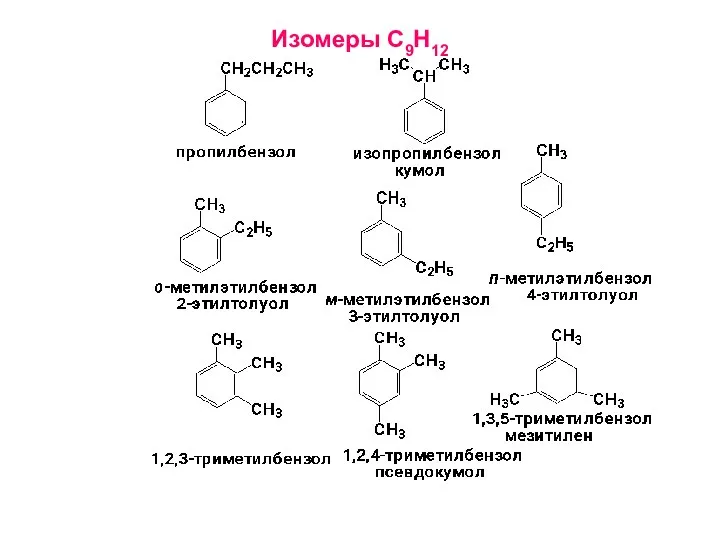
- 14. Изомеры С9Н12
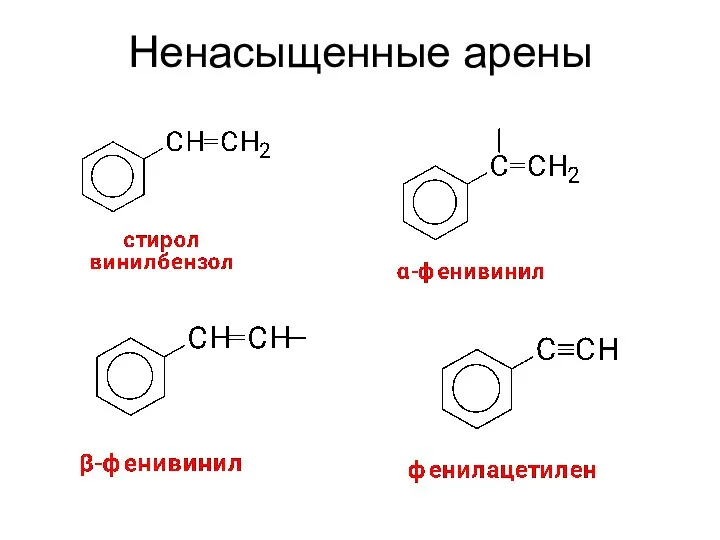
- 15. Ненасыщенные арены
- 16. СПОСОБЫ ПОЛУЧЕНИЯ Ряд промышленных способов основан на переработке угля и нефти. Из 1 т угля в
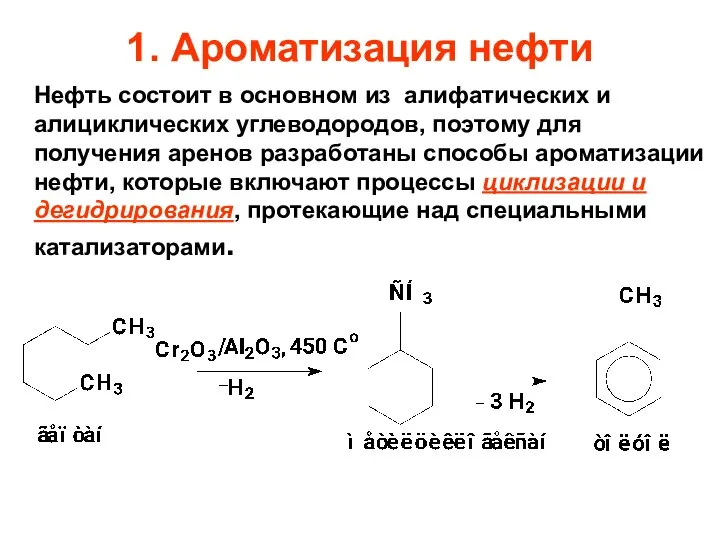
- 17. 1. Ароматизация нефти Нефть состоит в основном из алифатических и алициклических углеводородов, поэтому для получения аренов
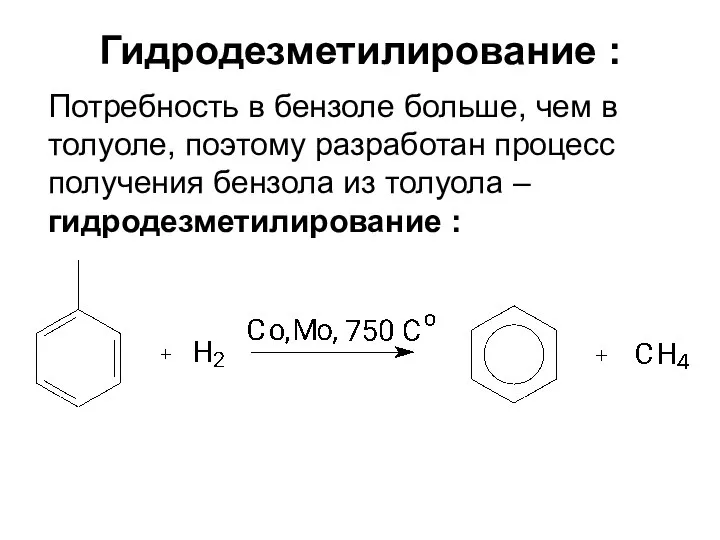
- 18. Гидродезметилирование : Потребность в бензоле больше, чем в толуоле, поэтому разработан процесс получения бензола из толуола
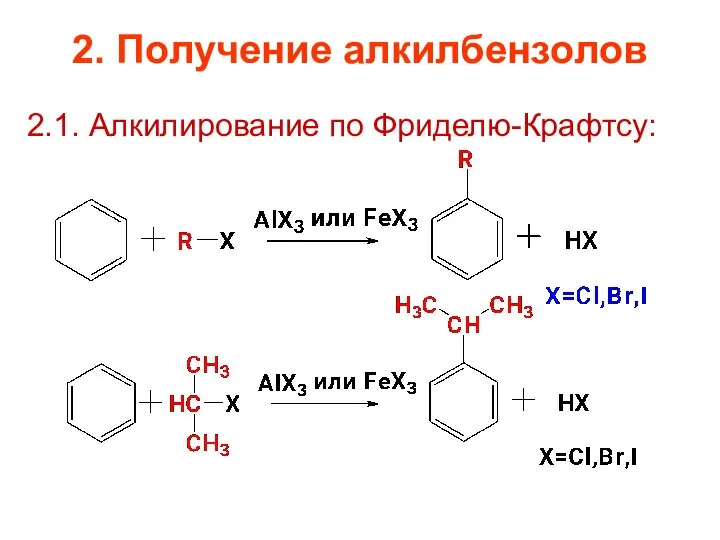
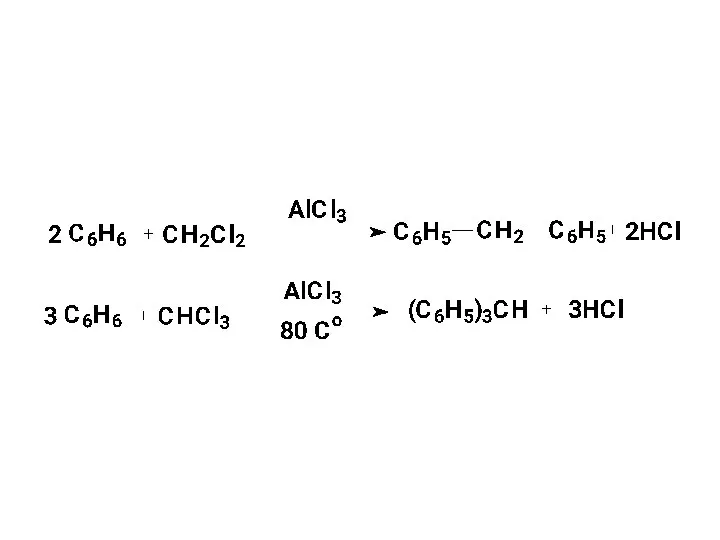
- 19. 2. Получение алкилбензолов 2.1. Алкилирование по Фриделю-Крафтсу:
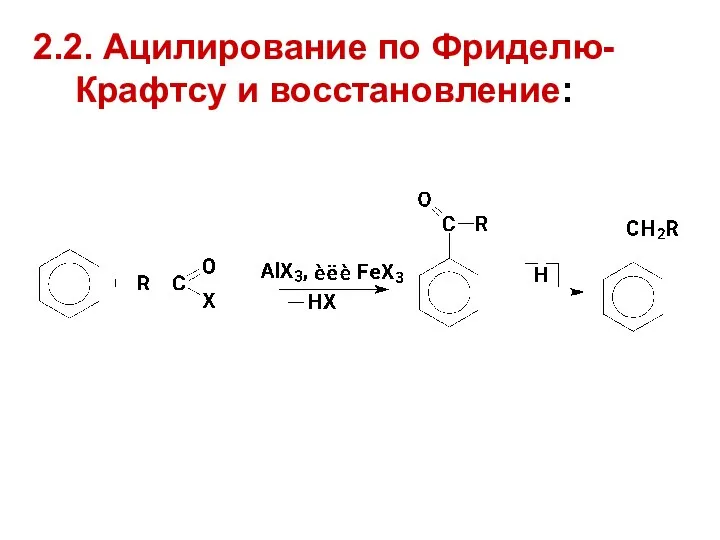
- 21. 2.2. Ацилирование по Фриделю-Крафтсу и восстановление:
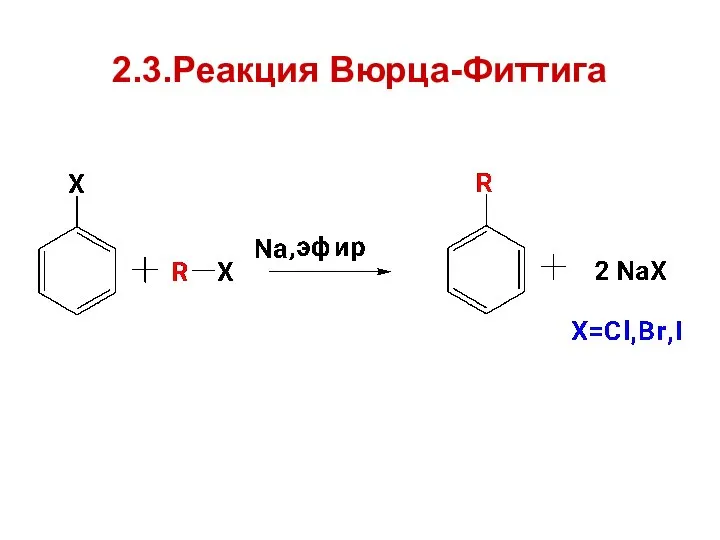
- 22. 2.3.Реакция Вюрца-Фиттига
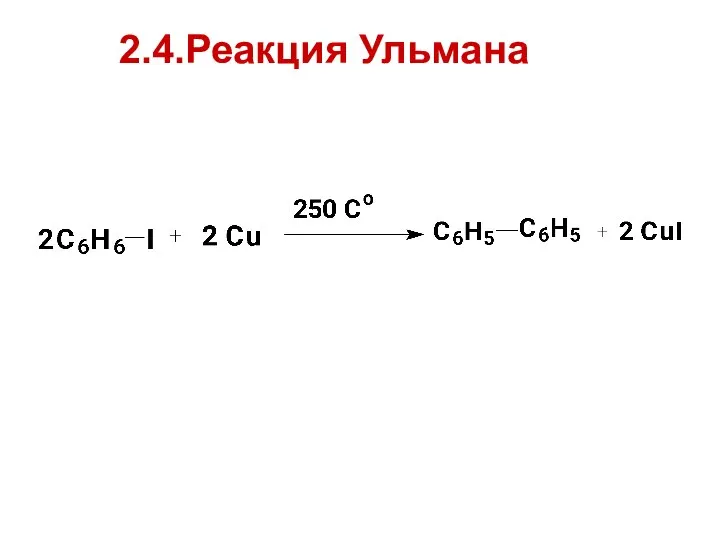
- 23. 2.4.Реакция Ульмана
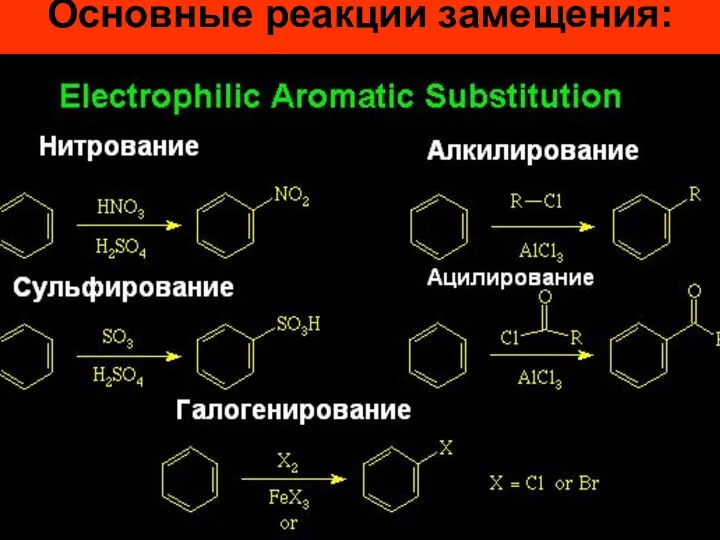
- 24. ХИМИЧЕСКИЕ СВОЙСТВА Для аренов характерны: Реакции электрофильного замещения (SЕ). Реакции бензола с нарушением ароматической системы. Реакции
- 25. Несмотря на высокую степень ненасыщенности аренов, для них не характерны реакции присоединения, свойственные алкенам и алкинам.
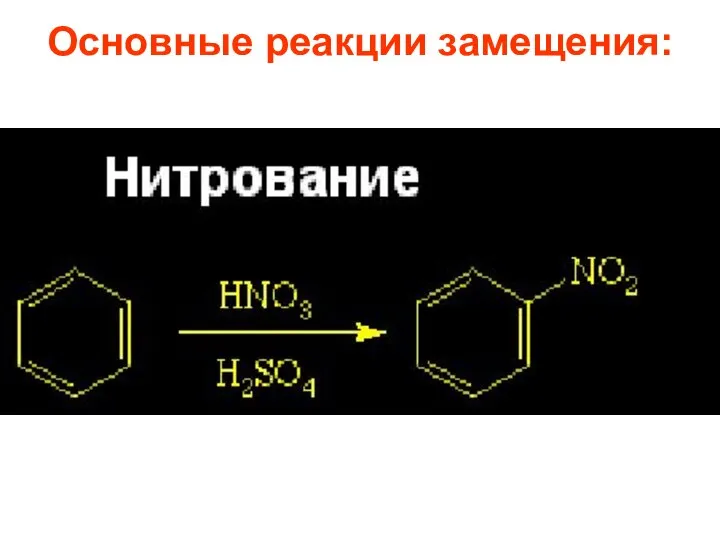
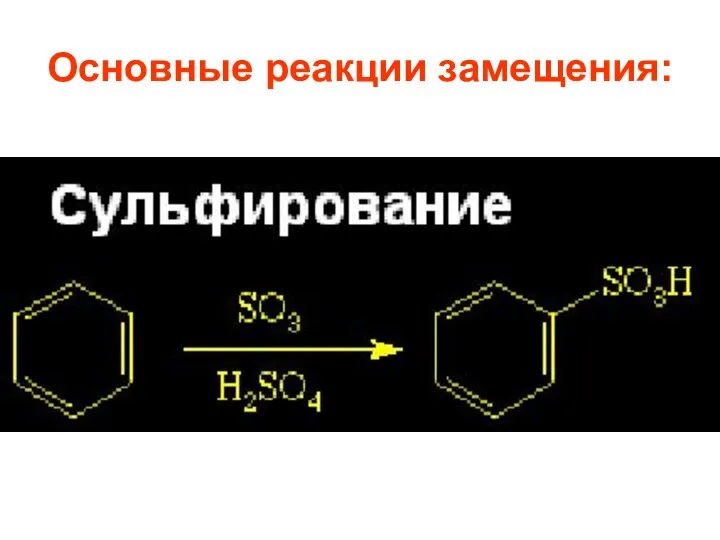
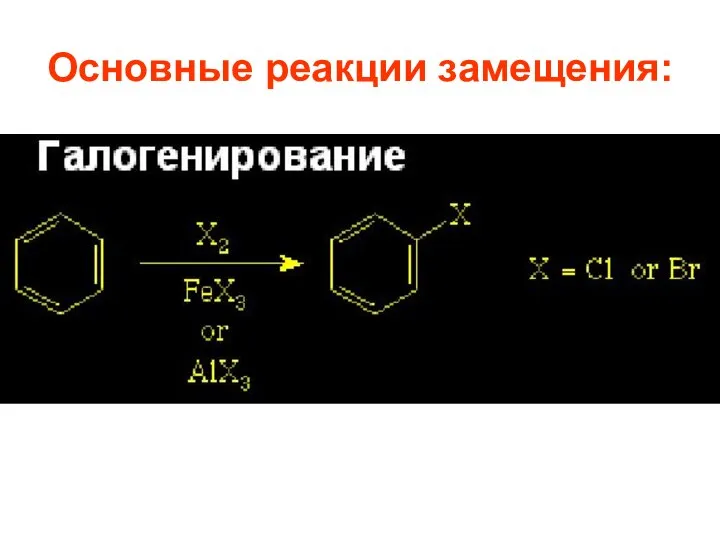
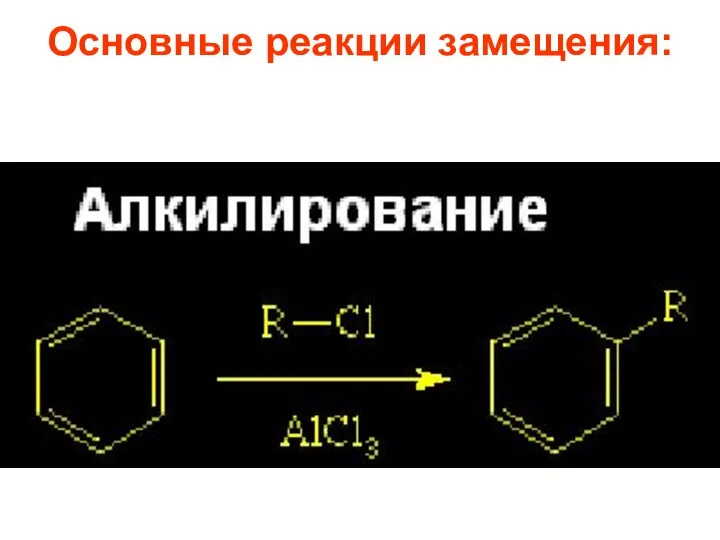
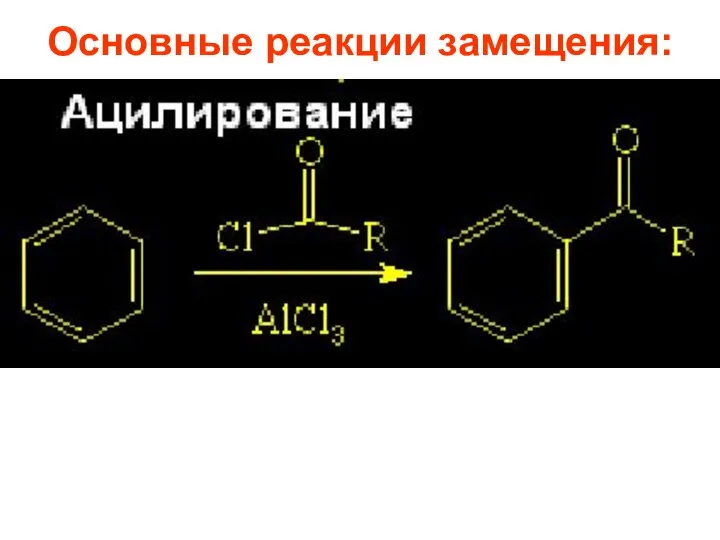
- 26. Основные реакции замещения:
- 27. Реакции галогенирования, нитрования и сульфирования осуществляются почти со всеми ароматическими соединениями, алкилирования и ацилирования – только
- 28. Основные реакции замещения:
- 29. Основные реакции замещения:
- 30. Основные реакции замещения:
- 31. Основные реакции замещения:
- 32. Основные реакции замещения:
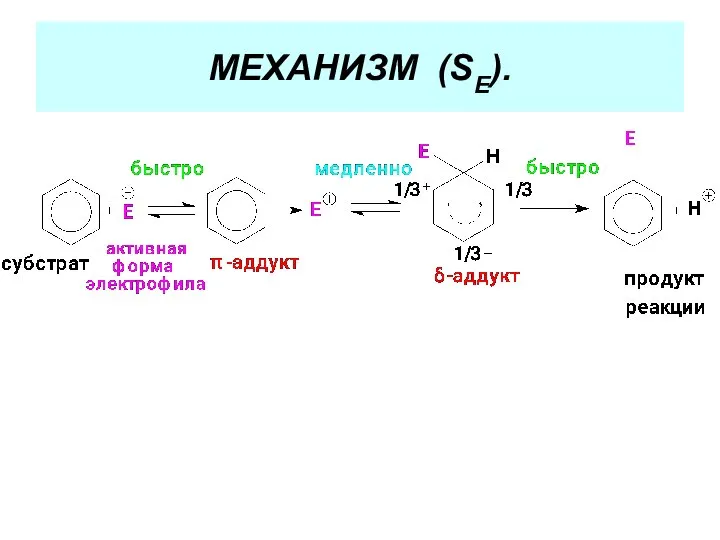
- 33. МЕХАНИЗМ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ). ( См. Учебник. С. 195-199). Стадии реакции: 1. Активация реагента 2.
- 34. МЕХАНИЗМ (SЕ).
- 35. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SE ( См. Учебник. С. 199-206).
- 37. При рассмотрении таких реакций надо решать два важных вопроса: Какие изомеры преимущественно образуются в результате замещения,
- 38. Правила ориентации в монозамещенных аренах По влиянию на ориентацию в SE реакциях все заместители делятся, на
- 39. Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью промежуточно образующихся аренониевых ионов σ-аддуктов
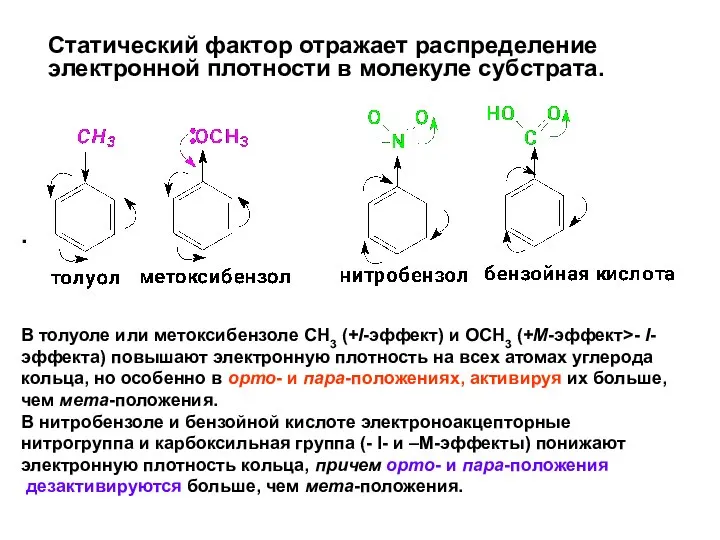
- 40. Статический фактор отражает распределение электронной плотности в молекуле субстрата. . В толуоле или метоксибензоле СН3 (+I-эффект)
- 41. Динамический фактор, то есть стабилизирующее или дестабилизирующее влияние заместителя на образующиеся в ходе реакции аренониевые ионы,
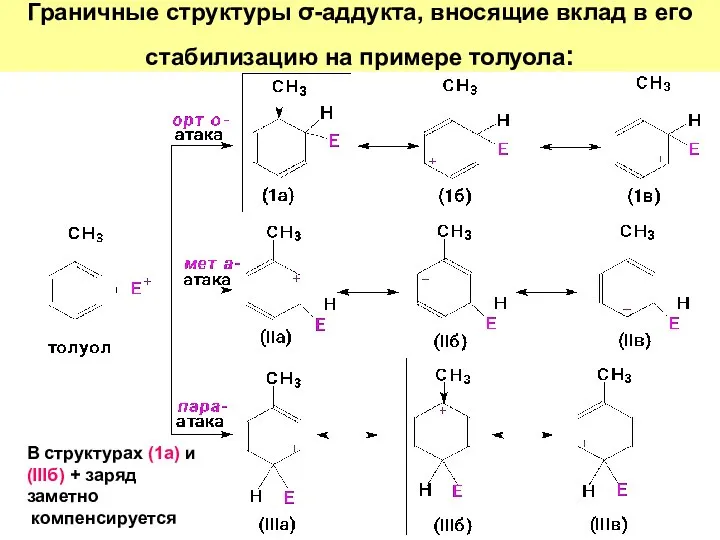
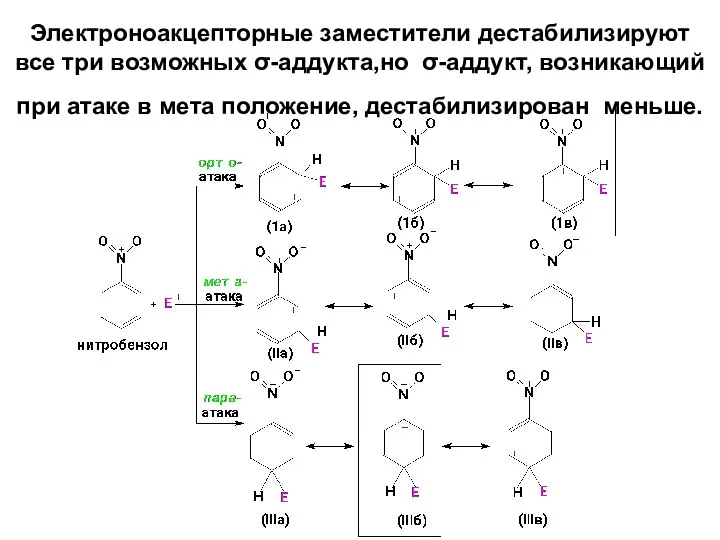
- 42. Граничные структуры σ-аддукта, вносящие вклад в его стабилизацию на примере толуола: В структурах (1а) и (IIIб)
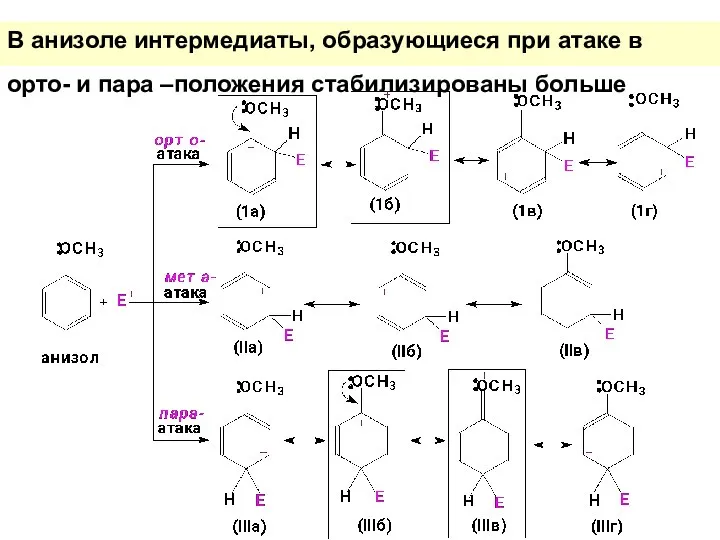
- 43. В анизоле интермедиаты, образующиеся при атаке в орто- и пара –положения стабилизированы больше
- 44. Электроноакцепторные заместители дестабилизируют все три возможных σ-аддукта,но σ-аддукт, возникающий при атаке в мета положение, дестабилизирован меньше.
- 45. По влиянию статических и динамических факторов на реакционную способность и ориентацию в реакциях электрофильного замещения заместители
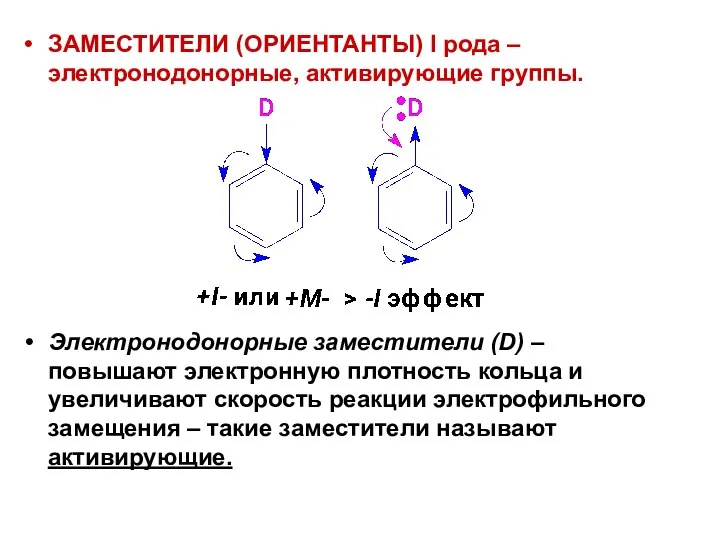
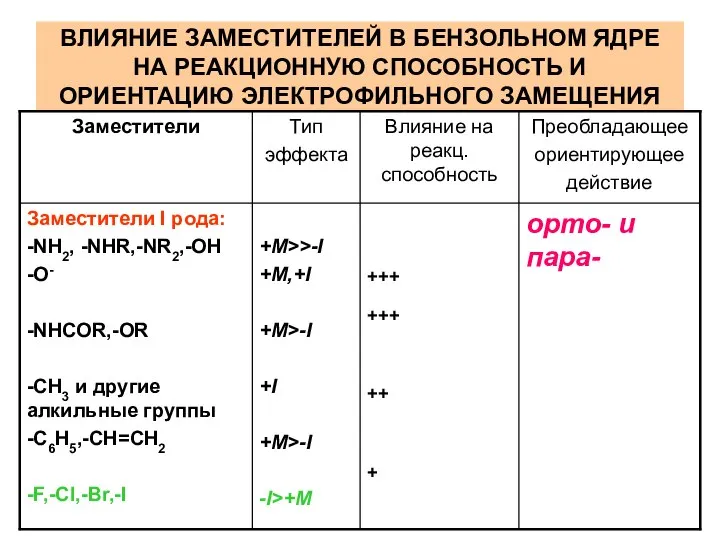
- 46. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) I рода – электронодонорные, активирующие группы. Электронодонорные заместители (D) – повышают электронную плотность кольца
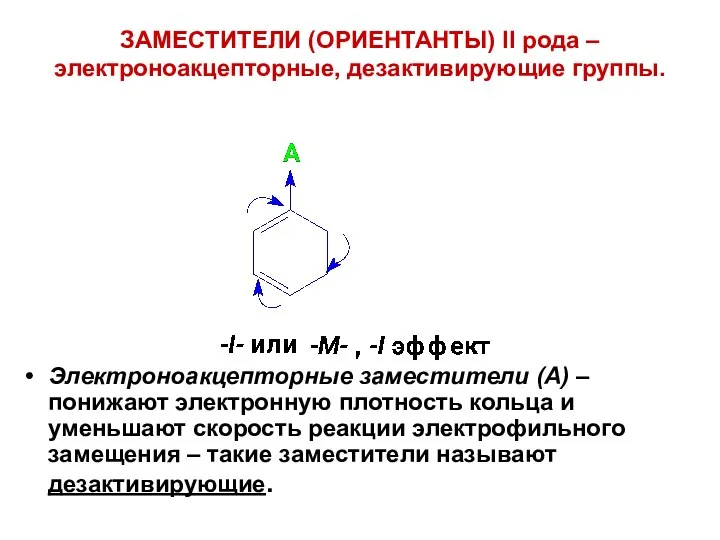
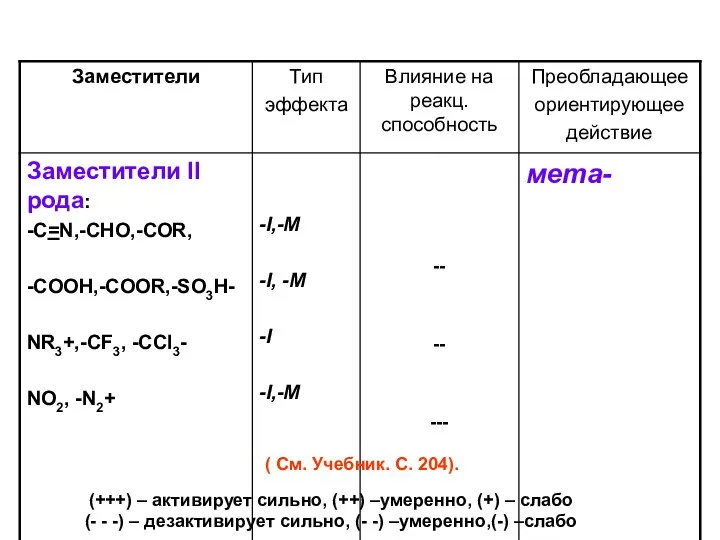
- 47. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) II рода – электроноакцепторные, дезактивирующие группы. Электроноакцепторные заместители (А) – понижают электронную плотность кольца
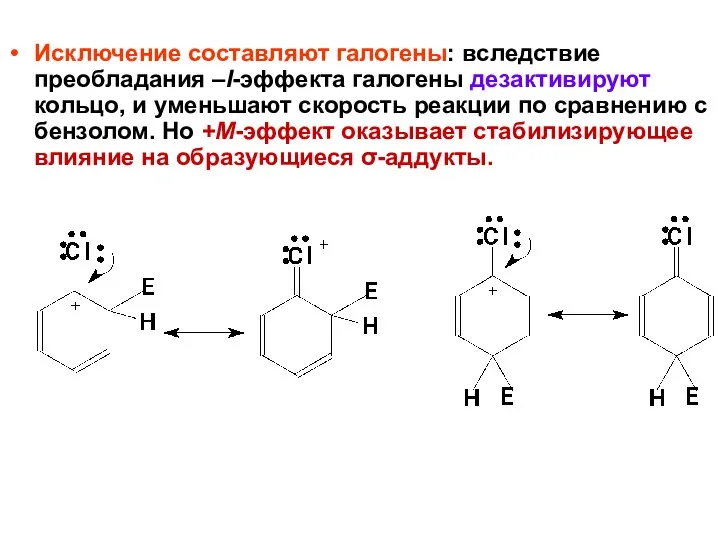
- 48. Исключение составляют галогены: вследствие преобладания –I-эффекта галогены дезактивируют кольцо, и уменьшают скорость реакции по сравнению с
- 49. ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ ЯДРЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ И ОРИЕНТАЦИЮ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
- 50. (+++) – активирует сильно, (++) –умеренно, (+) – слабо (- - -) – дезактивирует сильно, (-
- 51. Правила ориентации позволяют предсказать преимущественное направление реакции и преобладание того или иного изомера в продуктах реакции.
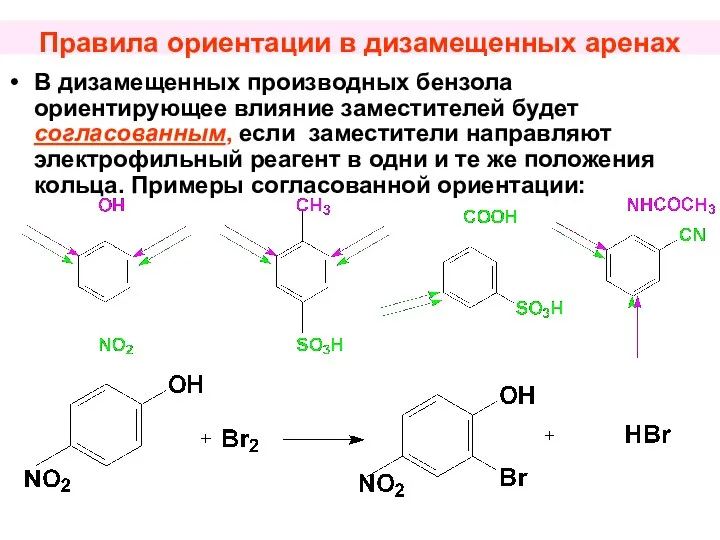
- 52. Правила ориентации в дизамещенных аренах В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители
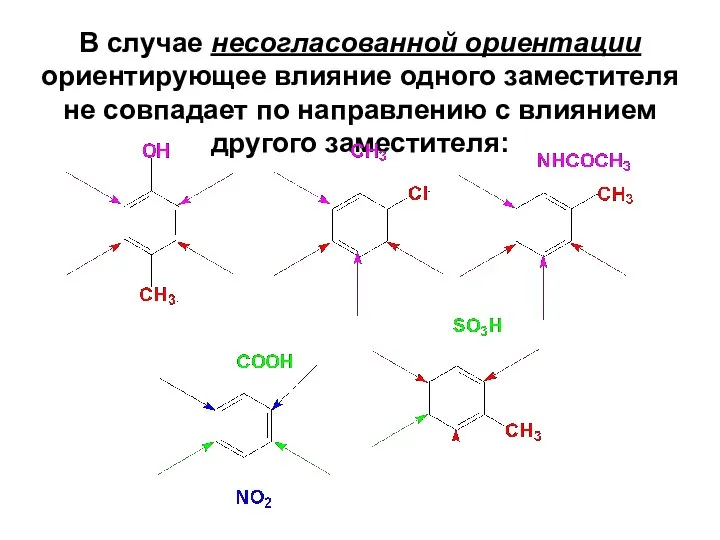
- 53. В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя:
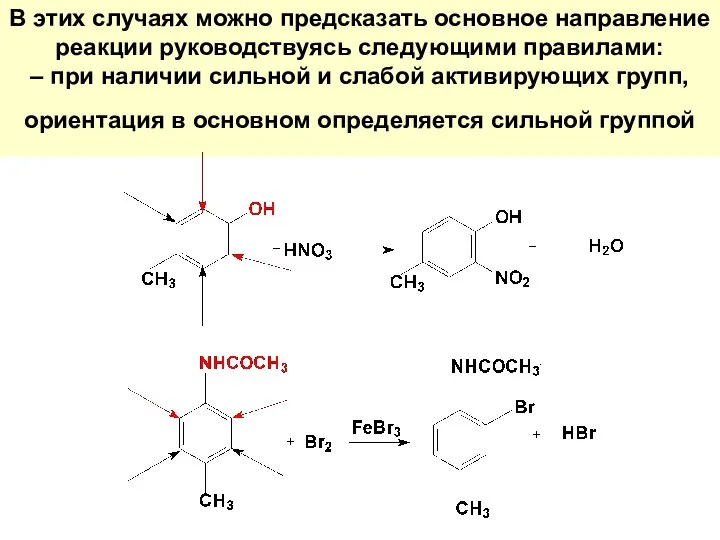
- 54. В этих случаях можно предсказать основное направление реакции руководствуясь следующими правилами: – при наличии сильной и
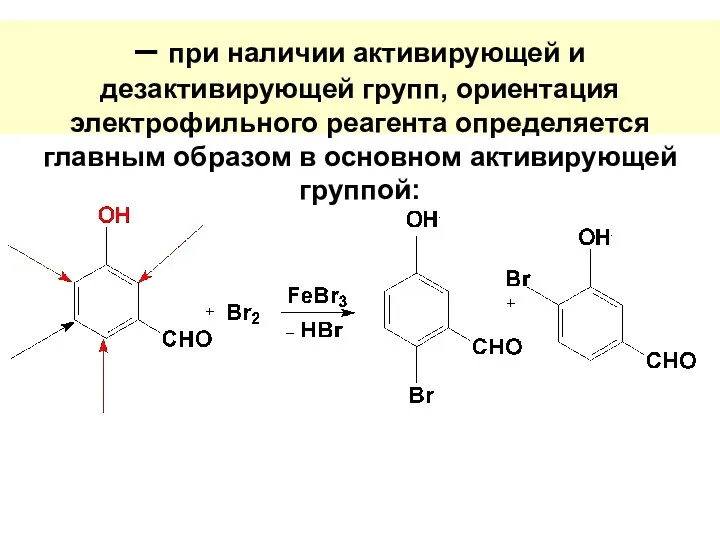
- 55. – при наличии активирующей и дезактивирующей групп, ориентация электрофильного реагента определяется главным образом в основном активирующей
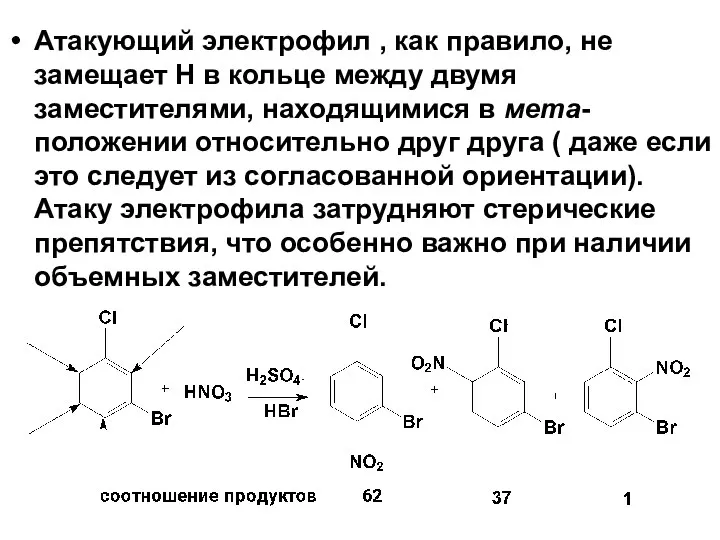
- 56. Атакующий электрофил , как правило, не замещает Н в кольце между двумя заместителями, находящимися в мета-положении
- 57. Важнейшие реакции SE 1.1. Галогенирование. Бензол реагирует с Cl2 и Br2 в присутствии Kt : безводных
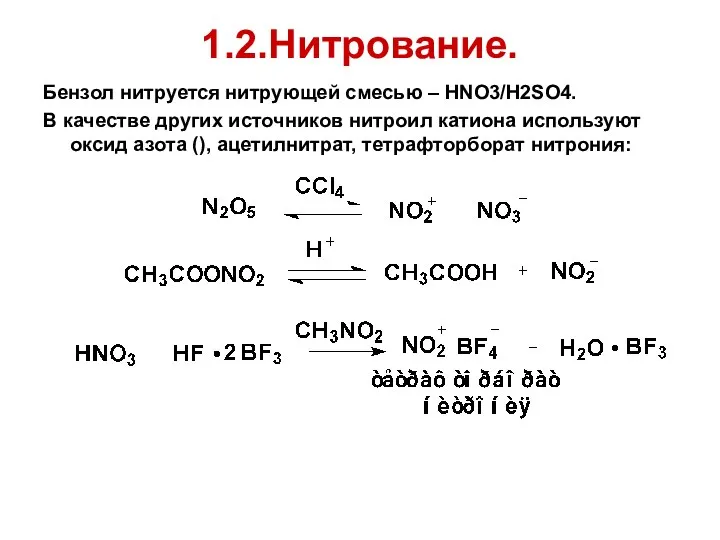
- 58. 1.2.Нитрование. Бензол нитруется нитрующей смесью – HNO3/H2SO4. В качестве других источников нитроил катиона используют оксид азота
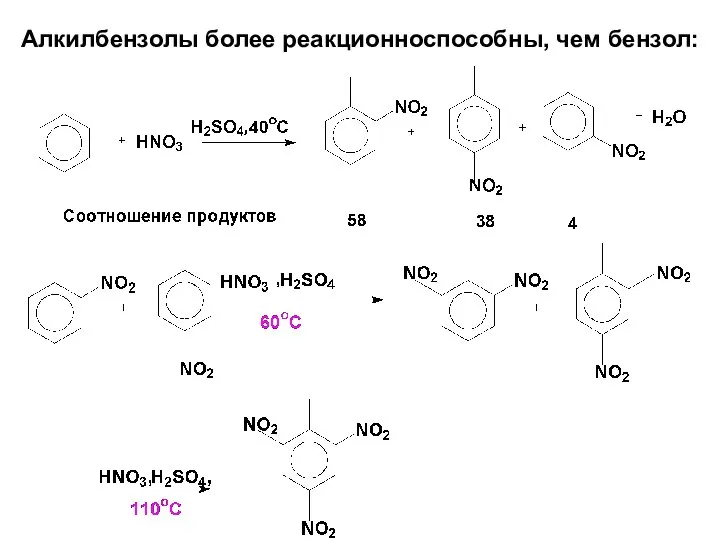
- 59. Алкилбензолы более реакционноспособны, чем бензол:
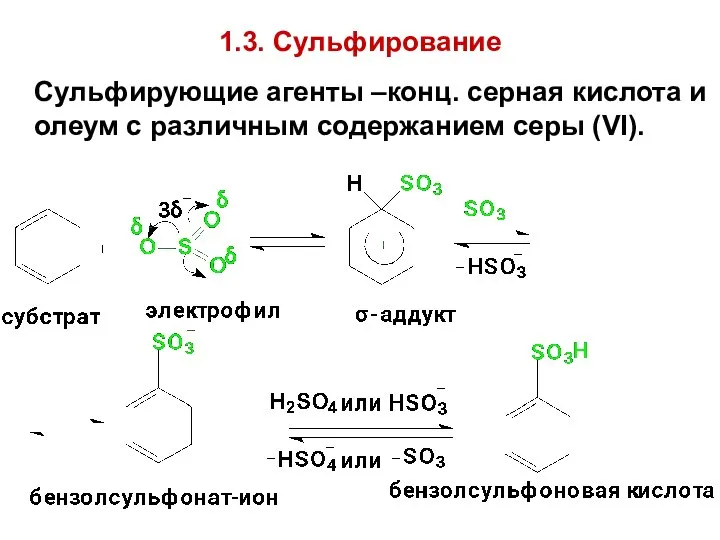
- 60. 1.3. Сульфирование Сульфирующие агенты –конц. серная кислота и олеум с различным содержанием серы (VI).
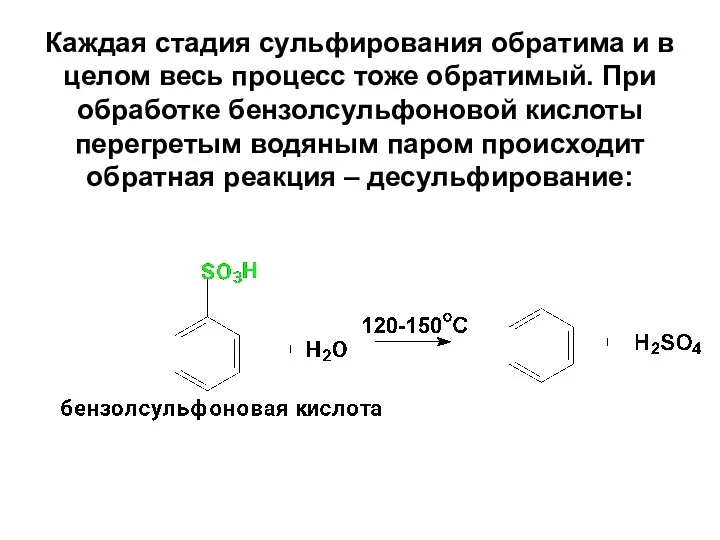
- 61. Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый. При обработке бензолсульфоновой кислоты перегретым
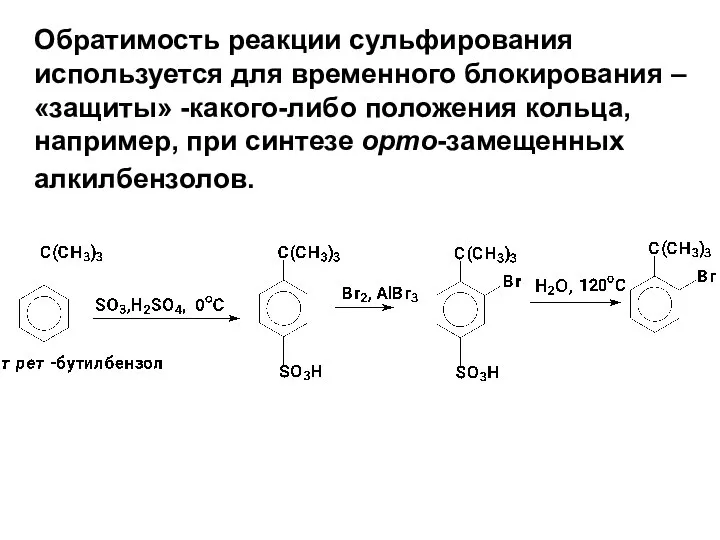
- 62. Обратимость реакции сульфирования используется для временного блокирования –«защиты» -какого-либо положения кольца, например, при синтезе орто-замещенных алкилбензолов.
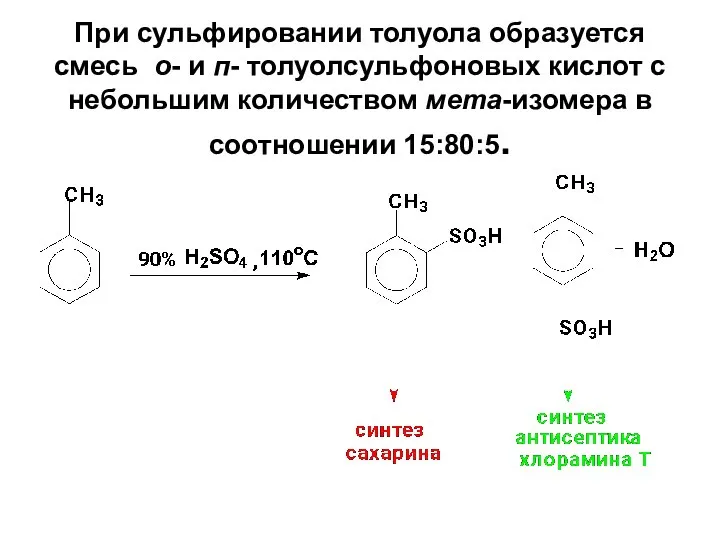
- 63. При сульфировании толуола образуется смесь о- и п- толуолсульфоновых кислот с небольшим количеством мета-изомера в соотношении
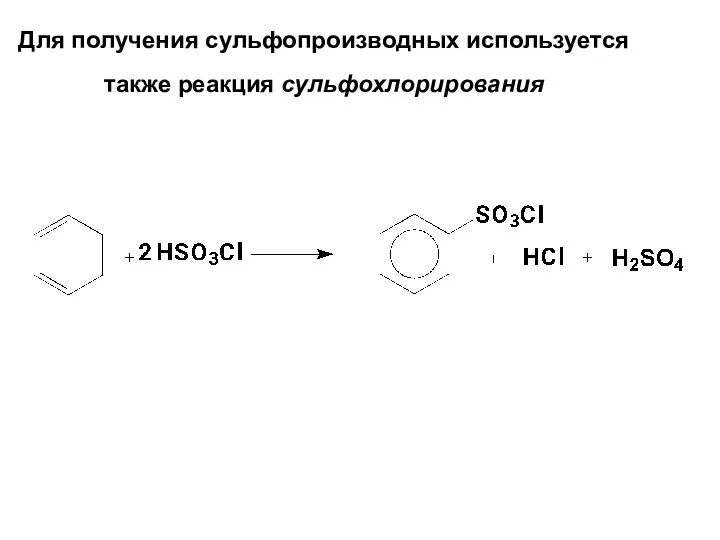
- 64. Для получения сульфопроизводных используется также реакция сульфохлорирования
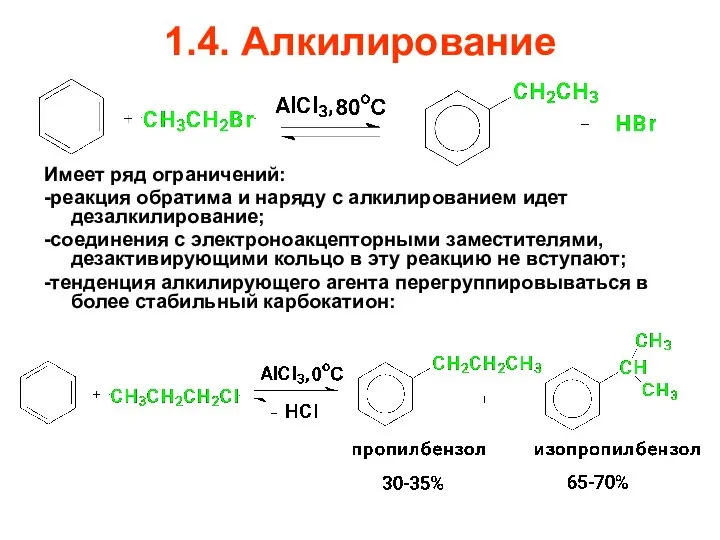
- 65. 1.4. Алкилирование Имеет ряд ограничений: -реакция обратима и наряду с алкилированием идет дезалкилирование; -соединения с электроноакцепторными
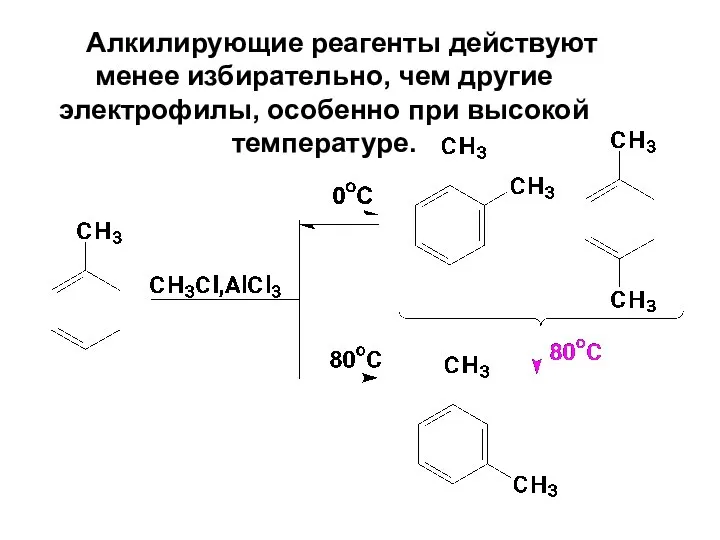
- 66. Алкилирующие реагенты действуют менее избирательно, чем другие электрофилы, особенно при высокой температуре.
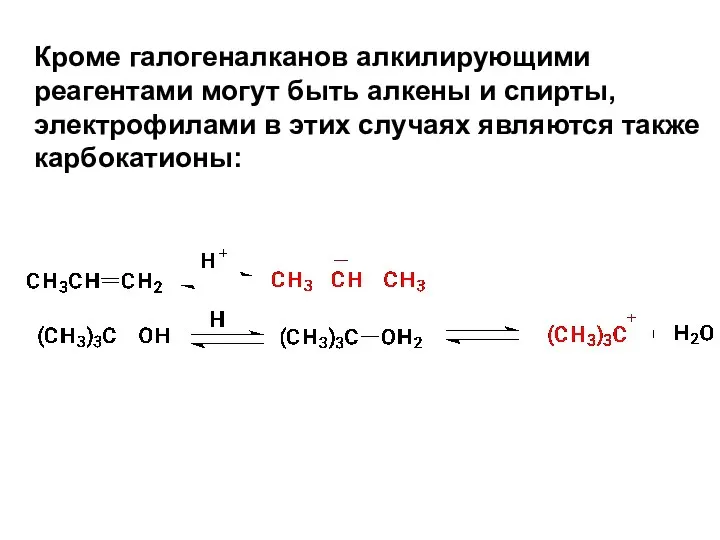
- 67. Кроме галогеналканов алкилирующими реагентами могут быть алкены и спирты, электрофилами в этих случаях являются также карбокатионы:
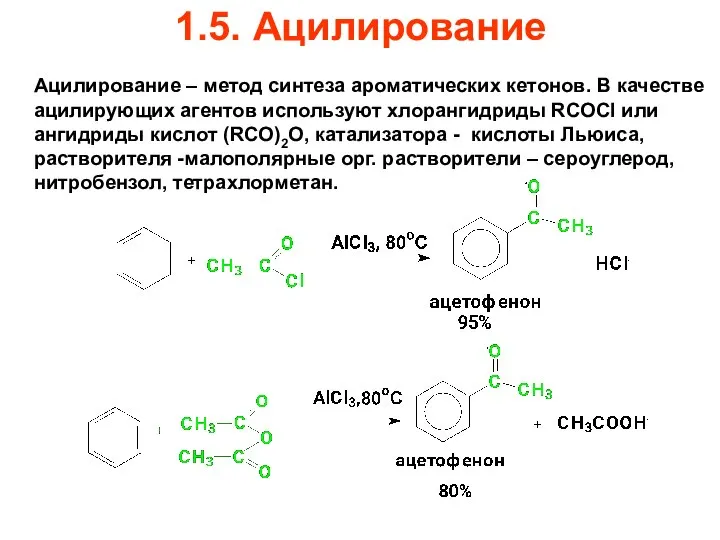
- 68. 1.5. Ацилирование Ацилирование – метод синтеза ароматических кетонов. В качестве ацилирующих агентов используют хлорангидриды RCOCl или
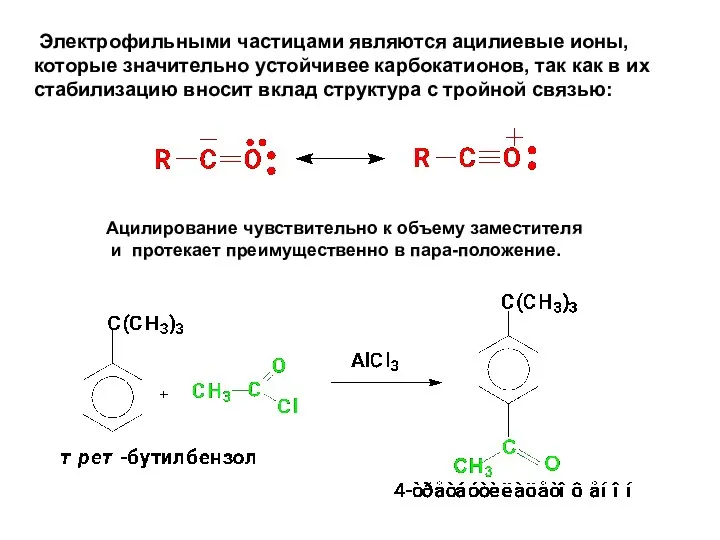
- 69. Электрофильными частицами являются ацилиевые ионы, которые значительно устойчивее карбокатионов, так как в их стабилизацию вносит вклад
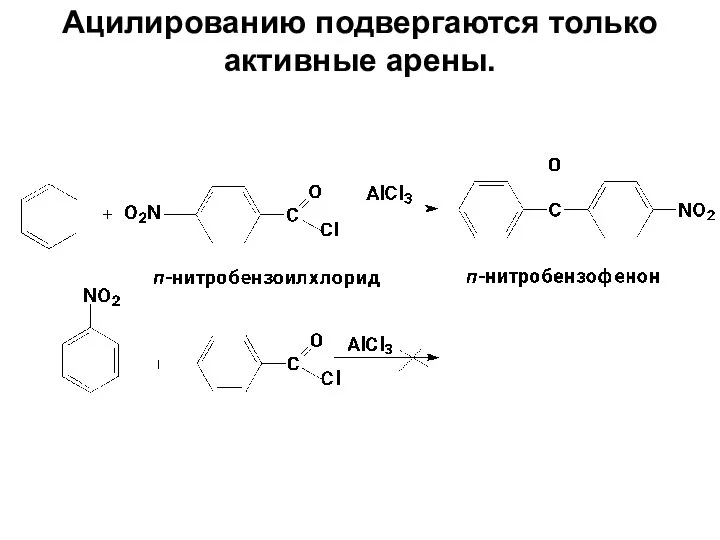
- 70. Ацилированию подвергаются только активные арены.
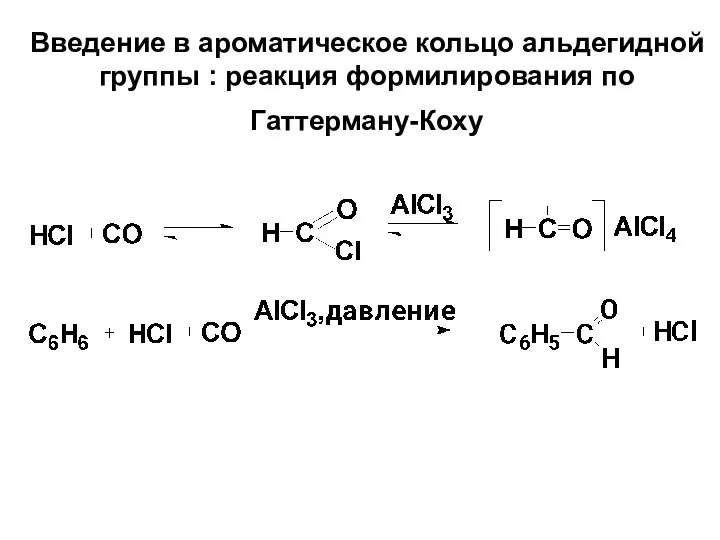
- 71. Введение в ароматическое кольцо альдегидной группы : реакция формилирования по Гаттерману-Коху
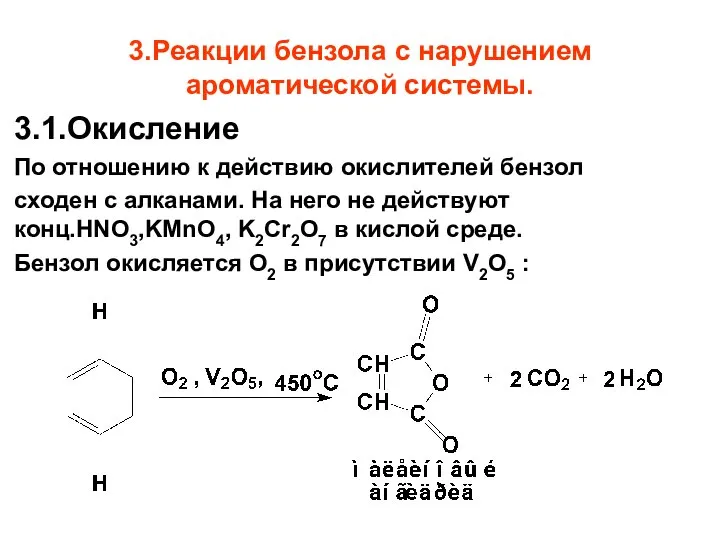
- 72. 3.Реакции бензола с нарушением ароматической системы. 3.1.Окисление По отношению к действию окислителей бензол сходен с алканами.
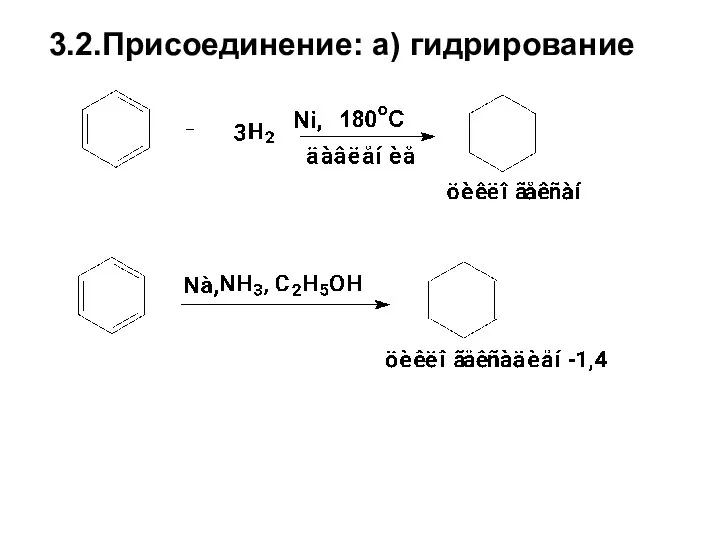
- 73. 3.2.Присоединение: а) гидрирование
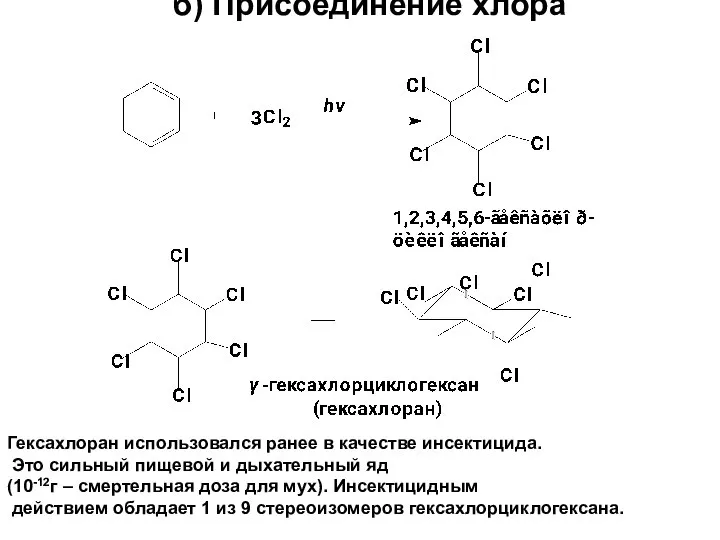
- 74. б) Присоединение хлора Гексахлоран использовался ранее в качестве инсектицида. Это сильный пищевой и дыхательный яд (10-12г
- 75. 3.3.Реакции боковых цепей в алкилбензолах. а) Галогенирования (Учебник. Стр. 214-215). Алкилбензолы вступают в реакции радикального хлорирования
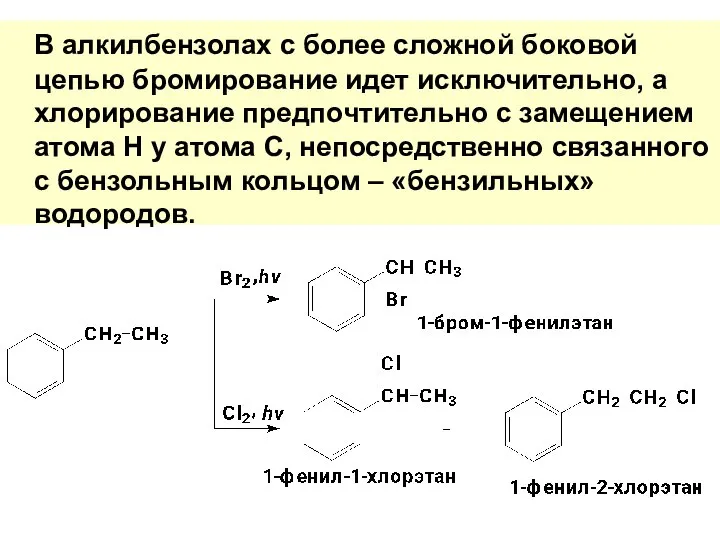
- 76. В алкилбензолах с более сложной боковой цепью бромирование идет исключительно, а хлорирование предпочтительно с замещением атома
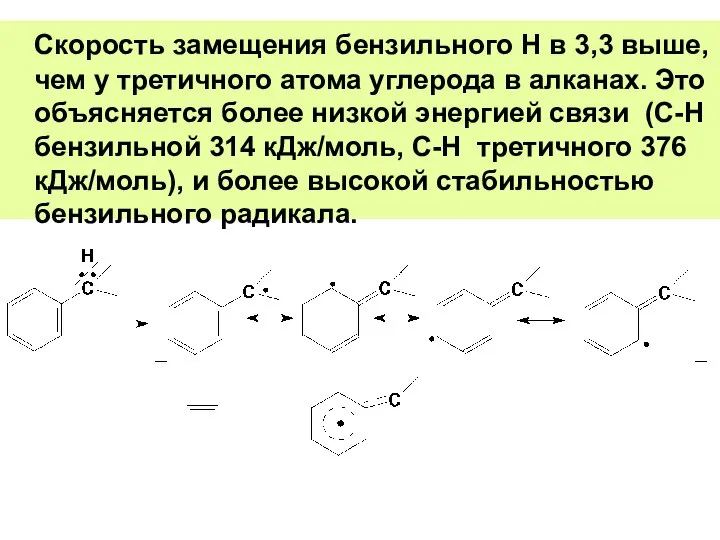
- 77. Скорость замещения бензильного Н в 3,3 выше, чем у третичного атома углерода в алканах. Это объясняется
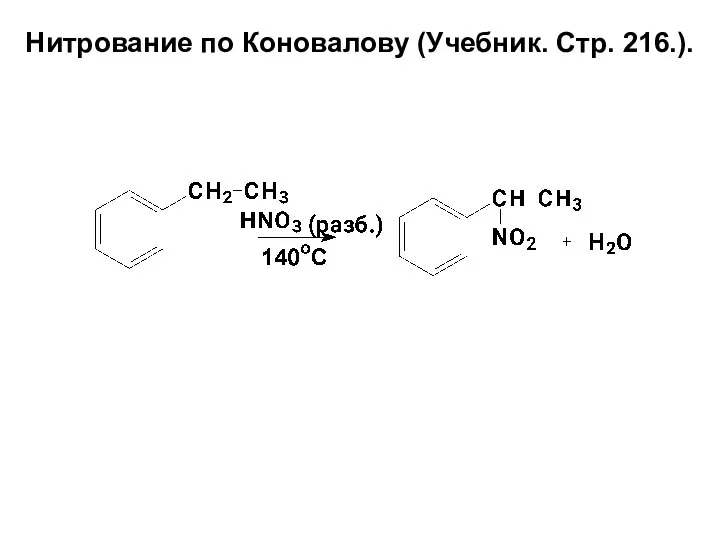
- 78. Нитрование по Коновалову (Учебник. Стр. 216.).
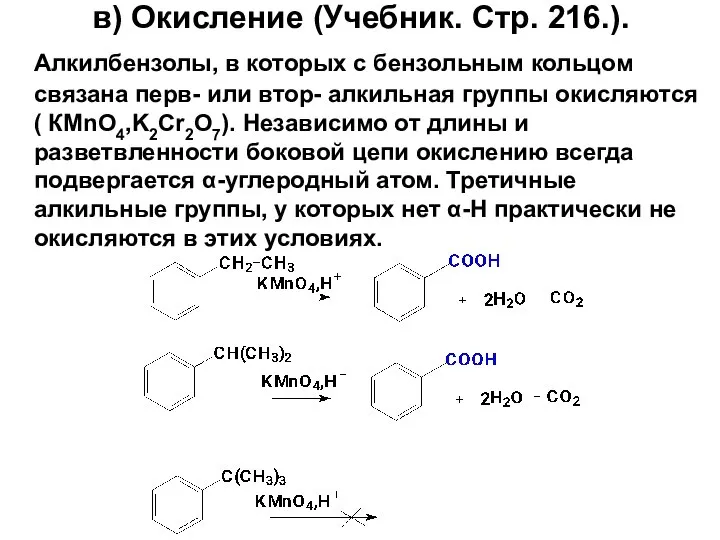
- 79. в) Окисление (Учебник. Стр. 216.). Алкилбензолы, в которых с бензольным кольцом связана перв- или втор- алкильная
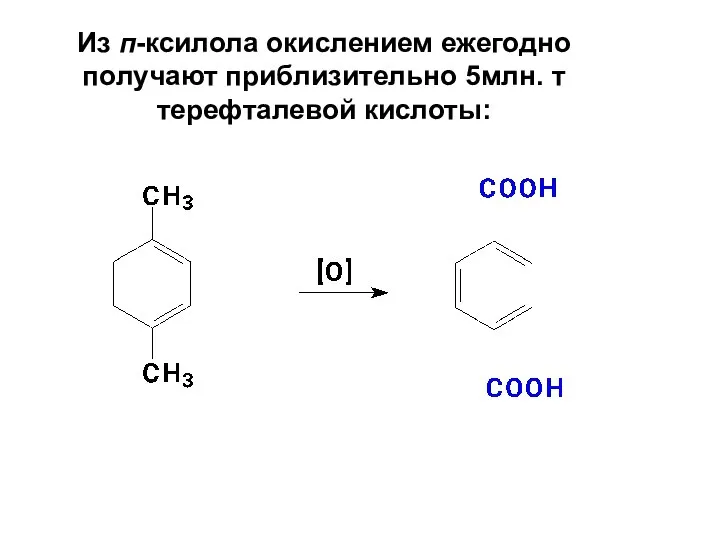
- 80. Из п-ксилола окислением ежегодно получают приблизительно 5млн. т терефталевой кислоты:
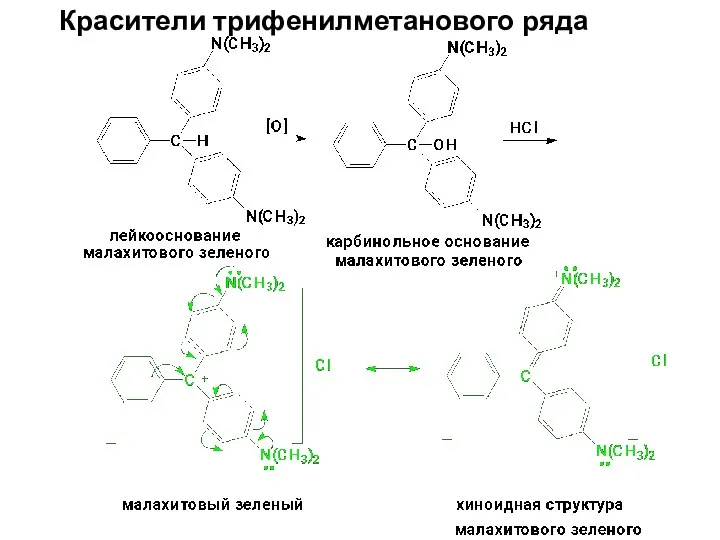
- 81. Красители трифенилметанового ряда
- 83. Скачать презентацию


















 Проект: «Мои любимые опыты с содой и уксусом»
Проект: «Мои любимые опыты с содой и уксусом» Водородный электрод
Водородный электрод Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Синтетические моющие средства
Синтетические моющие средства Ионные равновесия в растворах
Ионные равновесия в растворах СОЛЬ – ЗНАКОМАЯ НЕЗНАКОМКА Реймер Анна Евгеньевна МОУ «СОШ №2» 2 «А» класс Руководитель Попова Снежанна Владиславовна
СОЛЬ – ЗНАКОМАЯ НЕЗНАКОМКА Реймер Анна Евгеньевна МОУ «СОШ №2» 2 «А» класс Руководитель Попова Снежанна Владиславовна Металлы II, побочной подгруппы ПСХЭ
Металлы II, побочной подгруппы ПСХЭ Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Углеводороды: изомерия
Углеводороды: изомерия Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010
Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010 Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Урок :Углерод (9 класс) Автор:Ахметвалиева НаиляМисбаховна , учитель химии ГБОУ ООШ п.Приморский м.р.Ставропольский Самарской области Углерод Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, по
Урок :Углерод (9 класс) Автор:Ахметвалиева НаиляМисбаховна , учитель химии ГБОУ ООШ п.Приморский м.р.Ставропольский Самарской области Углерод Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, по Презентация по химии Карбоновые кислоты и их производные
Презентация по химии Карбоновые кислоты и их производные  Использование инновационных технологий в обучении химии как средство повышения качества подготовки специалистов. Методи
Использование инновационных технологий в обучении химии как средство повышения качества подготовки специалистов. Методи Химическое равновесие.
Химическое равновесие. Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией  Серная кислота H2SO4
Серная кислота H2SO4 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Біотехнічні основи технології харчових продуктів
Біотехнічні основи технології харчових продуктів Фармацевтичний аналіз
Фармацевтичний аналіз Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Электрохимические методы в радиохимии
Электрохимические методы в радиохимии 9 класс (обязательный минимум по химии) ПОЛИМЕРЫ
9 класс (обязательный минимум по химии) ПОЛИМЕРЫ  Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Строение атома. Периодический закон. Периодическая система
Строение атома. Периодический закон. Периодическая система Неметаллы. Сера. 9 класс
Неметаллы. Сера. 9 класс