Содержание
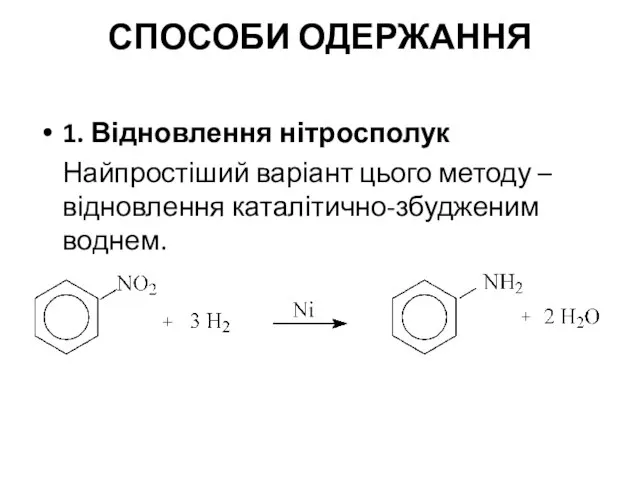
- 2. СПОСОБИ ОДЕРЖАННЯ 1. Відновлення нітросполук Найпростіший варіант цього методу – відновлення каталітично-збудженим воднем.
- 3. Існує велика кількість інших відновлювальних систем: Fe+HCI; Sn+НCI; H2S; Na2S. У промислових умовах часто застосовують чавунні
- 4. 2. З галогенопохідних 2.1. Отримання первинних амінів Реакція арилювання аміаку протікає в жорстких умовах внаслідок низької
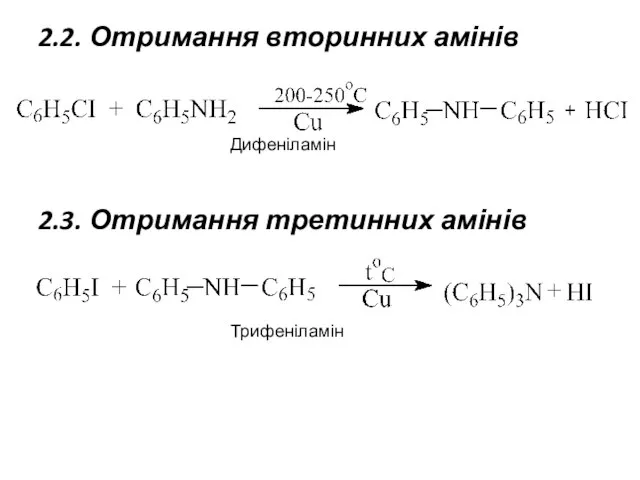
- 5. 2.2. Отримання вторинних амінів Дифеніламін 2.3. Отримання третинних амінів Трифеніламін
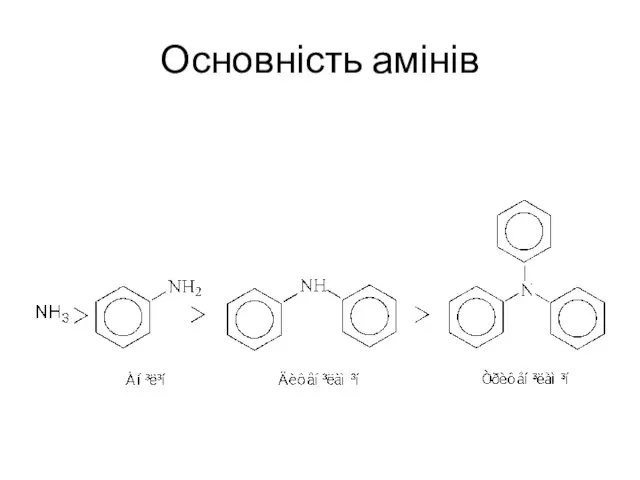
- 6. ХІМІЧНІ ВЛАСТИВОСТІ 1. Основність ариламінів. Ариламіни є слабшими основами порівняно з аліфатичними. Це пов'язано зі спряженням
- 7. Основність амінів
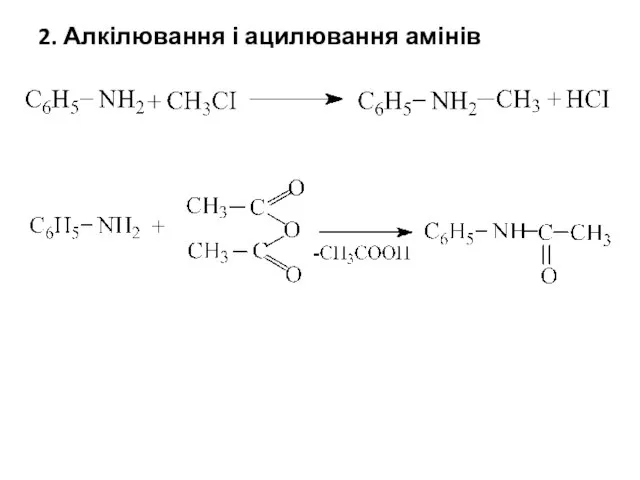
- 8. 2. Алкілювання і ацилювання амінів
- 9. Первинні аміни при взаємодії з ароматичними альдегідами утворюють основи Шіффа (азометини)
- 10. Реакції електрофільного заміщення Аміногрупа є одним з найактивніших замісників І роду, тому анілін вступає у реакції
- 11. Тому, її спочатку захищають, наприклад, реакцією ацилювання. Ацетиламіногрупа зберігає електронодонорні властивості і в реакціях SE орієнтує
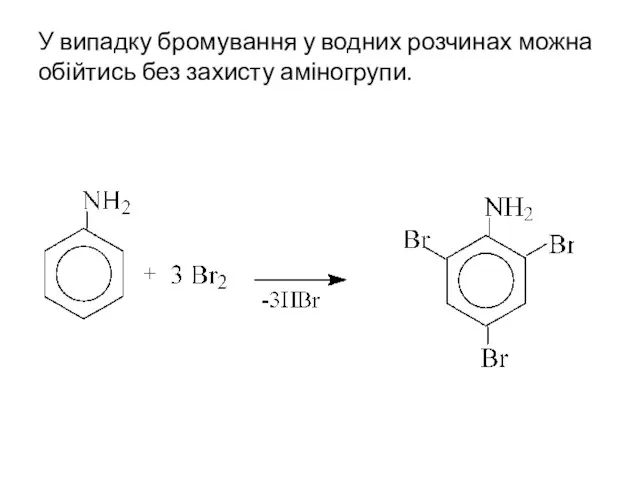
- 12. У випадку бромування у водних розчинах можна обійтись без захисту аміногрупи.
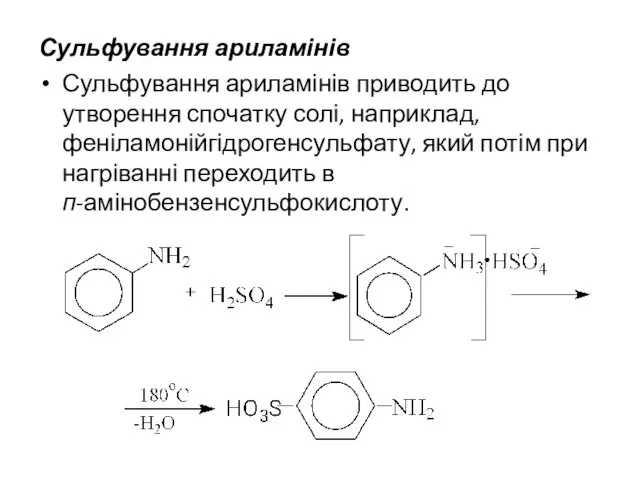
- 13. Сульфування ариламінів Сульфування ариламінів приводить до утворення спочатку солі, наприклад, феніламонійгідрогенсульфату, який потім при нагріванні переходить
- 14. АРОМАТИЧНІ ДІАЗО- ТА АЗОСПОЛУКИ, АЗОБАРВНИКИ Ароматичні азосполуки - це речовини загальної формули Ar—N=N—Ar у молекулах яких
- 15. Діазосполуки Найстабільнішими ароматичними діазосполуками є солі діазонію ([ArN≡N]+X─), де (Х=Hal, SO3H, CN), але і вони доволі
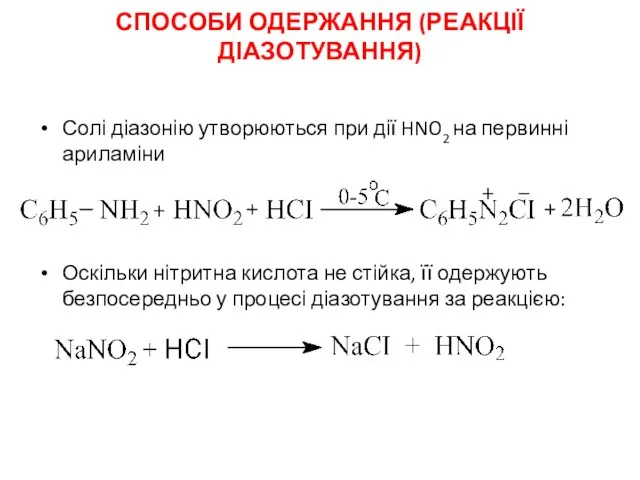
- 16. СПОСОБИ ОДЕРЖАННЯ (РЕАКЦІЇ ДІАЗОТУВАННЯ) Солі діазонію утворюються при дії HNO2 на первинні ариламіни Оскільки нітритна кислота
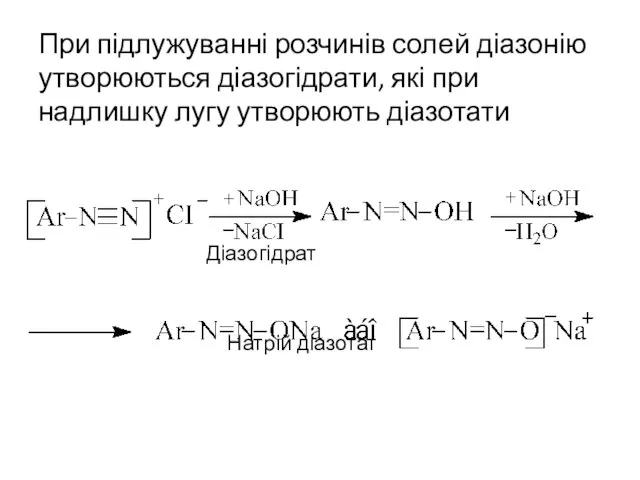
- 17. При підлужуванні розчинів солей діазонію утворюються діазогідрати, які при надлишку лугу утворюють діазотати Діазогідрат Натрій діазотат
- 18. Діазогідрати нестійкі сполуки і у вільному стані не виділені. У водних розчинах вони виявляють амфотерні властивості:
- 19. ХІМІЧНІ ВЛАСТИВОСТІ Діазоарени характеризуються реакціями двох типів: 1 - реакції з заміщенням діазонієвої групи та виділенням
- 20. 1. Реакції з виділенням азоту Реакція Л.Гаттермана-Т.Зандмейєра (заміна діазогрупи на CI, CN, NO2, SН)
- 21. Розкладання солей діазонію при нагріванні Реакція відновлення (заміщення діазогрупи на водень)
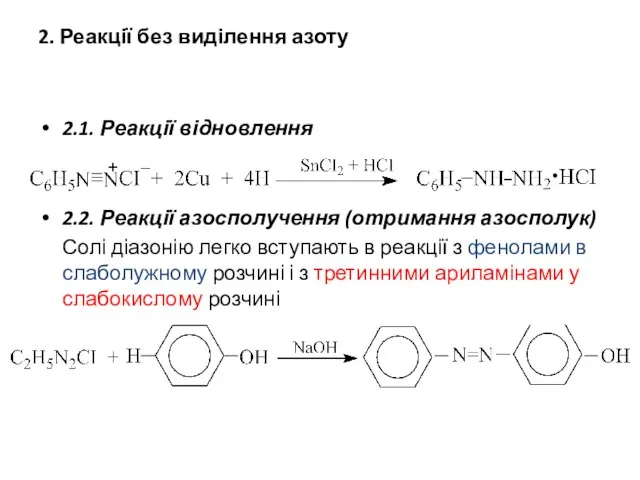
- 22. 2. Реакції без виділення азоту 2.1. Реакції відновлення 2.2. Реакції азосполучення (отримання азосполук) Солі діазонію легко
- 23. Діазокатіон заміщує атом водню тільки у тому ароматичному ядрі, де є сильні активуючі групи ( -NR2,
- 24. Реакція азосполучення відбувається у п-положенні, а якщо воно зайняте, то в о-положенні, до NR2 або НОгрупи.
- 25. Схема синтезу азобарвника метилового помаранчевого, який до того ж є одним з найпоширеніших кислотно-основних індикаторів. 1.
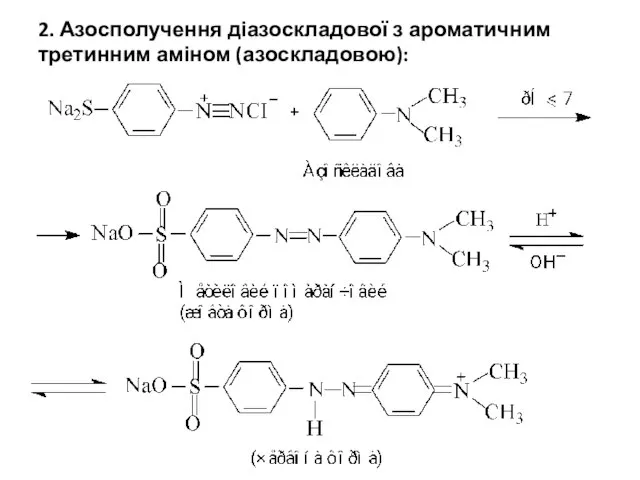
- 26. 2. Азосполучення діазоскладової з ароматичним третинним аміном (азоскладовою):
- 27. Біле світло складається з суміші всіх спектральних кольорів (червоного, помаранчового, жовтого, зеленого, блакитного, синього, фіолетового).
- 28. Якщо на поверхню тіла падає потік білого світла, то можна спостерігати такі явища: Світло проходить крізь
- 29. Отже, причиною забарвлення є вибіркове поглинання тілом частини світлових променів із загального потоку у видимівй частині
- 30. Як же пов’язана довжина світлової хвилі, що поглинається речовиною з її хімічною будовою? Більшість органічних речовин
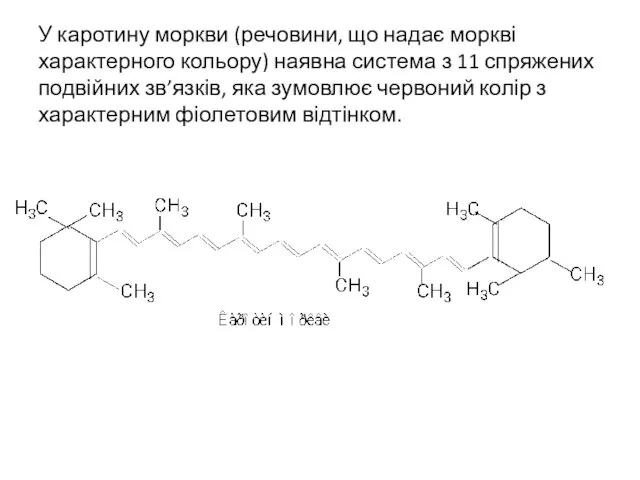
- 31. У каротину моркви (речовини, що надає моркві характерного кольору) наявна система з 11 спряжених подвійних зв’язків,
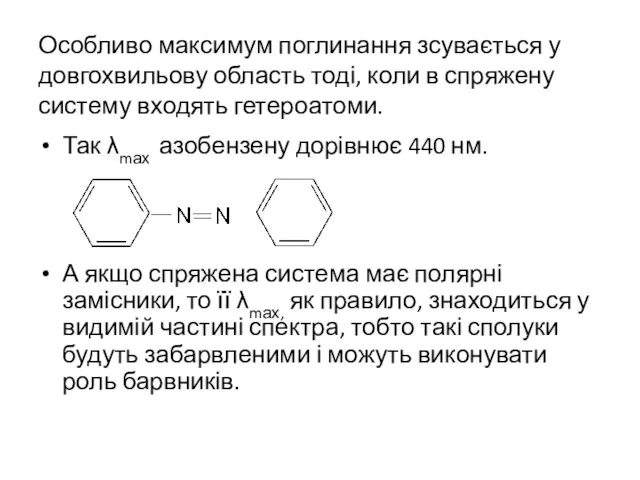
- 32. Особливо максимум поглинання зсувається у довгохвильову область тоді, коли в спряжену систему входять гетероатоми. Так λmах
- 34. Скачать презентацию







![Діазосполуки Найстабільнішими ароматичними діазосполуками є солі діазонію ([ArN≡N]+X─), де (Х=Hal, SO3H,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/526823/slide-14.jpg)











 Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Алканы. Алкены. Алкины
Алканы. Алкены. Алкины Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах Правила безопасности во дворе
Правила безопасности во дворе Матеріалознавство. Будова твердих тіл та вплив на їх властивості
Матеріалознавство. Будова твердих тіл та вплив на їх властивості Кальций туралы
Кальций туралы Организация физической защиты ДРМ
Организация физической защиты ДРМ Цікаві досліди з хімії
Цікаві досліди з хімії Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Сложные эфиры. Жиры
Сложные эфиры. Жиры Химический состав микроорганизмов-деструкторов
Химический состав микроорганизмов-деструкторов Періодична система хімічних елементів
Періодична система хімічних елементів Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.
Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.  Вода – чудо жизни
Вода – чудо жизни Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Горение твердого топлива
Горение твердого топлива Массовая доля вещества в растворе
Массовая доля вещества в растворе Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах
Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах Химическая термодинамика
Химическая термодинамика Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов
Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Свойства нейтральных атомов. Лекция 4
Свойства нейтральных атомов. Лекция 4 Топаз
Топаз ВЫПОЛНИЛА: УЧЕНИЦА 10А СРЕДНЕЙ ШКОЛЫ №9 ПОСПЕЛОВА АЛИНА ПРОВЕРИЛА: БОРЗЫХ Т.Н.
ВЫПОЛНИЛА: УЧЕНИЦА 10А СРЕДНЕЙ ШКОЛЫ №9 ПОСПЕЛОВА АЛИНА ПРОВЕРИЛА: БОРЗЫХ Т.Н. Нефтяные масла. Основная информация
Нефтяные масла. Основная информация Радиоактивность
Радиоактивность Волшебные свойства воды
Волшебные свойства воды