Содержание
- 2. Строение молекулы азота КНС Тройная связь: σ+2π Е связи = 1000 кДж/моль Sp – гибридизация Линейная
- 3. Химические свойства азота Азот – окислитель с металлами и водородом: N2 + 6 Li → 2
- 4. Способы получения азота В промышленности – испарение сжиженного воздуха (первым улетучивается азот) В лаборатории – нагревание
- 5. Аммиак: физические свойства NH3 – бесцветный газ с резким запахом, легче воздуха Dвозд.(NH3) =17/29 Хорошо растворим
- 6. Способы получения аммиака В промышленности – процесс Габера N2 + 3H2 ↔ 2NH3 5000, 350 атм,
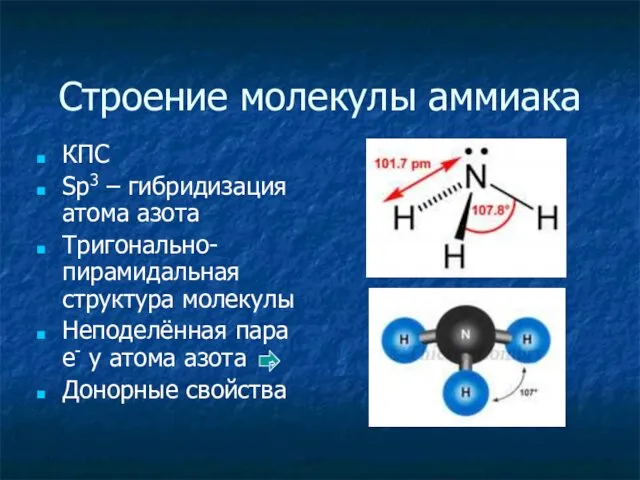
- 7. Строение молекулы аммиака КПС Sp3 – гибридизация атома азота Тригонально-пирамидальная структура молекулы Неподелённая пара е- у
- 8. Химические свойства аммиака Восстановительные: Горение: 2NH3 + 3O2 → N2 + 3H2O Каталитическое окисление: 4NH3 +
- 9. Применение аммиака Аммиачная селитра Краски для волос Производство азотной кислоты Средства для чистки стёкол
- 10. Оксид азота (Ι) «веселящий газ» Получение: NH4NO3 → N2O + 2H2O (до 1400) Свойства: Термически неустойчив:
- 11. Оксид азота (ΙΙ) Получение: 4NH3 + 5O2 → 4NО + 6H2O (kt – Pt) Бесцветный газ,
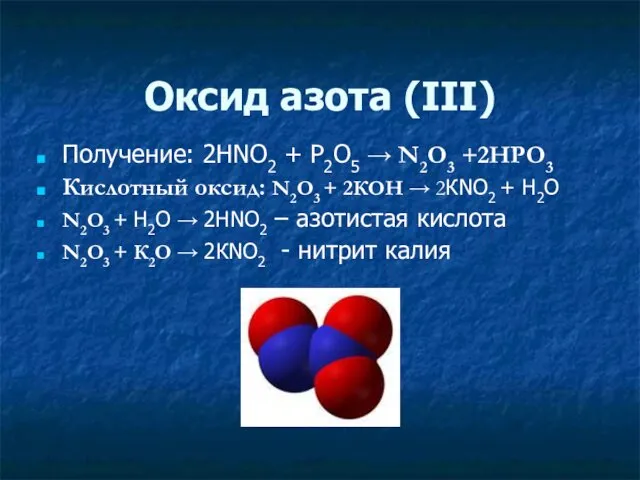
- 12. Оксид азота (ΙΙΙ) Получение: 2HNO2 + P2O5 → N2O3 +2HPO3 Кислотный оксид: N2O3 + 2КОН →
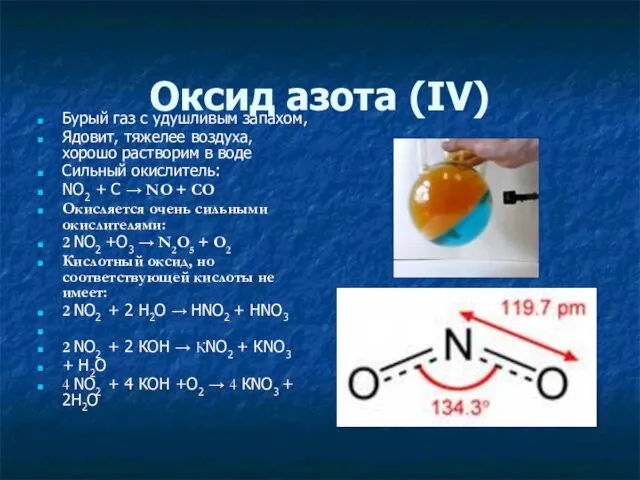
- 13. Оксид азота (ΙV) Бурый газ с удушливым запахом, Ядовит, тяжелее воздуха, хорошо растворим в воде Сильный
- 14. Оксид азота (V) Получение: 2HNO3 + P2O5 → N2O5 +2HPO3 Голубоватые кристаллы Кислотный оксид: N2O5 +
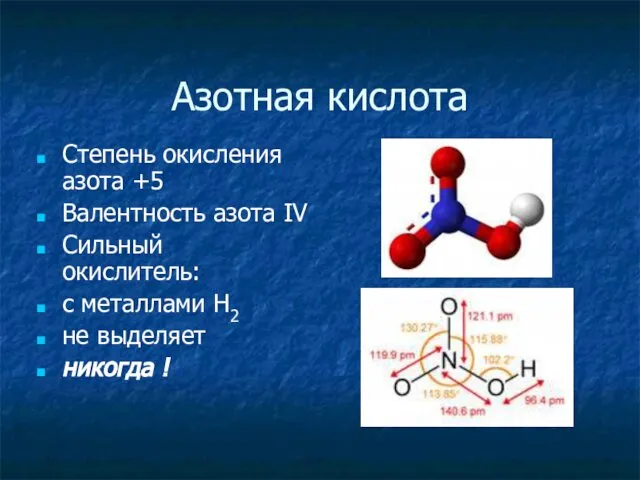
- 15. Азотная кислота Степень окисления азота +5 Валентность азота ΙV Сильный окислитель: с металлами Н2 не выделяет
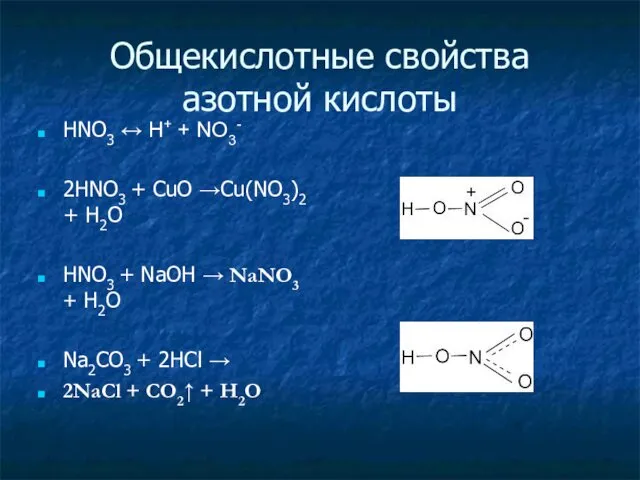
- 16. Общекислотные свойства азотной кислоты HNO3 ↔ H+ + NO3- 2HNO3 + CuO →Cu(NO3)2 + H2O HNO3
- 17. Окислительные свойства азотной кислоты Концентрированной w > 50% Cu + 4HNO3→Cu(NO3)2+ 2NO2↑ + 2H2O 8Na +
- 18. Окислительные свойства азотной кислоты РАЗБАВЛЕННОЙ 3Cu + 8HNO3→3Cu(NO3)2+ 2NO↑ + 4H2O 8Na + 9HNO3 → 8NaNO3
- 20. Скачать презентацию












 Что такое полупроводники
Что такое полупроводники Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Металлы. Общая характеристика
Металлы. Общая характеристика Ионный обмен или сорбция
Ионный обмен или сорбция Ковалентная неполярная химическая связь.
Ковалентная неполярная химическая связь.  Биоэлементы. Соотношение химических элементов в клетке
Биоэлементы. Соотношение химических элементов в клетке Нефть и газ. Химический состав и свойства
Нефть и газ. Химический состав и свойства Химическая термодинамика. Лекция 2
Химическая термодинамика. Лекция 2 Бензол и его свойства
Бензол и его свойства Ароматические углеводороды
Ароматические углеводороды Элементы группы VII B
Элементы группы VII B Коллигативные свойства растворов
Коллигативные свойства растворов Презентация по Химии "Раціональне використання добрив та проблеми охорони природи" - скачать смотреть бесплатно
Презентация по Химии "Раціональне використання добрив та проблеми охорони природи" - скачать смотреть бесплатно Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть
Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть  Биохимические и физико-химические процессы при производстве молочных продуктов
Биохимические и физико-химические процессы при производстве молочных продуктов Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния
Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті” Химическая кинетика и катализ
Химическая кинетика и катализ Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Химическое равновесие
Химическое равновесие Диаграмма состояния системы железо-углерод. Фазовые превращения сплавов железа
Диаграмма состояния системы железо-углерод. Фазовые превращения сплавов железа Электролитическая диссоциация
Электролитическая диссоциация