Химические свойства NO
NO – типичный восстановитель, обесцвечивает раствор перманганата калия:
Легко окисляется
кислородом воздуха. Реакция происходит очень быстро, так как оксид азота (II) обладает неспаренным электроном и по сути является радикалом:
Реакция приводит к образованию оксида азота (IV), который имеет характерный рыжевато-бурый цвет.
Менее характерны окислительные свойства (только с сильными восстановителями):
На родиевом катализаторе окисляет угарный газ до углекислого. Такие катализаторы ставят в выхлопные трубы автомобилей во избежание загрязнения угарным газом.
Биологическая роль:
NO способен проникать через мембраны клеток,. Эта молекула играет важную роль в регуляции кровяного давления, мышечной релаксации и участвует в неспецифическом иммунном ответе. Действие ряда препаратов, например, нитроглицерина, основано на образовании именно этой молекулы.
В то же время NO токсичен, так как способен связываться с гемоглобином подобно угарному газу и препятствовать переносу кислорода и углекислого газа.

























 Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5)
Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5) Щелочноземельные металлы
Щелочноземельные металлы Группа рассеянных химических элементов
Группа рассеянных химических элементов Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Водород. Открытие водорода
Водород. Открытие водорода Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Основные физико-химические процессы очистки воды. Опыт исследования коагулянтов и флокулянтов
Основные физико-химические процессы очистки воды. Опыт исследования коагулянтов и флокулянтов Реакции разложения
Реакции разложения Обобщение
Обобщение Получение и свойства азота
Получение и свойства азота Химическая кинетика
Химическая кинетика Лекарственное растительное сырье, содержащее алкалоиды
Лекарственное растительное сырье, содержащее алкалоиды Каталитикалық крекинг
Каталитикалық крекинг Насичені вуглеводні (алкани, парафіни)
Насичені вуглеводні (алкани, парафіни) Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Iodine
Iodine Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции
Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции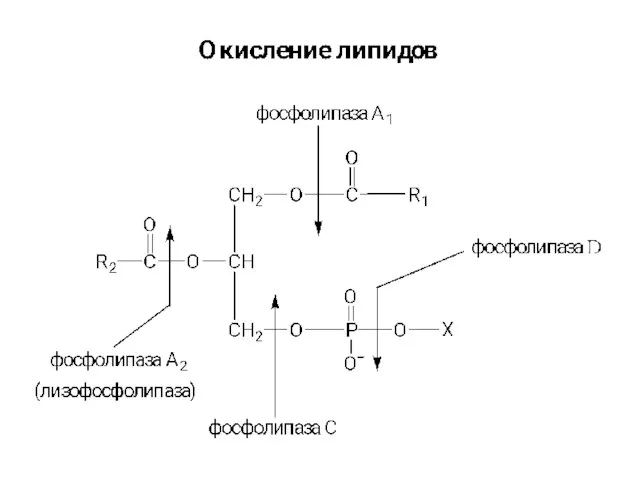 Бета-окисление жирных кислот
Бета-окисление жирных кислот Предельные одноатомные спирты. 10 класс
Предельные одноатомные спирты. 10 класс Введение в биохимию. Строение и функции белков (часть 2)
Введение в биохимию. Строение и функции белков (часть 2) Колообіг кальцію у природі Підготовила Йойна Юлія
Колообіг кальцію у природі Підготовила Йойна Юлія  Электролиттік диссоциация
Электролиттік диссоциация Витамины гетероциклического строения. (Тема 2)
Витамины гетероциклического строения. (Тема 2) Стекло и его разновидности
Стекло и его разновидности Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов
Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов Урок по химии в 10 классе: «Кислород и сера» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюкевич Юрий Михайлович
Урок по химии в 10 классе: «Кислород и сера» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюкевич Юрий Михайлович Гидролиз солей
Гидролиз солей Молочная кислота
Молочная кислота