Урок по химии в 10 классе: «Кислород и сера» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюкевич Юрий Михайлович
Содержание
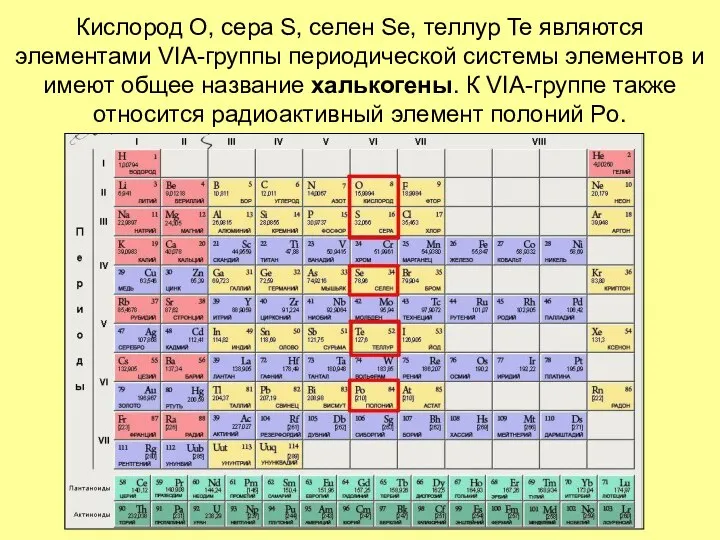
- 2. Кислород O, сера S, селен Se, теллур Te являются элементами VIА-группы периодической системы элементов и имеют
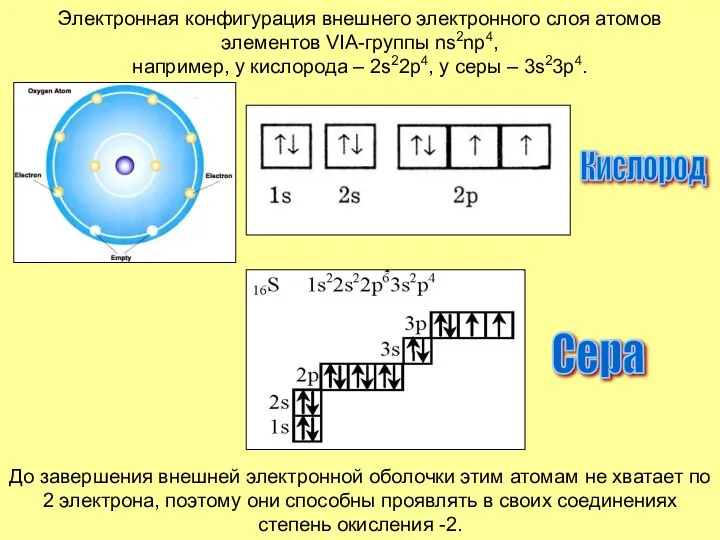
- 3. Электронная конфигурация внешнего электронного слоя атомов элементов VIA-группы ns2np4, например, у кислорода – 2s22p4, у серы
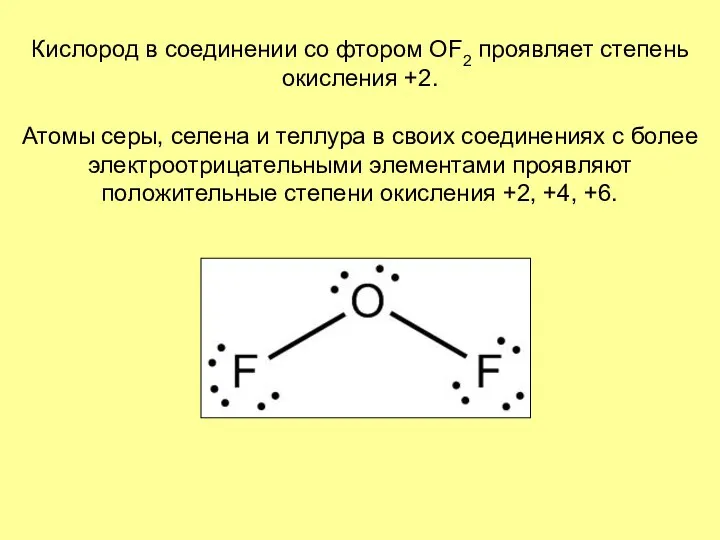
- 4. Кислород в соединении со фтором OF2 проявляет степень окисления +2. Атомы серы, селена и теллура в
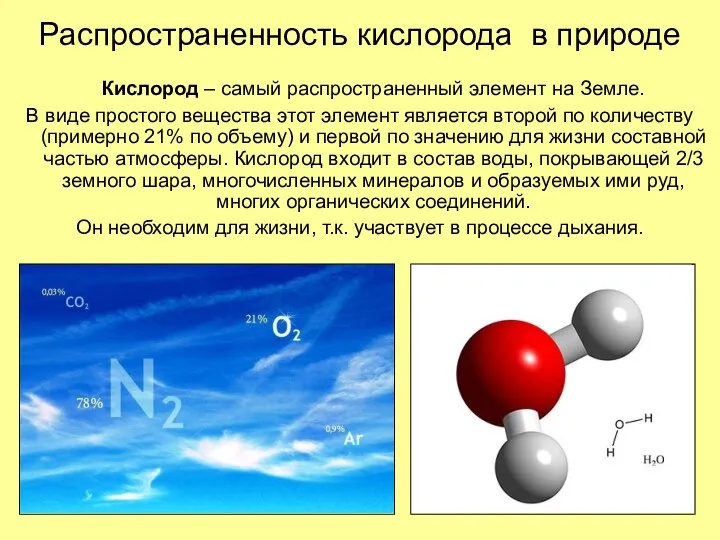
- 5. Распространенность кислорода в природе Кислород – самый распространенный элемент на Земле. В виде простого вещества этот
- 6. Распространенность серы в природе Сера в природе встречается в самородном состоянии, в виде соединений с металлами
- 7. Кислород
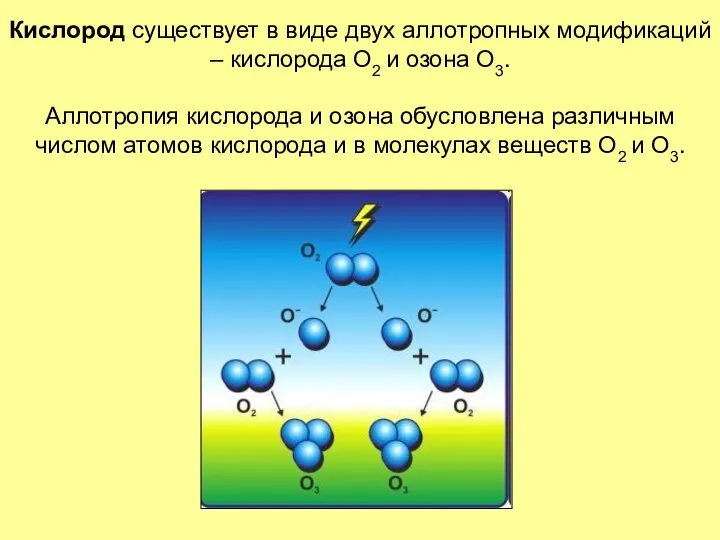
- 8. Кислород существует в виде двух аллотропных модификаций – кислорода О2 и озона О3. Аллотропия кислорода и
- 9. Простые вещества кислород и озон различаются по своим химическим свойствам. Кислород непосредственно взаимодействует со всеми простыми
- 10. Озон является более сильным окислителем, чем кислород. Многие малоактивные металлы, например серебро, ртуть, он окисляет уже
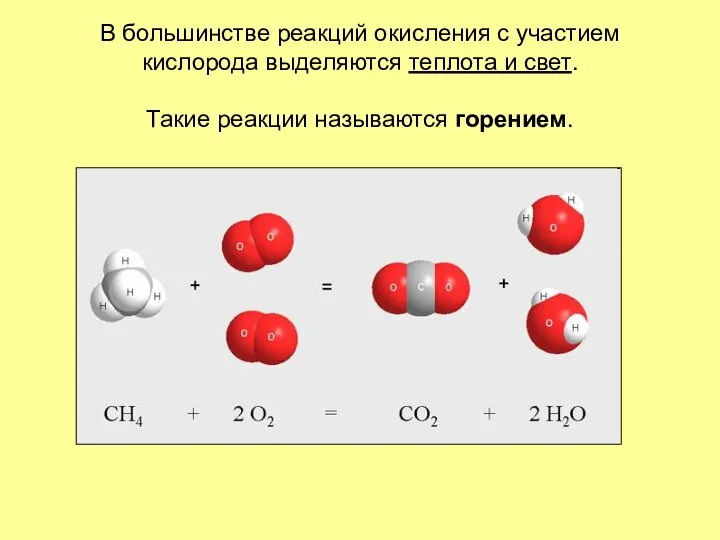
- 11. В большинстве реакций окисления с участием кислорода выделяются теплота и свет. Такие реакции называются горением.
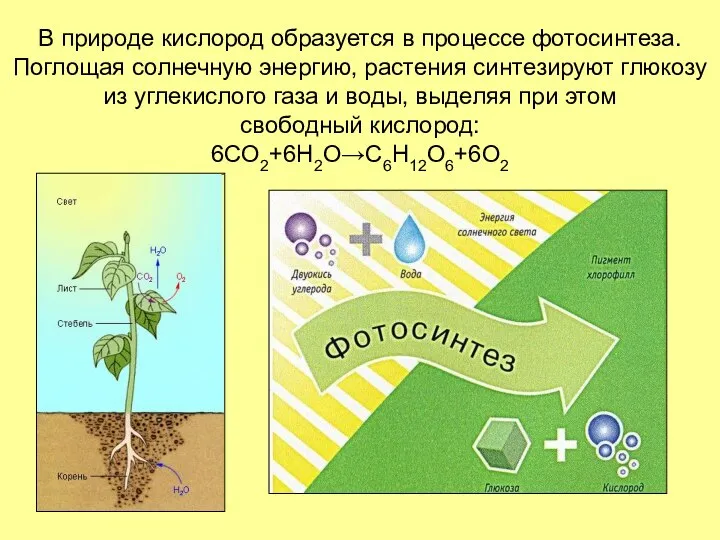
- 12. В природе кислород образуется в процессе фотосинтеза. Поглощая солнечную энергию, растения синтезируют глюкозу из углекислого газа
- 13. Озон получают при действии электрического разряда на кислород в специальном приборе – озонаторе. В природе озон
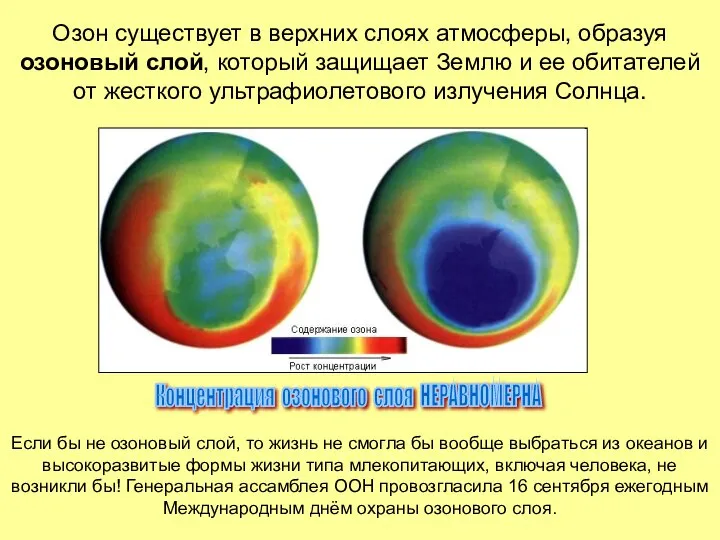
- 14. Озон существует в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от
- 15. Применение кислорода Для дыхания: Медицинский кислород хранится в металлических газовых баллонах высокого давления. Для подачи кислорода
- 16. Применение кислорода - В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота
- 17. Применение озона О3 - при получении многих веществ в лабораторной и промышленной практике; - для отбеливания
- 18. Сера
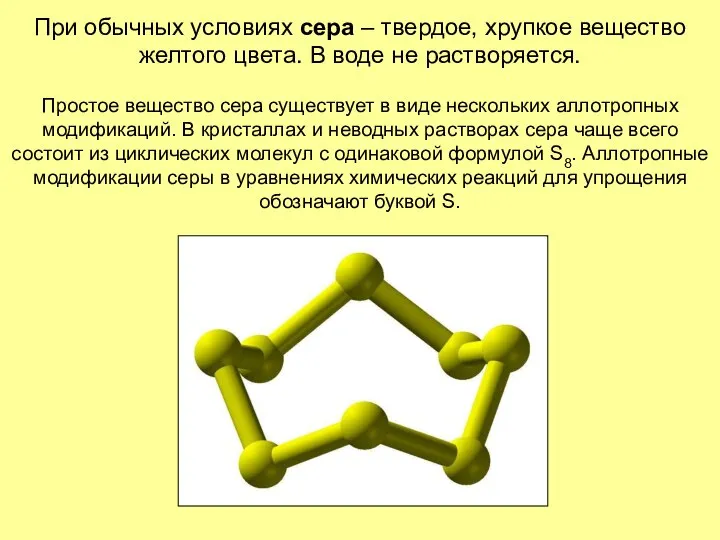
- 19. При обычных условиях сера – твердое, хрупкое вещество желтого цвета. В воде не растворяется. Простое вещество
- 20. Химические свойства серы Окислительные свойства серы проявляются при ее взаимодействии с металлами, кроме золота и платины,
- 21. Применение серы Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и
- 22. Вулкан Кава Джен , который находиться в регионе Индонезии (Восточная Ява), примерно 2,6 км высотой, имеет
- 23. Домашнее задание: Параграф §45.
- 25. Скачать презентацию













 Реология расплавов и растворов полимеров
Реология расплавов и растворов полимеров Основные сведения о строении атомов
Основные сведения о строении атомов Кислоты
Кислоты Чугуны. Лекция 6
Чугуны. Лекция 6 Предельные одноатомные спирты
Предельные одноатомные спирты Метод комплексонометрического титрования (лекция 8)
Метод комплексонометрического титрования (лекция 8) Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Коррозия железа и его сплавов в различных средах
Коррозия железа и его сплавов в различных средах СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Металлические стёкла (аморфные металлы)
Металлические стёкла (аморфные металлы) Способ вызвать быструю, но контролируемую коррозию железа
Способ вызвать быструю, но контролируемую коррозию железа Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Буферные системы
Буферные системы Плавление и кипение
Плавление и кипение Физическая химия растворов электролитов
Физическая химия растворов электролитов Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева Производство чугуна. (9 и 11 класс)
Производство чугуна. (9 и 11 класс) Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами
Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Биополимеры Диктант
Биополимеры Диктант IndustrialAlpinism (Средства для мытья фасадов)
IndustrialAlpinism (Средства для мытья фасадов) Неорганические соединения фосфора
Неорганические соединения фосфора Синтез высокооктановых компонентов топлива
Синтез высокооктановых компонентов топлива Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ (Продолжение)
Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ (Продолжение) Изомерия моносахаридов
Изомерия моносахаридов Периодическая система химических элементов. Простые и сложные вещества
Периодическая система химических элементов. Простые и сложные вещества