Содержание
- 2. Элементы IIA группы Be Mg Ca Sr Ba Ra Щелочноземельные металлы Ra ― радиоактивный элемент Радий-226
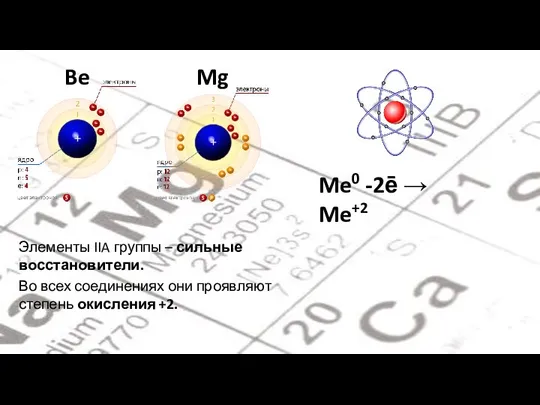
- 3. Be Mg Me0 -2ē → Me+2 Элементы IIA группы – сильные восстановители. Во всех соединениях они
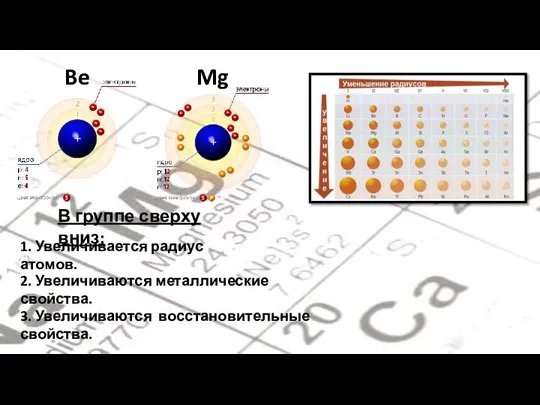
- 4. Be Mg В группе сверху вниз: 1. Увеличивается радиус атомов. 2. Увеличиваются металлические свойства. 3. Увеличиваются
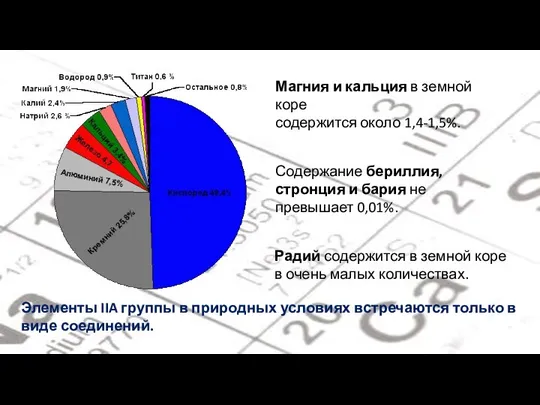
- 5. Магния и кальция в земной коре содержится около 1,4-1,5%. Содержание бериллия, стронция и бария не превышает
- 6. Физические свойства: Это типичные металлы с характерным металлическим блеском. Представляют собой серебристо-белые металлы, а стронций имеет
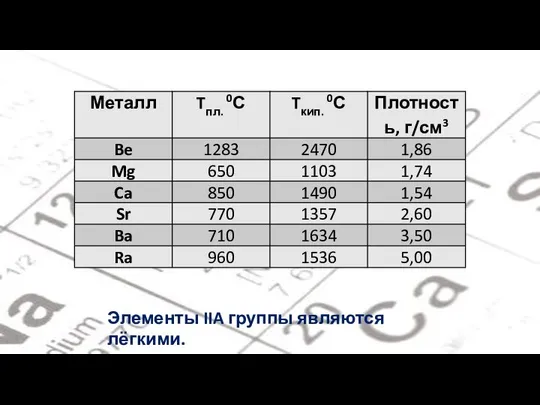
- 7. Элементы IIA группы являются лёгкими.
- 8. Получение: MgCl2 = Mg + Cl2↑ CaCl2 = Ca + Cl2↑ Электролиз расплавов
- 9. Химические свойства Be Mg + O2 = Только при нагревании 2Ca + O2 = 2CaO 0
- 10. Реакции с азотом Химические свойства Ra реагирует с азотом при комнатной температуре. 3Ba + N2 =
- 11. Реакции с галогенами Химические свойства 0 0 +2 -1 хлорид кальция Ca + Cl2 = CaCl2
- 12. Реакции с серой Химические свойства 0 0 +2 -2 сульфид магния 0 0 +2 -1 гидрид
- 13. Реакции с водой Химические свойства Mg + 2H2O = Mg(OH)2 + H2↑ Ca + 2H2O =
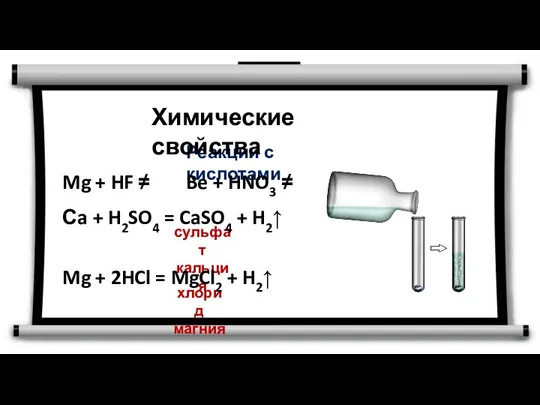
- 14. Реакции с кислотами Химические свойства сульфат кальция хлорид магния Mg + HF ≠ Be + HNO3
- 15. Реакции с растворами солей Химические свойства Mg + FeSO4 = MgSO4 + Fe
- 17. Скачать презентацию









 Реология расплавов и растворов полимеров
Реология расплавов и растворов полимеров Основные сведения о строении атомов
Основные сведения о строении атомов Кислоты
Кислоты Чугуны. Лекция 6
Чугуны. Лекция 6 Предельные одноатомные спирты
Предельные одноатомные спирты Метод комплексонометрического титрования (лекция 8)
Метод комплексонометрического титрования (лекция 8) Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Коррозия железа и его сплавов в различных средах
Коррозия железа и его сплавов в различных средах СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Металлические стёкла (аморфные металлы)
Металлические стёкла (аморфные металлы) Способ вызвать быструю, но контролируемую коррозию железа
Способ вызвать быструю, но контролируемую коррозию железа Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Буферные системы
Буферные системы Плавление и кипение
Плавление и кипение Физическая химия растворов электролитов
Физическая химия растворов электролитов Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева Производство чугуна. (9 и 11 класс)
Производство чугуна. (9 и 11 класс) Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами
Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Биополимеры Диктант
Биополимеры Диктант IndustrialAlpinism (Средства для мытья фасадов)
IndustrialAlpinism (Средства для мытья фасадов) Неорганические соединения фосфора
Неорганические соединения фосфора Синтез высокооктановых компонентов топлива
Синтез высокооктановых компонентов топлива Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ (Продолжение)
Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ (Продолжение) Изомерия моносахаридов
Изомерия моносахаридов Периодическая система химических элементов. Простые и сложные вещества
Периодическая система химических элементов. Простые и сложные вещества