Содержание
- 2. Білки – високомолекулярні полімерні азотомісні сполуки, що складаються з амінокислот, зв'язаних пептидним зв'язком. Білки відіграють ряд
- 3. Функції білків Структурна – білки є обов'язковим компонентом клітинних мембран, з білків побудовані сухожилля, зв'язки, найбільш
- 4. Функції білків Каталітична (ферментативна) – тільки білки є природними каталізаторами, прискорювачами хімічних реакцій. Без ферментів у
- 5. Функції білків Захисна – тільки білки виконують функцію захисту від чужорідних тіл, це: імуноглобуліни (антитіла), що
- 6. Функції білків Газообмінна (дихальна) – перенесення газів: кисню, вуглекислого газу. У крові цю функцію виконує гемоглобін,
- 7. Функції білків Транспортна – лише білки здатні переносити інші речовини: ліпіди, вітаміни, мінерали, пігменти. Білок трансферин
- 8. Функції білків Підтримання гомеостазу – білки формують білкову буферну систему, що підтримує рН крові, білки створюють
- 9. Властивості білків Білки володіють низкою властивостей, характерних лише для даного класу сполук: Специфічність – кожен живий
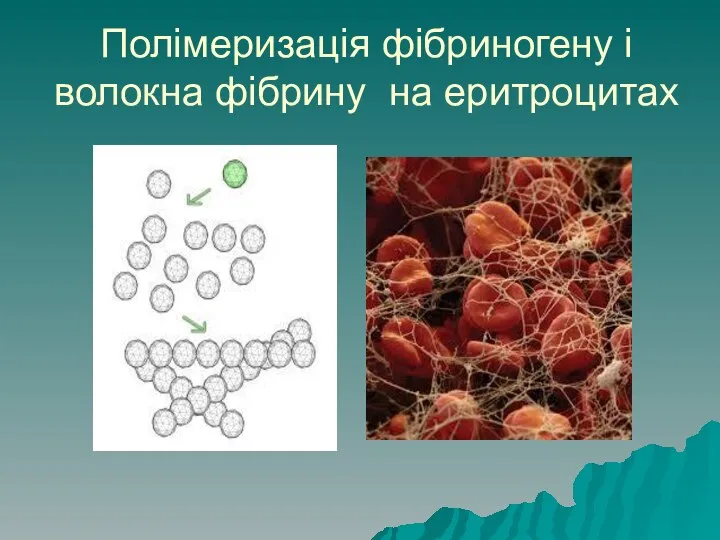
- 10. Властивості білків Здатність до коагуляції: при втраті електричного заряду та сольватної оболонки білки злипаються між собою,
- 11. Полімеризація фібриногену і волокна фібрину на еритроцитах
- 12. Властивості білків Висолювання – здатність білків під впливом електролітів (солей) втрачати молекули води, що знаходяться всередині
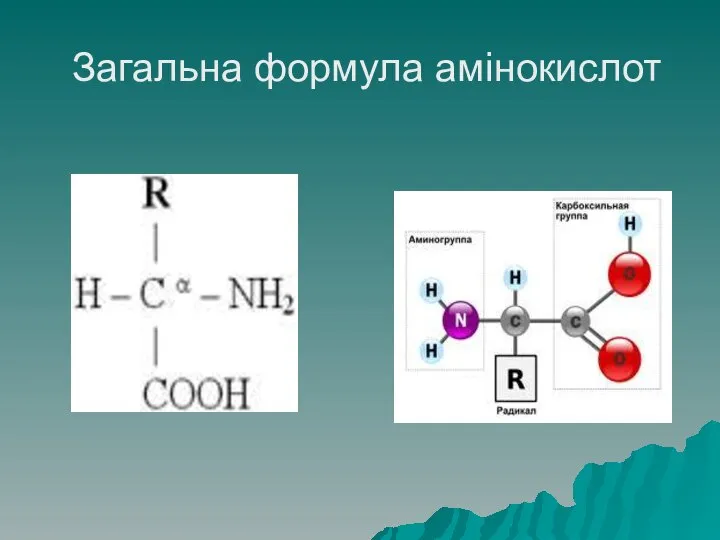
- 13. Будова амінокислот Амінокислоти – мономери білків, є похідними органічних кислот, всі амінокислоти, що входять до складу
- 14. Загальна формула амінокислот
- 15. Будова амінокислот До складу білків входить 19 різних амінокислот, які відрізняються за будовою радикала (R), який
- 16. Властивості амінокислот Для амінокислот характерна амфотерність – здатність одночасно проявляти кислі та лужні властивості. Кислі властивості
- 17. Амфотерність амінокислот
- 18. Класифікація амінокислот Амінокислоти класифікують за двома ознаками: за зарядом радикала амінокислот (позитивно заряджені, негативно заряджені, неполярні
- 19. Класифікація амінокислот За будовою радикала амінокислоти поділяють на лінійні та циклічні. Лінійні поділяють у залежності від
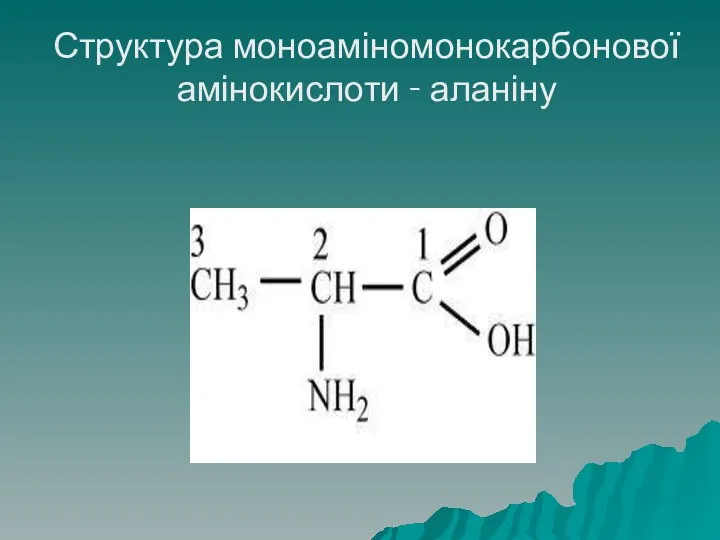
- 20. Класифікація амінокислот Молекула моноамінокарбонових амінокислот містить одну (моно-) аміногрупу і одну карбоксильну групу. До даного класу
- 21. Структура моноаміномонокарбонової амінокислоти - аланіну
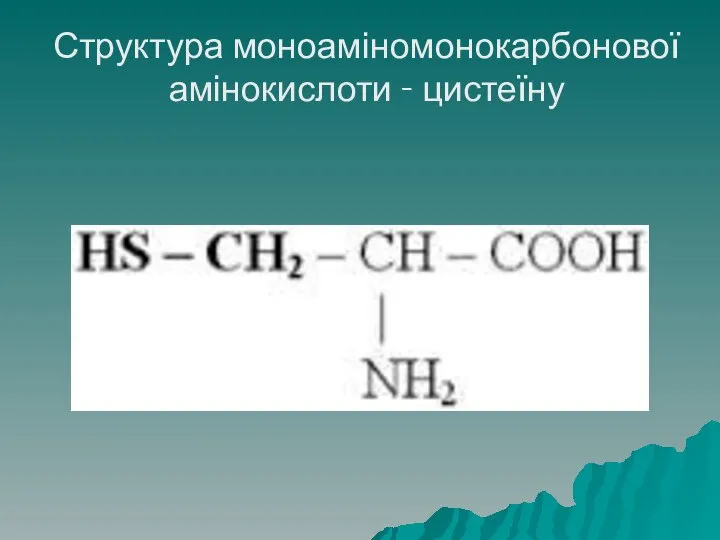
- 22. Структура моноаміномонокарбонової амінокислоти - цистеїну
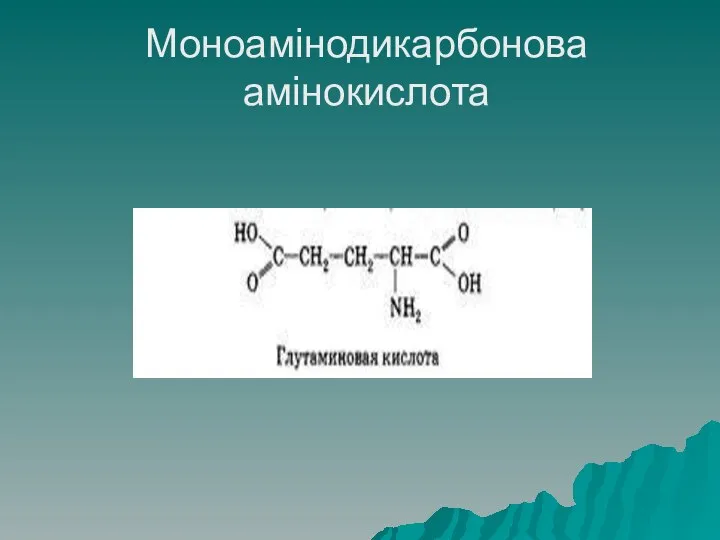
- 23. Класифікація амінокислот Моноамінодикарбонові кислоти мають одну аміногрупу і дві каррбоксильні, до даної групи належать: аспарагінова кислота
- 24. Моноамінодикарбонова амінокислота
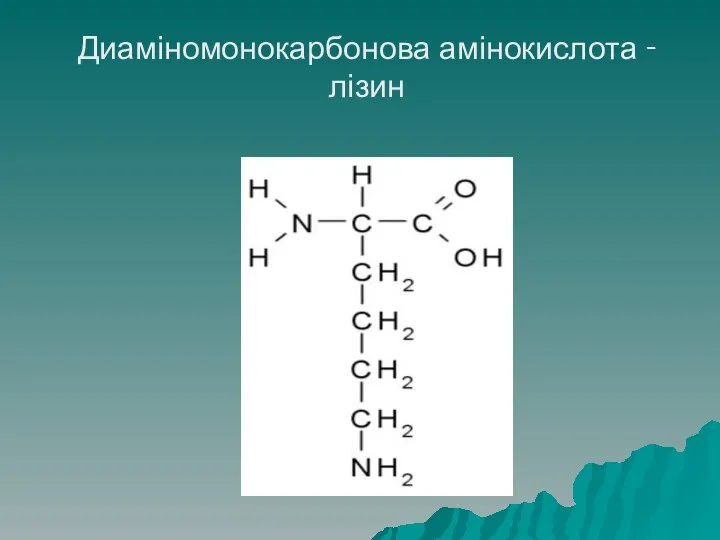
- 25. Класифікація амінокислот Диаміномонокарбонові – містять дві аміногрупи і одну карбоксильну, до даної групи належать: аргінін, лізіин,
- 26. Диаміномонокарбонова амінокислота - лізин
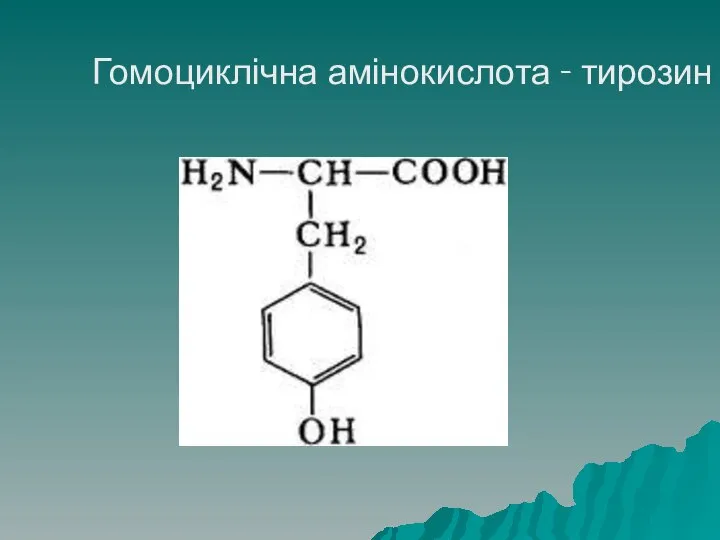
- 27. Класифікація амінокислот Циклічні амінокислоти поділяють на гомоциклічні, у яких цикл однорідний (складається лише з атомів Карбону)
- 28. Гомоциклічна амінокислота - тирозин
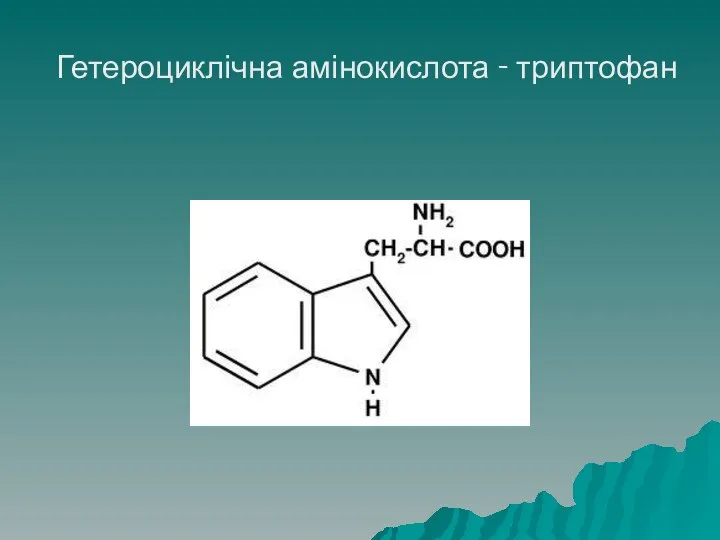
- 29. Класифікація амінокислот До гетероциклічних належать триптофан, гістидин і імінокислота - пролін
- 30. Гетероциклічна амінокислота - триптофан
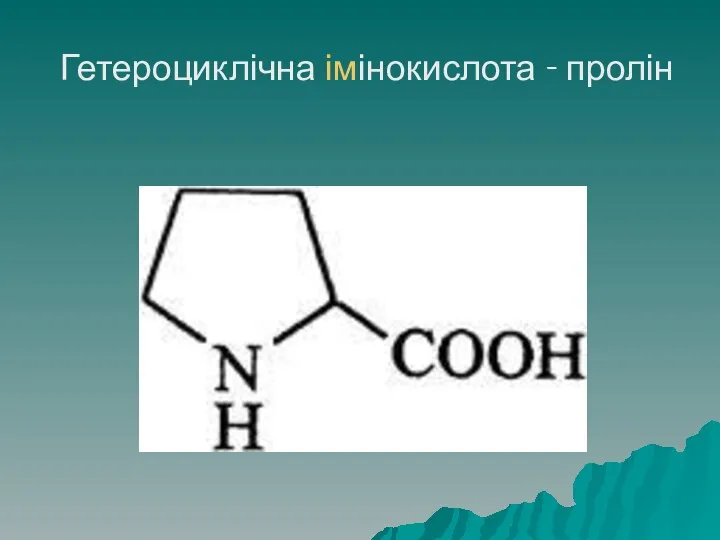
- 31. Гетероциклічна імінокислота - пролін
- 32. Структура білків Амінокислоти здатні взаємодіяти між собою ( реакція конденсації) утворюючи полімерні ланцюги. При взаємодії амінокислот
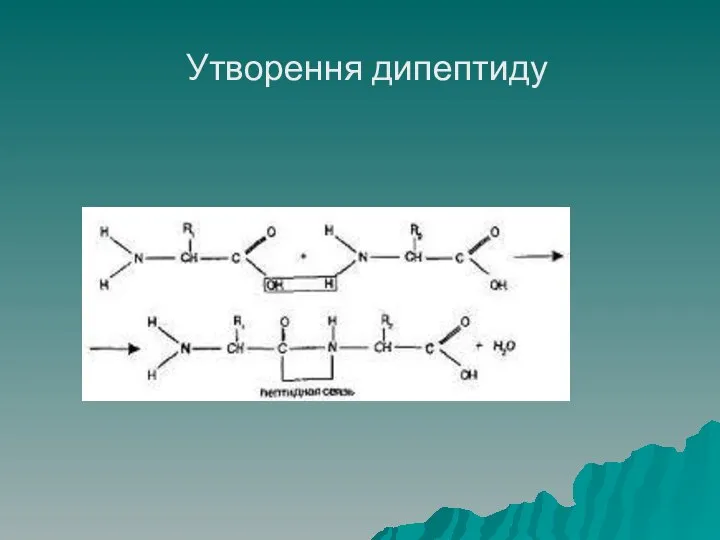
- 33. Утворення дипептиду
- 34. Структура білків Якщо пептидним зв'язком зв'язані дві амінокислоти, то таке утворення називають дипептидом, три – трипептидом
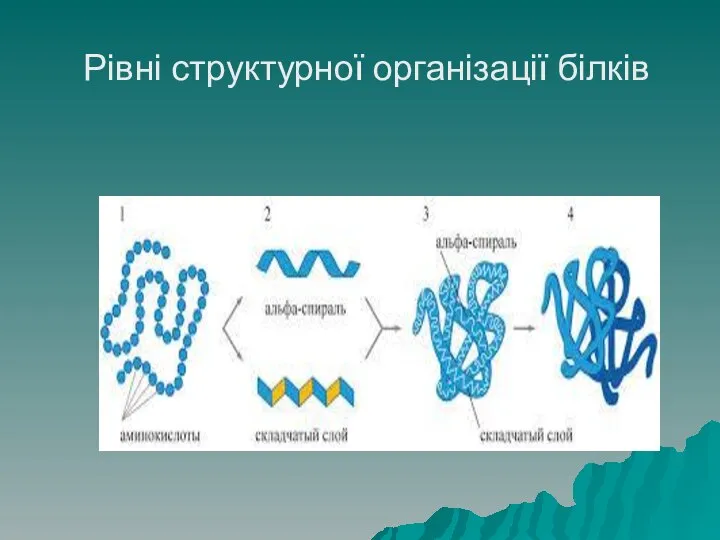
- 35. Структура білків Білки мають 4 рівні структурної організації молекули. Первинна структура білка – це лінійний ланцюг,
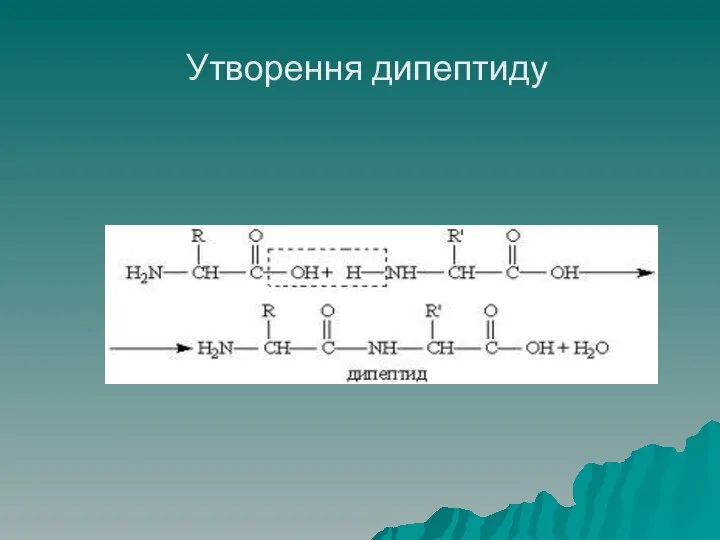
- 36. Утворення дипептиду
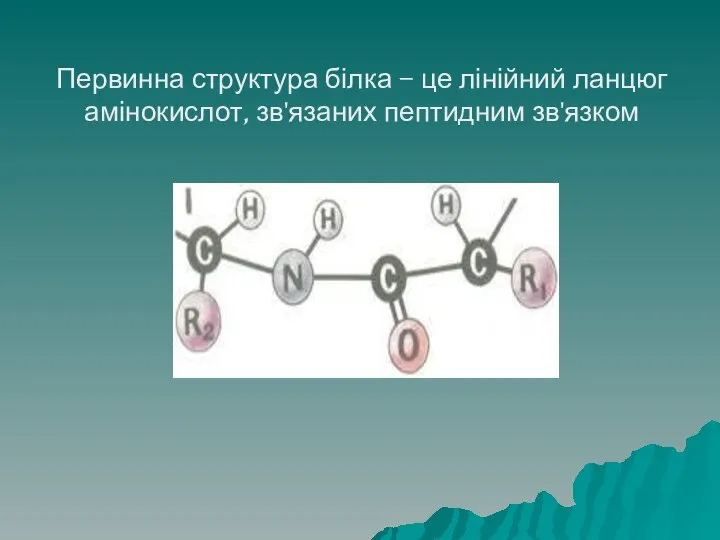
- 37. Первинна структура білка – це лінійний ланцюг амінокислот, зв'язаних пептидним зв'язком
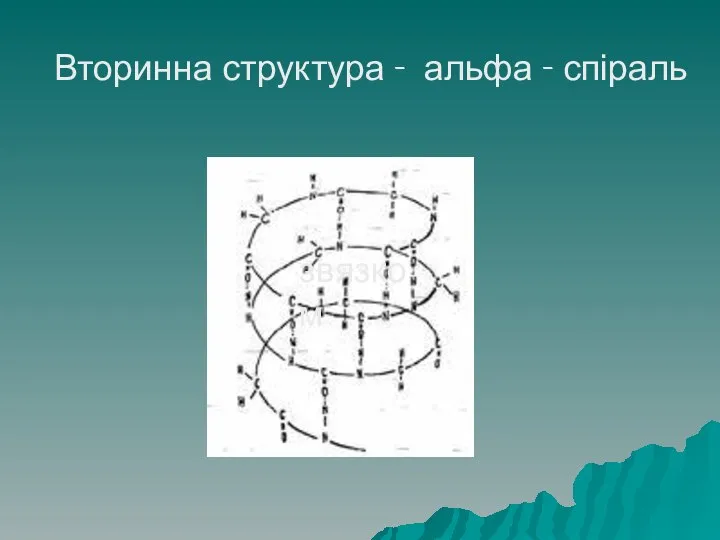
- 38. Структура білків Вторинна структура буває двох видів – у вигляді α – спіралі: правозакручена спіраль, висота
- 39. Вторинна структура - альфа - спіраль звязком
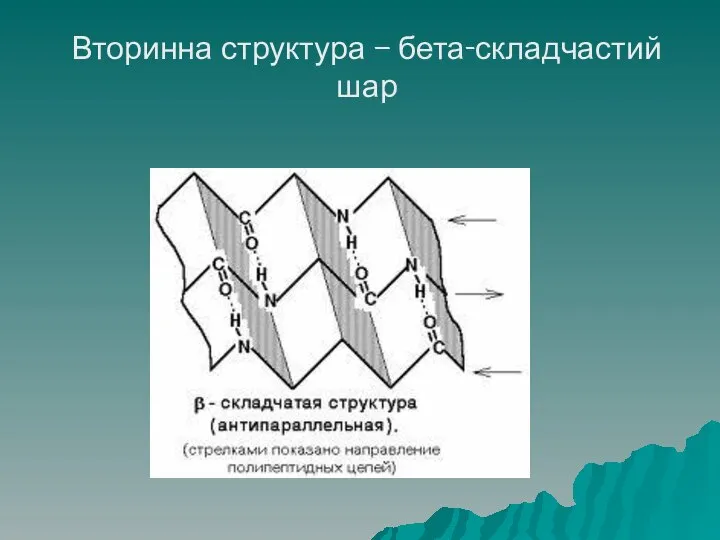
- 40. Структура білків Бета – складчастий шар – другий вид вторинної структури: поліпептидні ланцюги знаходяться на одній
- 41. Вторинна структура – бета-складчастий шар
- 42. Структура білків Третинна структура білків – це компактно (щільно) викладена у просторі вторинна структура, найчастіше має
- 43. Третинна структура білка
- 44. Структура білків Четвертинна структура – це декілька глобул третинної структури з'єднаних між собою, найчастіше кількість глобул
- 45. Четвертинна структура білків
- 46. Рівні структурної організації білків
- 47. Структура білків Домени – це специфічні структури, що мають вигляд спіралі, однак вона побудована не з
- 48. Доменні структури у молекулі білка
- 49. Утворення доменів
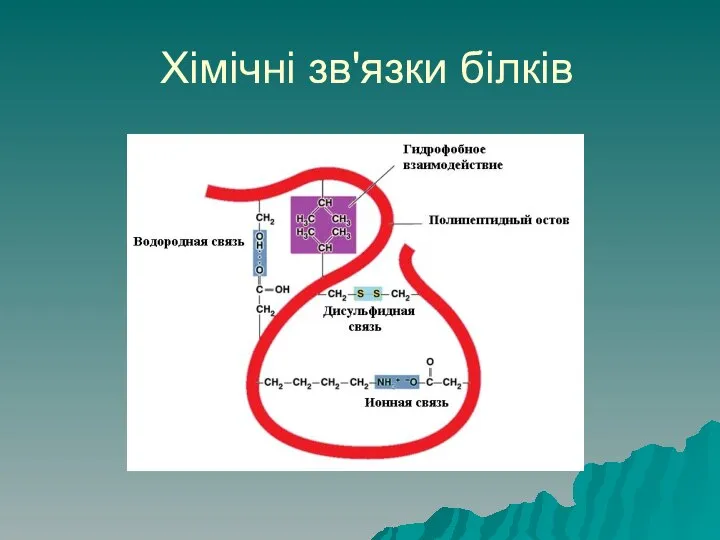
- 50. Хімічні зв'язки білків Структуру білків підтримують ряд хімічних зв'язків: Первинну структуру забезпечують пептидні зв'язки (ковалентні). Вторинну
- 51. Хімічні зв'язки білків Третинну структуру підтримують дисульфідні зв'язки (ковалентні) між атомами сульфуру амінокислоти цистеїну –S-S-. Гідрофобні
- 52. Хімічні зв'язки білків
- 53. Класифікація білків Існує дві класифікації білків: за формою молекули та за складністю будови. За формою молекули
- 54. Глобулярні білки Глобулярні білки мають округлу форму і у свою чергу поділяються на: альбуміни і глобуліни.
- 55. Глобулярні білки у розчинах електролітів. Надзвичайно легко осаджуються (розведеними розчинами електролітів).
- 56. Фібрилярні білки Фібрилярні білки – мають ниткоподібну форму, структурною одиницею є три поліпептидні ланцюги, заплетені у
- 57. Глобулярні білки
- 58. Фібрилярні білки
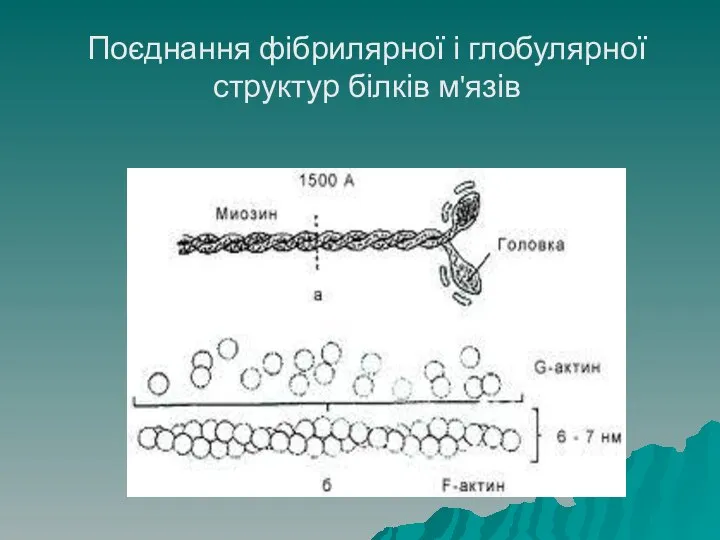
- 59. Структура білків Глобулярні білки можуть об'єднуватись у лінійні структури, які є фібрилярними. Прикладом є білок м'язів
- 60. Поєднання фібрилярної і глобулярної структур білків м'язів
- 61. Прості і складні білки За складністю будови білки поділяються на прості – протеїни, складаються лише з
- 62. Фосфопротеїди Фосфопротеїди у якості небілкової групи містять залишки фосфатної кислоти, у більшості це резервні білки, ферменти:
- 63. Казеїн - фосфопротеїд
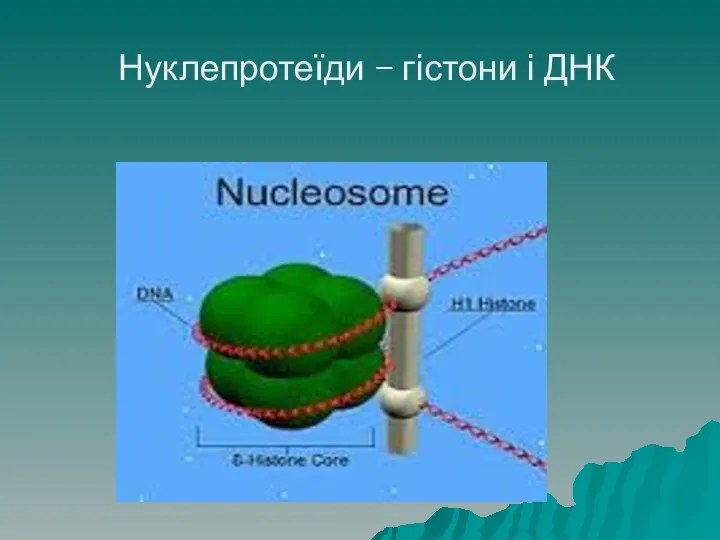
- 64. Нуклепротеїди Нуклеопротеїди – це білки, зв'язані з нуклеїновими кислотами. Прикладом є білки. Що утворюють нуклеосоми хромосом.
- 65. Нуклепротеїди – гістони і ДНК
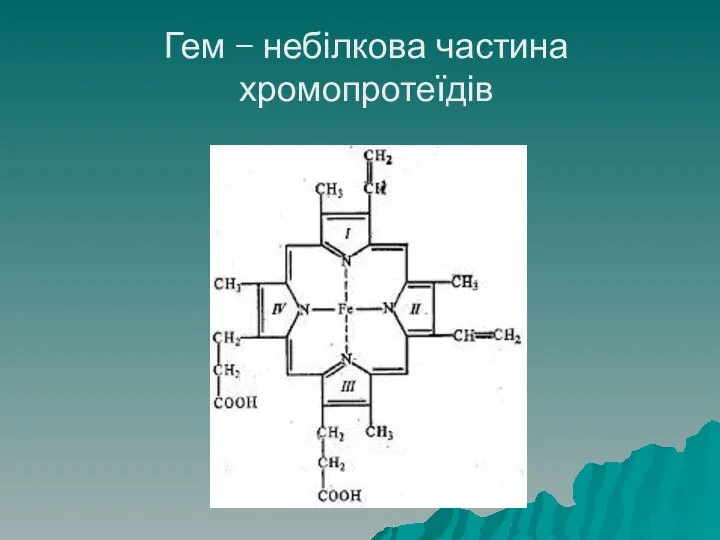
- 66. Хромопротеїди Хромопротеїди – клас складних білків, що мають різноманітне забарвлення, яке їм надає небілкова група, що
- 67. Гем – небілкова частина хромопротеїдів
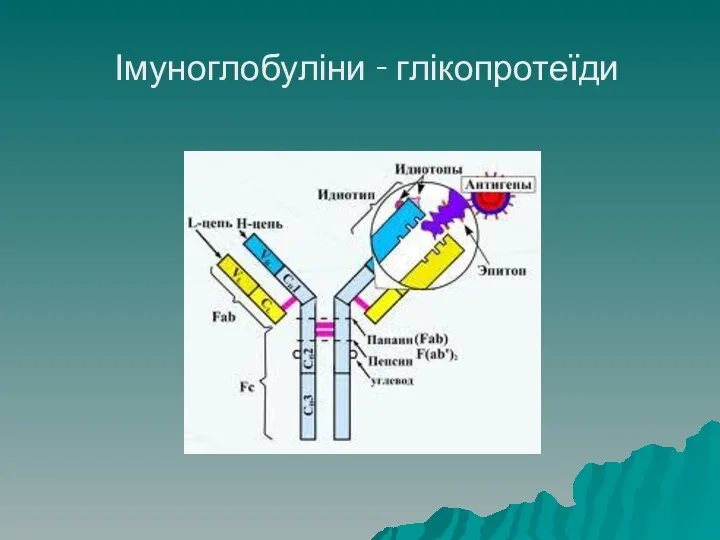
- 68. Глікопротеїди Глікопротеїди – складні білки, що містять вуглеводний компонент, у якості такого можуть бути похідні глюкози,
- 69. Імуноглобуліни - глікопротеїди
- 70. Білки - пріони Існує група патогенних білків – пріонів (від слів: protein та infection), які здатні
- 72. Скачать презентацию

















































 Periodic Table of the Elements
Periodic Table of the Elements «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Основы химической технологии
Основы химической технологии Содержание ртути и её соединений в воздухе при использовании осветительных ламп
Содержание ртути и её соединений в воздухе при использовании осветительных ламп Нитрофенилалкиламины
Нитрофенилалкиламины Получение гидроксида никеля (II)
Получение гидроксида никеля (II) Презентация по Химии "Насичені вуглеводні. Застосування." - скачать смотреть бесплатно
Презентация по Химии "Насичені вуглеводні. Застосування." - скачать смотреть бесплатно Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Виконали: Алексеенко О.В. Перегонцева А.А.
Виконали: Алексеенко О.В. Перегонцева А.А.  Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Миграция химических элементов (геохимическая миграция)
Миграция химических элементов (геохимическая миграция) Композиционные или композитные материалы
Композиционные или композитные материалы Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Значення хімії в повсякденному житті
Значення хімії в повсякденному житті  Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Полезные ископаемые. Золото
Полезные ископаемые. Золото Непредельные углеводороды: алкены
Непредельные углеводороды: алкены Свойства солей. Получение солей
Свойства солей. Получение солей Основы кристаллографии
Основы кристаллографии Упражнение в расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса
Упражнение в расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса Химический элемент кислород
Химический элемент кислород Радиоактивный распад. Чернобыль
Радиоактивный распад. Чернобыль Энтропия. Изменение энтропии в изопроцессах
Энтропия. Изменение энтропии в изопроцессах Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Коррозия (лат. corrosio — «жегіде»)- қоршаған ортаның әсерінен метал бетінің бүлінуі
Коррозия (лат. corrosio — «жегіде»)- қоршаған ортаның әсерінен метал бетінің бүлінуі Вольфрам. Знаходження в періодичній системі
Вольфрам. Знаходження в періодичній системі