Содержание
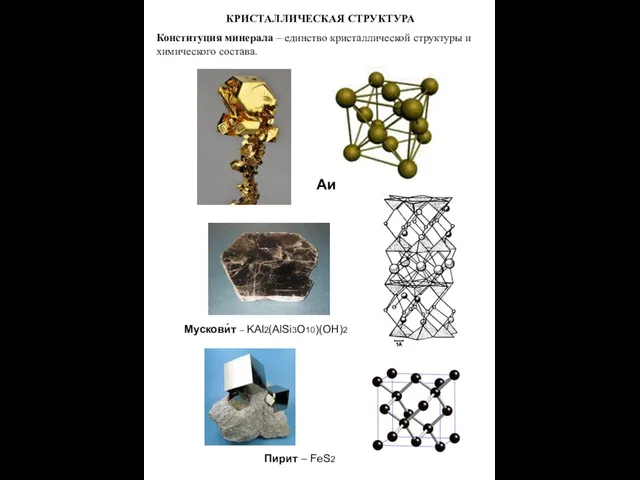
- 2. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА Конституция минерала – единство кристаллической структуры и химического состава. Аи Мускови́т – KAl2(AlSi3O10)(OH)2 Пирит
- 3. Свойства кристаллических веществ Пространственная, или кристаллическая, решетка: - узлы (отдельные точки, центры тяжести атомов и ионов),
- 4. Химическая связь в минералах Кристаллическое поле – общее кристаллическое пространство взаимодействующих атомов Типы химической связи Ионная
- 5. Металлическая («электронный газ») – Си, Аи Вандерваальсова (остаточная) связь: дальнее взаимодействие электронейтральных частей Сера – S,
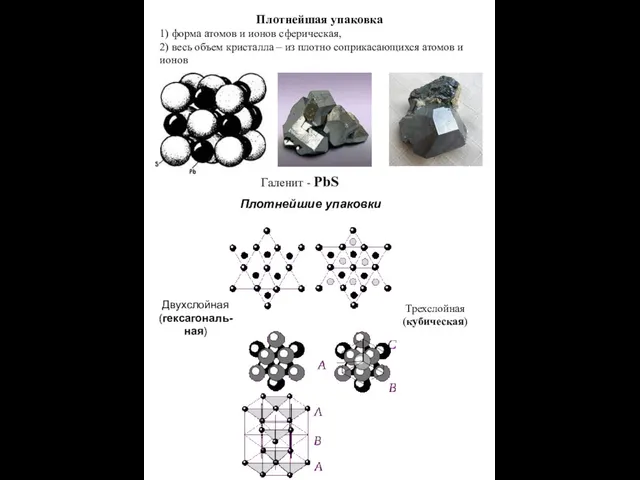
- 6. Плотнейшая упаковка 1) форма атомов и ионов сферическая, 2) весь объем кристалла – из плотно соприкасающихся
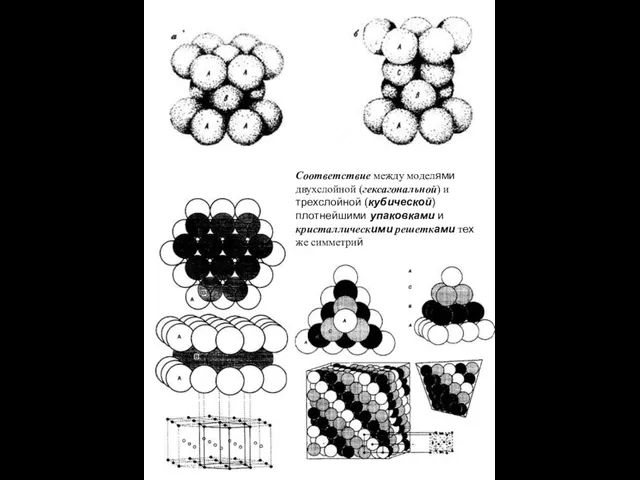
- 7. Соответствие между моделями двухслойной (гексагональной) и трехслойной (кубической) плотнейшими упаковками и кристаллическими решетками тех же симметрий
- 8. Пустоты между шарами (26% объема) Типы: тетраэдрические и октаэдрические. Факторы многообразия структур минералов: тип упаковки, размер
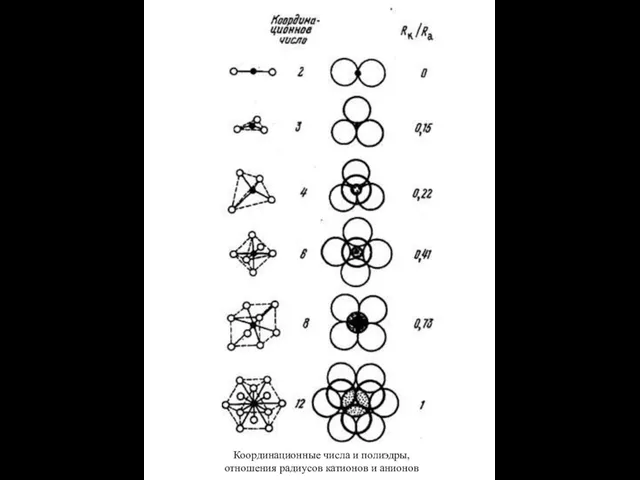
- 9. КООРДИНАЦИОННЫЕ ЧИСЛА АТОМОВ Число ближайших соседних атомов в структуре минерала. Галит (NaCl): у атомов натрия и
- 10. Координационные числа и полиэдры, отношения радиусов катионов и анионов
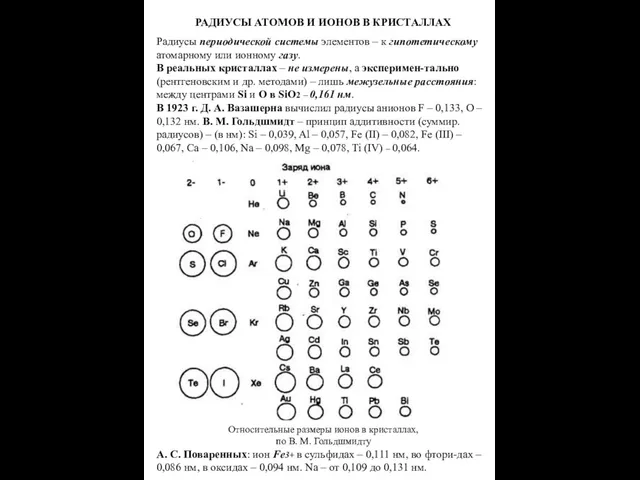
- 11. РАДИУСЫ АТОМОВ И ИОНОВ В КРИСТАЛЛАХ Радиусы периодической системы элементов – к гипотетическому атомарному или ионному
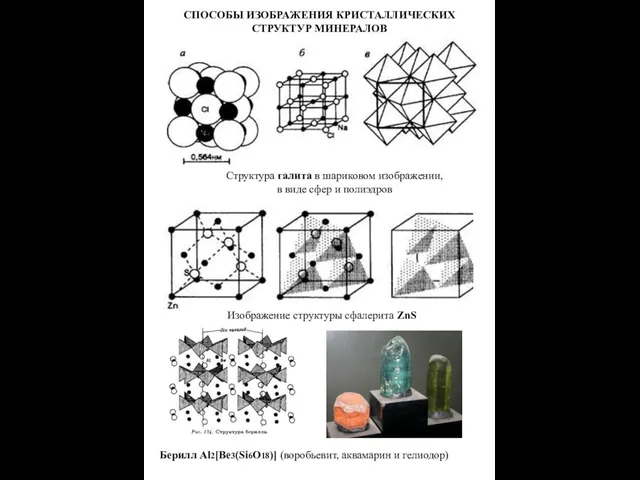
- 12. СПОСОБЫ ИЗОБРАЖЕНИЯ КРИСТАЛЛИЧЕСКИХ СТРУКТУР МИНЕРАЛОВ Структура галита в шариковом изображении, в виде сфер и полиэдров Изображение
- 13. Полиморфизм Вещества одного состава, но разной структуры: - полиморфные модификации (физика и химия), разные минералы (минералогия).
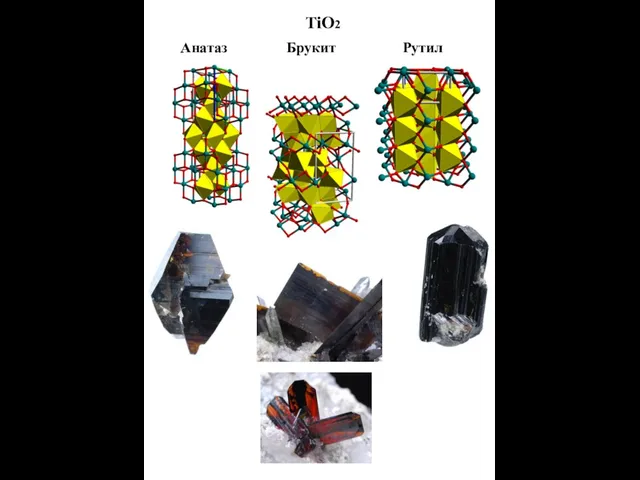
- 14. TiO2 Анатаз Брукит Рутил
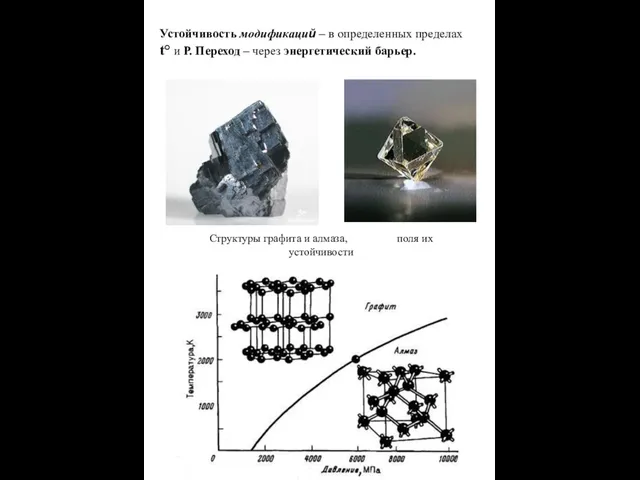
- 15. Устойчивость модификаций – в определенных пределах t° и Р. Переход – через энергетический барьер. Структуры графита
- 16. ИЗОМОРФИЗМ Изоструктурные соединения Fе2Оз (гематит) и Аl2Оз (корунд), SпО2 (касситерит), МпО2 (пиролюзит) и ТiO2 (рутил) Шпинель
- 17. Твердые растворы Явления замещения атомов, соответствующих по заряду и размеру – непрерывное изменение химического состава изоструктурных
- 18. Типы изоморфизма По характеру сохранения электронейтральности крис-таллической решетки (тип компенсации валентностей): а) изовалентный – замена ионов
- 20. Скачать презентацию









 Бензины. Общие свойства топлив
Бензины. Общие свойства топлив Влияние обработки семян фасоли растворами химических веществ на рост и развитие растений
Влияние обработки семян фасоли растворами химических веществ на рост и развитие растений Урок химии на тему: «Типы химических реакций»
Урок химии на тему: «Типы химических реакций»  Нитрозный способ получения серной кислоты Мой любимый синтез
Нитрозный способ получения серной кислоты Мой любимый синтез Физические свойства металлов
Физические свойства металлов Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері
Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері Роль воды в химических реакциях
Роль воды в химических реакциях АСПІРИН, ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ЙОГО ПЛЮСИ ТА МІНУСИ Малькевич Анастасія Вікторівна 11-А
АСПІРИН, ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ЙОГО ПЛЮСИ ТА МІНУСИ Малькевич Анастасія Вікторівна 11-А  Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Спирты. Органическая химия
Спирты. Органическая химия Таблица Менделеева
Таблица Менделеева Химия вокруг нас
Химия вокруг нас Organic compounds: nomenclature
Organic compounds: nomenclature Матеріалознавство. Будова твердих тіл та вплив на їх властивості
Матеріалознавство. Будова твердих тіл та вплив на їх властивості Экологическая оценка качества воды поверхностных водоемов г. Донецка
Экологическая оценка качества воды поверхностных водоемов г. Донецка Аттестационная работа. Методическая разработка занятия клуба Я – исследователь по теме Волшебное вещество ‒ соль
Аттестационная работа. Методическая разработка занятия клуба Я – исследователь по теме Волшебное вещество ‒ соль Бытовая не химия
Бытовая не химия Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Концентрации никеля
Концентрации никеля Термоэластопласты. Классификация ТЭП
Термоэластопласты. Классификация ТЭП α-Аминокислоты
α-Аминокислоты Химическая связь (лекция 4)
Химическая связь (лекция 4) Галогенопохідні ароматичних вуглеводнів
Галогенопохідні ароматичних вуглеводнів Продуктивная экстракция
Продуктивная экстракция Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно
Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно Алюминий. Положение в Периодической системе
Алюминий. Положение в Периодической системе Процессы и аппараты химической технологии
Процессы и аппараты химической технологии Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика