Содержание
- 2. Свойства солей Некоторые физические свойства: все соли – твердые кристаллические вещества.Соли имеют различную окраску. Каждая индивидуальная
- 3. По растворимости в воде 1) растворимые. Это соли щелочных металлов, соли аммония, нитраты и ацетаты, сульфиды
- 4. 2) малорастворимые AgCl, CuCl, Hg2Cl2, PbCl2
- 5. 3) Нерастворимые все сульфиды, карбонаты, сульфиты, силикаты, фосфаты (кроме солей аммония, щелочных металлов, сульфидов магния и
- 6. Химические свойства средних солей 1. Соль1+кислота1соль2+кислота2 Ряд кислот: HNO3, H2SO4, HCl, H3PO4, H2SO3, H2CO3,H2S, H2SiO3 каждая
- 7. Закончить уравнения Na2SiO3+HCl …; Na2CO3+ H2SO4 …; CuS+ H2SO4(p)…
- 8. 2. Соль1+щелочь соль2+нерастворимое основание Mg(NO3)2+KOH …; Fe2(SO4)3+NaOH …
- 9. 3. соль1+металл1 соль2+металл2 CuSO4+Zn …; Hg(NO3)2+Cu … Каждый левостоящий металл вытесняет из соли правостоящий.
- 10. 4. Соль1+соль2 соль3+соль4 AgNO3+NaCl …; CuSO4+BaCl2 …
- 11. Получение солей Средние соли. Металл+неметалл: 2Fe+3Cl22FeCl3
- 12. 2. Металл+кислота соль +водород : Mg+2HCl MgCl2+H2
- 13. 3. Металл+соль Zn+CuSO4 Cu+ZnSO4
- 14. 4. Основной оксид+ кислотный оксид CaO+CO2 CaCO3
- 15. 5. Основной оксид+кислота CuO+H2SO4 CuSO4+H2O
- 16. 6. Основание+кислотный оксид Ba(OH)2+N2O5 Ba(NO3)2+2H2O
- 17. 7. Основание+кислота .Fe(OH)3+3HCl FeCl3+3H2O
- 18. 8. Щелочь+соль 2NaOH+Mg(NO3)2 2NaNO3+Mg(OH)2
- 19. 9. Соль+кислота CaCO3+2HCl CaCl2+CO2+H2O
- 20. 10. Соль1+соль2 Na2SO4+AgNO3 2NaNO3+Ag2SO4
- 21. При написании уравнений реакций следует помнить 1) Реакция возможна, если в результате реакции образуется а)осадок, б)
- 22. продолжение 2) Водород из кислот (кроме азотной и концентрированной серной) вытесняют только металлы, стоящте левее водорода
- 23. продолжение 3) Каждый левостоящий металл (в ряду напряжений) может вытеснять правостоящий из раствора его соли
- 24. Получение кислых солей Неполная нейтрализация кислоты основанием . В реакции участвует избыток кислоты и недостаток основания.
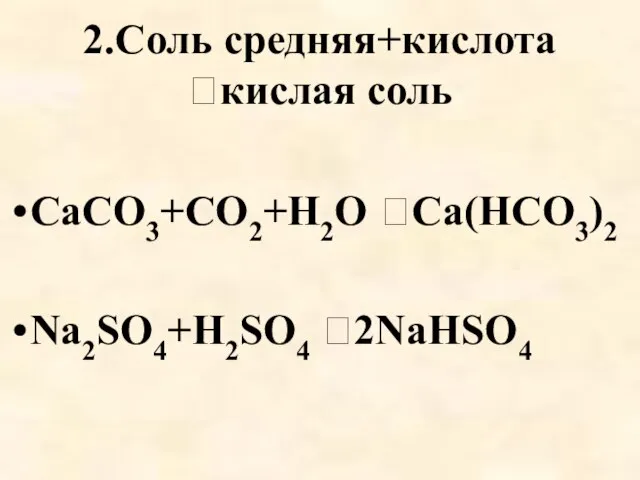
- 25. 2.Соль средняя+кислота кислая соль CaCO3+CO2+H2O Ca(HCO3)2 Na2SO4+H2SO4 2NaHSO4
- 26. Получение основных солей Неполная нейтрализация основания кислотой (избыток основания+недостаток кислоты основная соль). Fe(OH)3+HCl Fe(OH)2Cl Fe(OH)3+2HCl FeOHCl+2H2O
- 27. 2. Средняя соль1+щелочь основная соль+средняя соль2 FeCl2+KOH FeOHCl+KCl
- 28. 3. Средняя соль+одноименное основание основная соль CaSO4+Cа(OH)2 (CaOH)2SO4
- 29. Взаимосвязь средних, кислых, основных солей Кислая соль+основаниесредняя соль+вода NaHSO3+NaOHNa2SO4+H2O KH2PO4+2KOHK3PO4+2H2O
- 30. Основная соль+кислота средняя соль+вода CaOHNO3+HNO3Ca(NO3)2+H2O Cr(OH)2Cl+2HClCrCl3+2H2O
- 31. Осуществить цепочку превращений FeFeOFeSO4Fe(OH)2 Fe(OH)ClFeCl2 2Fe+O22FeO; 2) FeO+H2SO4FeSO4+H2O;
- 32. продолжение 3) FeSO4+2KOHFe(OH)2+K2SO4 4) Fe(OH)2+HClFeOHCl+H2O; 5) FeOHCl+HClFeCl2+H2O
- 34. Скачать презентацию






























 « Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес
« Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Получение водорода в промышленности и его применение Химия 8 класс
Получение водорода в промышленности и его применение Химия 8 класс  Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Способи та засоби припинення та запобігання процесів горіння. Припинення горіння методом охолодження. (Тема 15.24)
Способи та засоби припинення та запобігання процесів горіння. Припинення горіння методом охолодження. (Тема 15.24) Комплексные соединения
Комплексные соединения Органическая химия. История развития
Органическая химия. История развития Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов
Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов Химическая связь
Химическая связь Химия в разных науках
Химия в разных науках Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013
Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013 Электролиз. Правила электролиза
Электролиз. Правила электролиза ФОСФАТНІ ДОБРИВА
ФОСФАТНІ ДОБРИВА  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Подготовили: Сигова Ольга Хетчикова Екатерина
Подготовили: Сигова Ольга Хетчикова Екатерина Фізичні та хімічні явища. (7 клас)
Фізичні та хімічні явища. (7 клас) Таблица Менделеева внутри нас
Таблица Менделеева внутри нас Структура периодической системы элементов
Структура периодической системы элементов Железо в сплавах и природе. Состав железа
Железо в сплавах и природе. Состав железа Презентация по Химии "Молочная кислота" - скачать смотреть _
Презентация по Химии "Молочная кислота" - скачать смотреть _ Адсорбция
Адсорбция Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Термопластичные полимеры
Термопластичные полимеры Эрбий (лат. Erbium)
Эрбий (лат. Erbium) Презентация по Химии "Дисахариди" - скачать смотреть бесплатно
Презентация по Химии "Дисахариди" - скачать смотреть бесплатно