Содержание
- 2. Цілі уроку Продовжити знайомство з періодичною системою хімічних елементів Д.І.Менделєєва; Розкрити зміст порядкового номера елемента на
- 3. Хімічна фортуна
- 4. Найменша електронейтральна частинка хімічного елемента, яка несе усі властивості елемента. Атом
- 5. Розмір атомів Атом має дуже малі розміри 1 нм = 10-9м Наприклад, радиус атома заліза 0,13
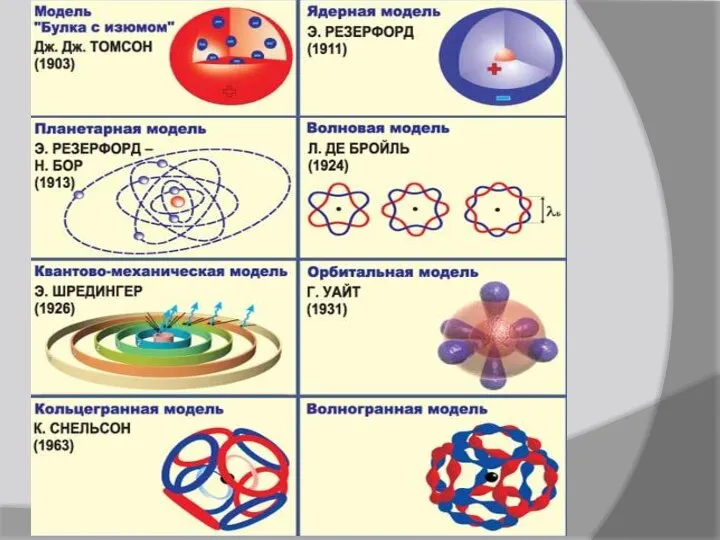
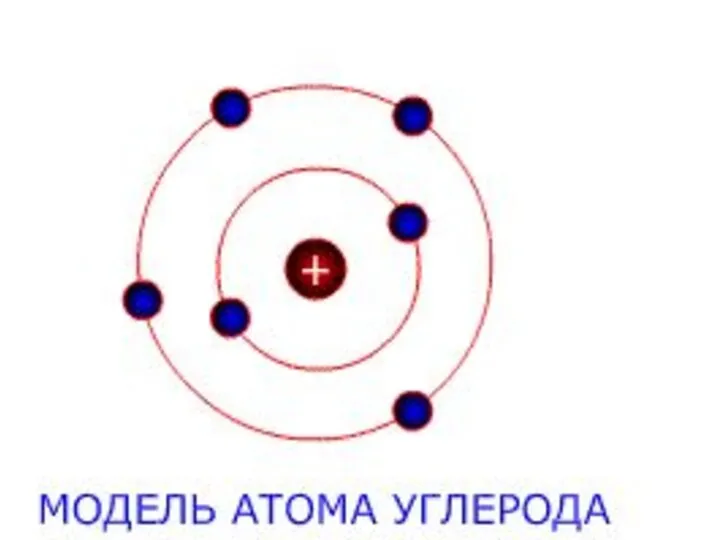
- 6. Історичні моделі будови атомів
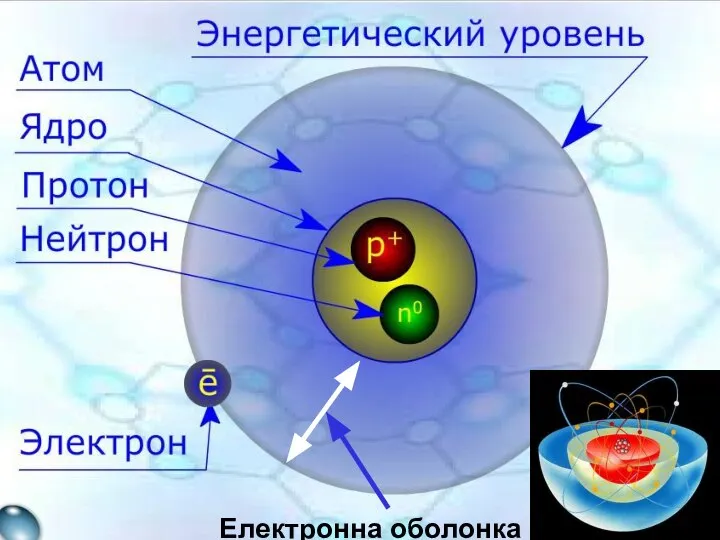
- 8. Електронна оболонка
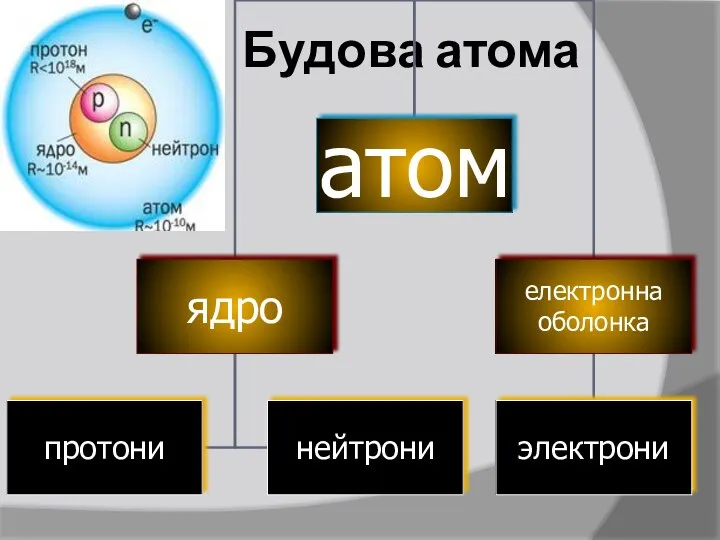
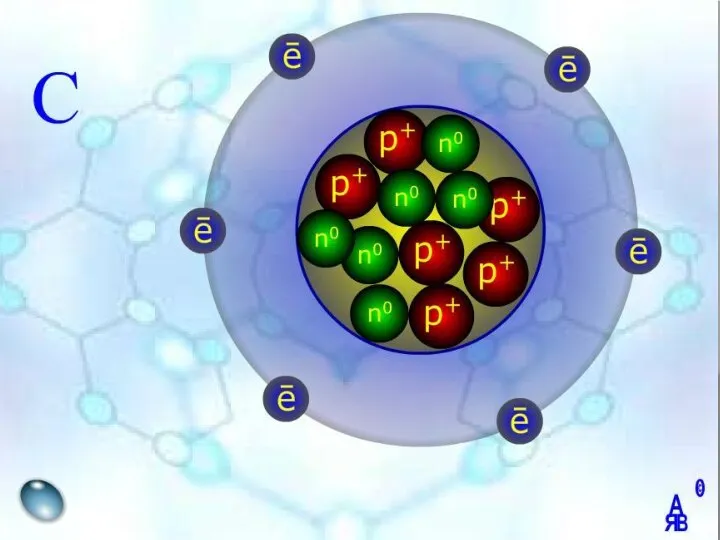
- 9. Будова атома
- 10. Нейтрон – нейтральна частинка, що не має електричного заряду Протон – позитивно заряджена частинка Електрон –
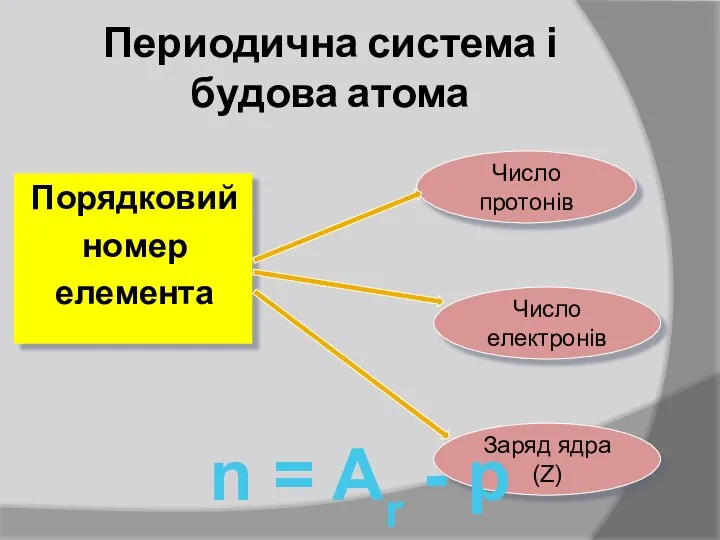
- 11. Периодична система і будова атома Порядковий номер елемента Число протонів Число електронів Заряд ядра (Z) n
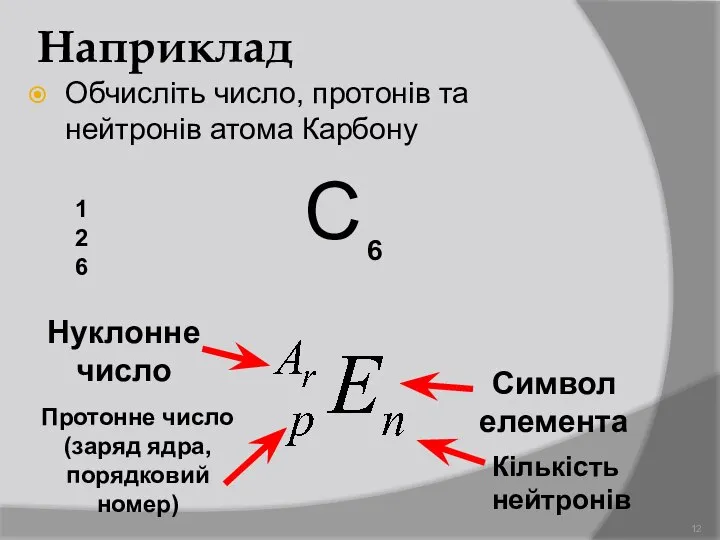
- 12. Наприклад Обчисліть число, протонів та нейтронів атома Карбону С 12 6 Символ елемента Протонне число (заряд
- 15. Основні терміни – загальна кількість протонів і нейтронів – загальне число протонів – загальне число протонів
- 16. Домашня робота Опрацювати параграф 22; Вик. пис. впр. № 1-4 ст.123 Демидова О.Л.
- 17. Радіоактивнівсть
- 18. Сторінками історії А.Беккерель у 1896 році виявив, що матеріали, які містять Уран, засвідчують у темряві фотопластинку,
- 19. П’єр і Марія Склодовська-Кюрі відкрили два нові радіоактивні елементи – Полоній і Радій. І у 1903
- 20. Радіоактивність Це здатність деяких елементів випромінювати. Радіоактивний розпад Процес розпадання ядер на менші ядра, окремі частинки
- 21. α-випромінення – випромінювання позитивно заряджених частинок (ядра Гелію) β-випромінення – це випромінювання негативно заряджених частинок (електронів)
- 22. Ураження випроміненням α-частинка β-частинка γ-частинка 2-3 см Захистить картон Кілька метрів Може захистити цегляна стіна Найбільша
- 23. Заповніть таблицю N Ca Al Al2 O3 CaO N2O5 Al(OH)3 HAlO3 Ca(OH)2 HNO3 7 13 20
- 24. Демидова О.Л.
- 25. Домашня робота Опрацювати параграф 23; Вик. пис. впр. № 5-7 ст.132 Демидова О.Л.
- 26. Дякую за урок До побачення Демидова О.Л.
- 27. Назвіть елемент VІ групи, відносна молекулярна маса сполуки з Гідрогеном якого дорівнює 81 Демидова О.Л.
- 28. Назвіть елемент V групи, відносна молекулярна маса оксиду якого дорівнює 142 Демидова О.Л.
- 29. Порівняйте металічні властивості елементів: Алюмінію та Галію, Кальцію та Барію. Демидова О.Л.
- 30. Порівняйте неметалічні властивості елементів: Оксигену та Карбону, Флуору та Бору. Демидова О.Л.
- 31. Як класифікують групи та періоди? Демидова О.Л.
- 32. Як змінюється валентність у періодичній системі хімічних елементів? Демидова О.Л.
- 33. Як змінюються неметалічні та металічні властивості елементів у періодах Демидова О.Л.
- 34. Розкажіть про структуру періодичної системи хімічних елементів Демидова О.Л.
- 35. Що називають групою? Демидова О.Л.
- 37. Скачать презентацию



























 Введение. Тренажер
Введение. Тренажер Актиноиды и их применение
Актиноиды и их применение Харчові добавки Підготувала Учениці 11 класу Маніло Ірина, Прищепчук Надія
Харчові добавки Підготувала Учениці 11 класу Маніло Ірина, Прищепчук Надія  Туф вулканический
Туф вулканический Презентация по Химии "Коррозия металлов" - скачать смотреть
Презентация по Химии "Коррозия металлов" - скачать смотреть  Металлы. Общая характеристика
Металлы. Общая характеристика Строение атома. Движение электрона в атоме
Строение атома. Движение электрона в атоме Презентация Сплавы металлов.
Презентация Сплавы металлов. Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Энергоресурсы и их использование
Энергоресурсы и их использование Электролиз воды
Электролиз воды Схема катаболизма углеродного скилета аминокислот
Схема катаболизма углеродного скилета аминокислот Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Правила поведения в кабинете химии
Правила поведения в кабинете химии Вольтамперометрия
Вольтамперометрия Николаева Наталия Николаевна учитель химии МОУ «ООШ № 1 имени Бабкина Г.О.» представляет открытый урок по химии с использованием
Николаева Наталия Николаевна учитель химии МОУ «ООШ № 1 имени Бабкина Г.О.» представляет открытый урок по химии с использованием  Аргентум, или серебро
Аргентум, или серебро Пропиновые кислоты
Пропиновые кислоты Алкени
Алкени Применение фенола
Применение фенола Знаки химических элементов
Знаки химических элементов Круговорот углерода в природе
Круговорот углерода в природе Теория электролитической диссоциации
Теория электролитической диссоциации Теория Кристаллического Поля
Теория Кристаллического Поля Горение жидкого топлива
Горение жидкого топлива Интересные факты в химии
Интересные факты в химии Гума
Гума Полисахариды. Крахмал. Целлюлоза
Полисахариды. Крахмал. Целлюлоза