Содержание
- 2. Атом и состав атома Атом это: наименьшая частица химического элемента Атом состоит из: Положительно заряженного ядра
- 3. Атом и состав атома 3. В ядре сосредоточена почти вся масса атома, так как масса электронов
- 4. Обозначения Суммарно число протонов – Z Суммарное число нейтронов – N Массовое число – А Итог:
- 5. Молекула Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая
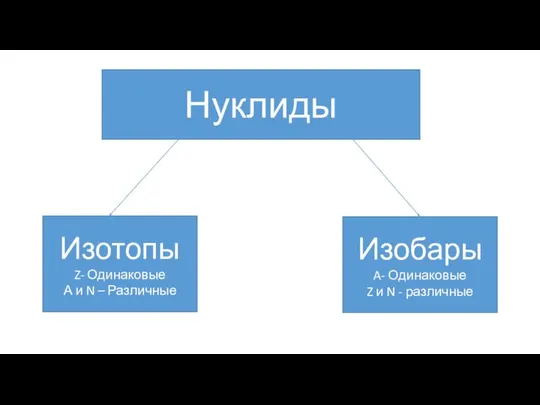
- 6. Нуклиды Это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа
- 7. Изотопы и изобары Изотопы – это атомы (нуклиды) одного и того же химического элемента, имеющие одинаковый
- 8. Нуклиды Изотопы Z- Одинаковые А и N – Различные Изобары A- Одинаковые Z и N -
- 9. Состояние электрона в атоме
- 10. Электрон Одновременно проявляет свойства частицы и волны (Корпускулярно-волновой дуализм) Как частица обладает определенной массой и зарядом
- 11. Движение электрона Электрон в атоме находится в постоянном движении вокруг ядра. Для описания состояния электрона оценивается
- 12. Электронное облако
- 13. Атомная орбиталь Пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона.
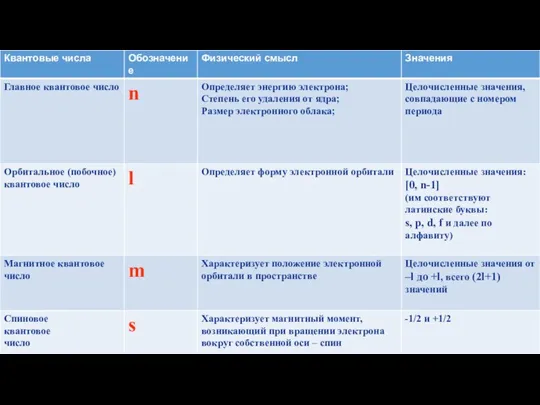
- 14. Квантовые числа Существуют: 1.Главное квантовое число (n) 2.Орбитальное квантовое число (l) 3.Магнитное квантовое число (ml) 4.Спиновое
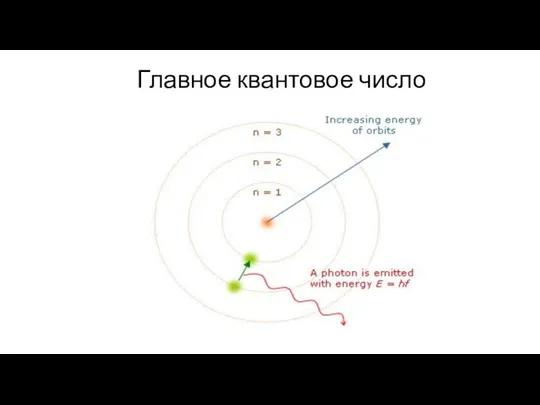
- 16. Главное квантовое число
- 17. Орбитальное квантовое число
- 18. Магнитное квантовое число
- 20. Скачать презентацию














 Презентация по Химии "Экологические проблемы химии гидросферы" - скачать смотреть
Презентация по Химии "Экологические проблемы химии гидросферы" - скачать смотреть  Альдегидтер және кетондар
Альдегидтер және кетондар Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Производные углеводородов
Производные углеводородов Основы теории энергетических зон кристаллов. Волны Блоха
Основы теории энергетических зон кристаллов. Волны Блоха Химические свойства металлов
Химические свойства металлов Состав и строение вещества. Молекулы
Состав и строение вещества. Молекулы Закономерности изменения свойств химических элементов в Периодической Системе Химических Элементов ( ПСХЭ)
Закономерности изменения свойств химических элементов в Периодической Системе Химических Элементов ( ПСХЭ) Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки Building blocks. Atoms. Elements. Structure of the atom
Building blocks. Atoms. Elements. Structure of the atom Классификация топлива, масел и спецжидкостей
Классификация топлива, масел и спецжидкостей Сухой спирт
Сухой спирт Такой разный песок
Такой разный песок Гноеродные (пиогенные) кокки
Гноеродные (пиогенные) кокки Химия - моя жизнь
Химия - моя жизнь Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Классификация, виды бензинов и их свойства
Классификация, виды бензинов и их свойства Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Поліметилметакрилат
Поліметилметакрилат Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Начала физической химии
Начала физической химии Изменение агрегатных состояний вещества_
Изменение агрегатных состояний вещества_ Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7
Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 Химический состав клеток. Углеводы. Липиды
Химический состав клеток. Углеводы. Липиды Оксокислоти. Номенклатура
Оксокислоти. Номенклатура Окислительно-востановительные реакции в растворах
Окислительно-востановительные реакции в растворах Способы разделения смесей
Способы разделения смесей Агрегатные состояния вещества
Агрегатные состояния вещества