Содержание
- 2. Цель урока: углубить знания по теме «Растворы», обеспечить формирование понятий «Диффузия» и «Осмос» на основе синтеза
- 3. Между молекулами растворенного вещества большое расстояние и почти отсутствуют силы притяжения. Т.е. поведение молекул в разбавленном
- 4. Диффузия Диффузия – процесс самопроизвольного выравнивания концентраций веществ в растворе.
- 5. Диффузия всегда идет из области с большей концентрации в сторону меньшей. При этом энтропия (мера беспорядка)
- 6. Диффузия играет важную роль в жизнедеятельности организмов, в природных и технологических процессах. Примеры:1) перемещение питательных веществ
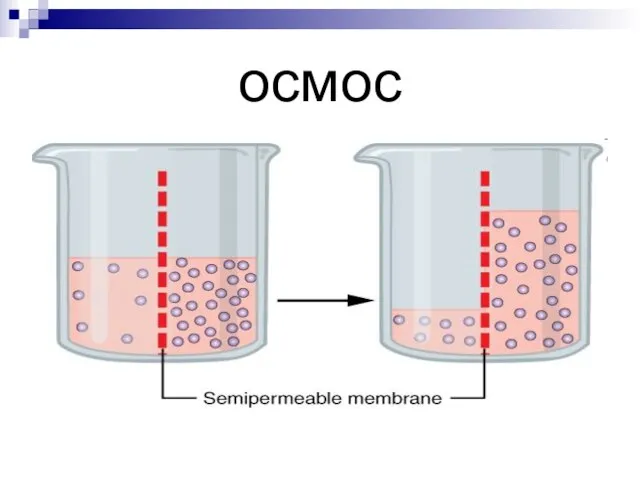
- 8. осмос
- 9. Осмос – явления перехода растворителя через полупроницаемую мембрану из области с меньшей концентрацией в область с
- 11. Значение осмоса Велика роль осмоса в жизни растений, животных, в медицине и технологии. Это и процесс
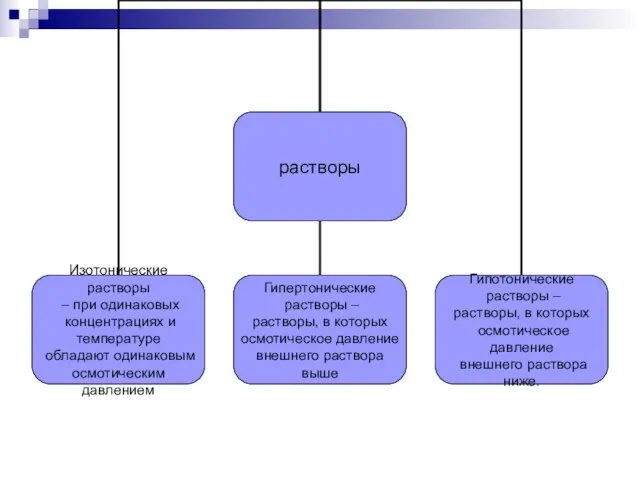
- 12. Закон Вант - Гоффа Сила, обуславливающая осмос, - осмотическое давление. Она равна тому внешнему давлению, которое
- 13. Закон Вант - Гоффа pV=nRT ↔ Росм = n/V*RT Т.к. n/V=См ↔ Росм= СмRT Осмотическое давление
- 15. Давление пара растворов.1 закон Рауля Давление пара растворов.1 закон Рауля Давление насыщенного пара жидкости зависит от
- 16. Первый закон Рауля l-й закон Рауля: понижение давления пара растворителя над раствором при постоянной температуре пропорционально
- 17. Второй закон Рауля Из физики вы знаете, что жидкость закипает при такой температуре, при котором давление
- 18. Второй закон Рауля Замерзает же жидкость при той температуре, при которой давление пара вещества в твердом
- 19. Второй закон Рауля 2-й закон Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально
- 21. Скачать презентацию
















 Презентация по Химии "Презентація про мене" - скачать смотреть
Презентация по Химии "Презентація про мене" - скачать смотреть  Фосфор
Фосфор Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті ОГЭ, вопрос 16 1-4
ОГЭ, вопрос 16 1-4 Начальные этапы обмена липидов
Начальные этапы обмена липидов Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл
Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно
Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно Щавелевая кислота
Щавелевая кислота Хімічний елемент Літій
Хімічний елемент Літій Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Предельные одноатомные спирты
Предельные одноатомные спирты Серебра нитрат и другие препараты серебра. Ртути окись желтая
Серебра нитрат и другие препараты серебра. Ртути окись желтая Посвящение в химики!
Посвящение в химики! Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4)
Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4) Узинская ООШ исслед.работа Лобановой Елизаветы
Узинская ООШ исслед.работа Лобановой Елизаветы ТБ в школе и в быту
ТБ в школе и в быту Твердые тела и их свойства
Твердые тела и их свойства  Геология и геохимия нефти и газа
Геология и геохимия нефти и газа Азотсодержащие органические соединения
Азотсодержащие органические соединения Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 Юные химики
Юные химики Курсовая работа. Влияние микроэлементов на физиологические процессы
Курсовая работа. Влияние микроэлементов на физиологические процессы Материаловедение. Текстильные волокна, пряжа и ткань
Материаловедение. Текстильные волокна, пряжа и ткань Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Презентация по Химии "Углерод" - скачать смотреть
Презентация по Химии "Углерод" - скачать смотреть  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Платина. Свойства
Платина. Свойства