Содержание
- 2. Происхождение названия Название платине было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в
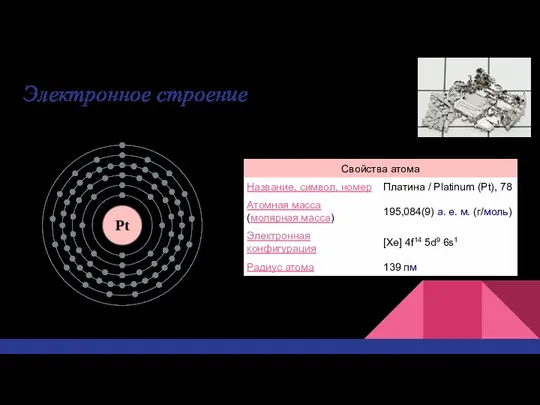
- 3. Электронное строение
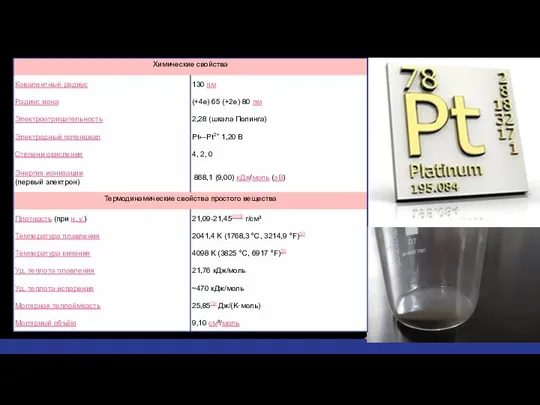
- 4. Физические свойства серовато-белый пластичный ковкий металл t плавления = 1768, 3 °C t кипения = 3825
- 6. Химические свойства Платина является одним из самых инертных металлов. По химическим свойствам платина похожа на палладий,
- 7. Химические свойства При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины:
- 8. Использование С первой четверти XIX века применялась в России в качестве легирующей добавки для производства высокопрочных
- 9. Использование Незначительная часть платины идет в медицинскую промышленность. Платина, золото и серебро — основные металлы, выполняющие
- 10. Использование Платина и её сплавы широко используются для производства ювелирных изделий. Большинство ювелирных изделий из платины
- 11. Применение в химии Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном
- 12. Источники информации Неорганическая химия. Я. А. Угай Материал из Википедии – Платина. Общая и неорганическая химия.
- 14. Скачать презентацию









 Производство азотной кислоты
Производство азотной кислоты Вуглеводи, як компонент їжі. Їхня роль в організмі людини
Вуглеводи, як компонент їжі. Їхня роль в організмі людини Строение электронных оболочек атомов
Строение электронных оболочек атомов Научные основы процессов разделения
Научные основы процессов разделения Презентация по Химии "Пластмаси" - скачать смотреть бесплатно
Презентация по Химии "Пластмаси" - скачать смотреть бесплатно Ionization Energy
Ionization Energy Белковая инженерия ферментов. (Лекция 10)
Белковая инженерия ферментов. (Лекция 10) Химический элемент медь. (11 класс)
Химический элемент медь. (11 класс) Кристаллы и их свойства. Понятие о симметрии кристаллов и элементах симметрии. Сингония
Кристаллы и их свойства. Понятие о симметрии кристаллов и элементах симметрии. Сингония Моль. Молярная масса
Моль. Молярная масса Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас
Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас Карбоновые кислоты. Лекция 7
Карбоновые кислоты. Лекция 7 Проект соль
Проект соль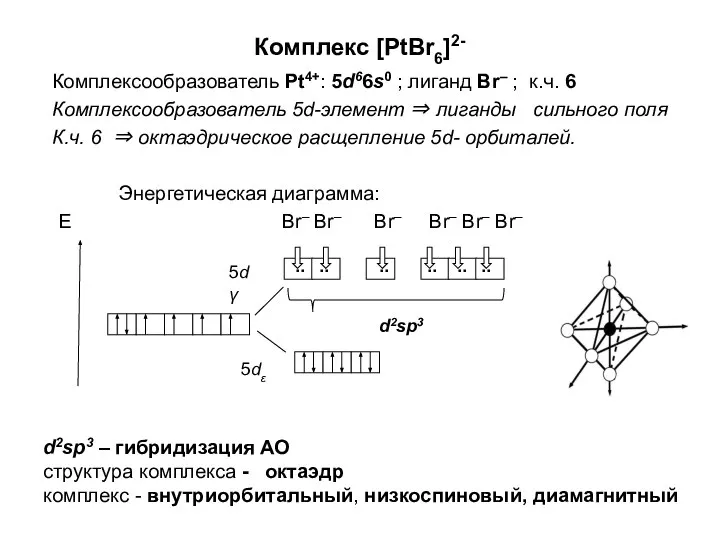 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Знакомимся с химическим языком!
Знакомимся с химическим языком! Реакции ионного обмена
Реакции ионного обмена Химические элементы
Химические элементы Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Строение вещества. Молекулы
Строение вещества. Молекулы Органические вещества клетки. Белки
Органические вещества клетки. Белки Гниение аминокислот в кишечнике
Гниение аминокислот в кишечнике Химия в рисунках или эта удивительная химия Материал подготовила учитель высшей категории МОУ «Травниковская СОШ» Тутукова Е.Л
Химия в рисунках или эта удивительная химия Материал подготовила учитель высшей категории МОУ «Травниковская СОШ» Тутукова Е.Л Дикарбоновые кислоты
Дикарбоновые кислоты Министерство образования и науки Республики Бурятия Бичурская средняя общеобразовательная школа №3 Определение аскорбиновой к
Министерство образования и науки Республики Бурятия Бичурская средняя общеобразовательная школа №3 Определение аскорбиновой к Металлокомплексный катализ. (Лекция 16)
Металлокомплексный катализ. (Лекция 16) Разработка и внедрение метода измерений массовых концентраций сульфид-ионов в водах методом ионной хроматографии
Разработка и внедрение метода измерений массовых концентраций сульфид-ионов в водах методом ионной хроматографии Ш. Мәрҗани исемендәге Комыргуҗа урта мәктәбе Физика укытучысы Шәрәфетдинова Р.З. 2012 ел
Ш. Мәрҗани исемендәге Комыргуҗа урта мәктәбе Физика укытучысы Шәрәфетдинова Р.З. 2012 ел Слайд-шоу
Слайд-шоу