Содержание
- 2. Дикарбоновые кислоты – производные углеводородов, у которых два атома водорода замещены на гидроксильную группу (-СООН). Общая
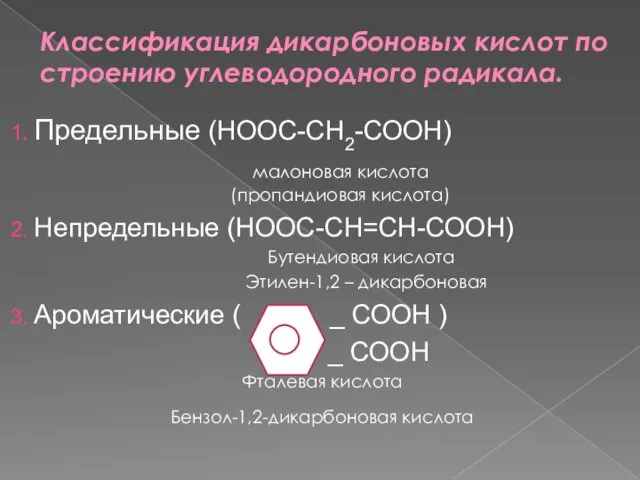
- 3. Классификация дикарбоновых кислот по строению углеводородного радикала. 1. Предельные (НООС-СН2-СООН) малоновая кислота (пропандиовая кислота) 2. Непредельные
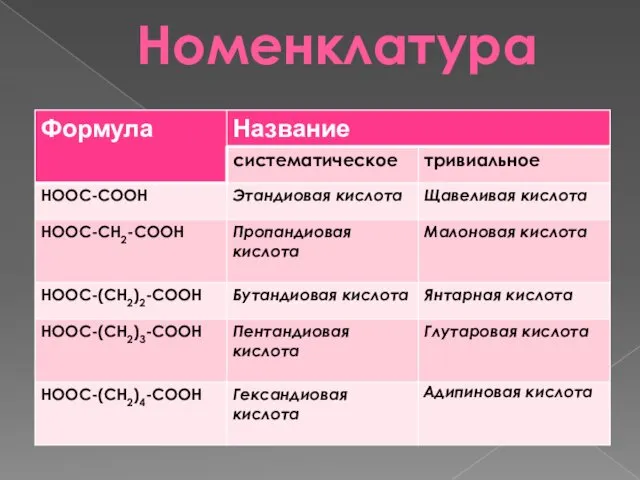
- 4. Номенклатура
- 5. Физические свойства Дикарбоновые кислоты – кристаллические вещества с высокой температурой плавления. Низшие – очень хорошо растворимы
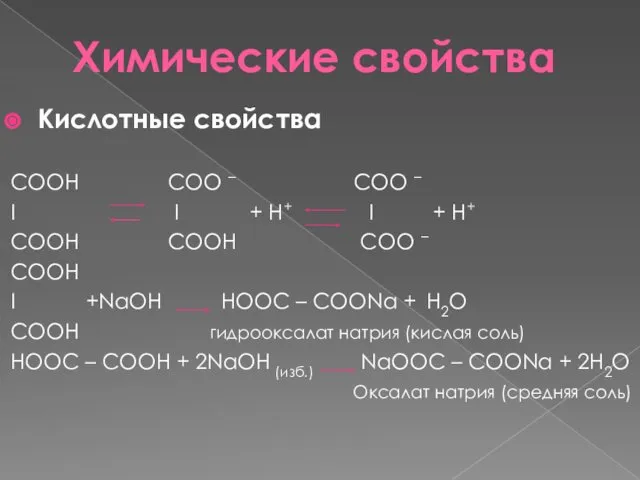
- 6. Химические свойства Кислотные свойства СООН COO – COO – I I + H+ I + H+
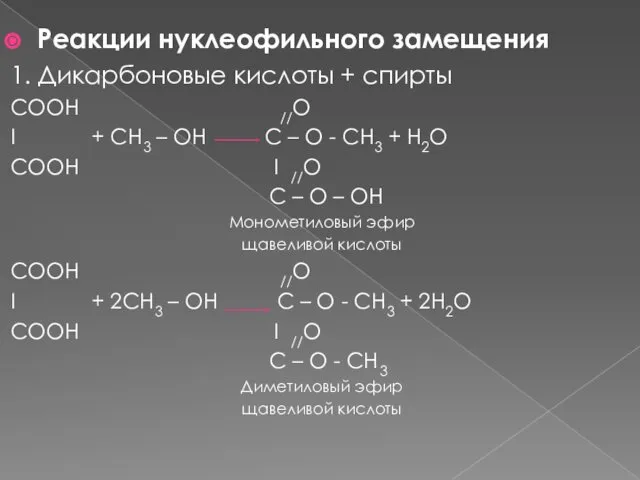
- 7. Реакции нуклеофильного замещения 1. Дикарбоновые кислоты + спирты СООН //O I + CH3 – OH C
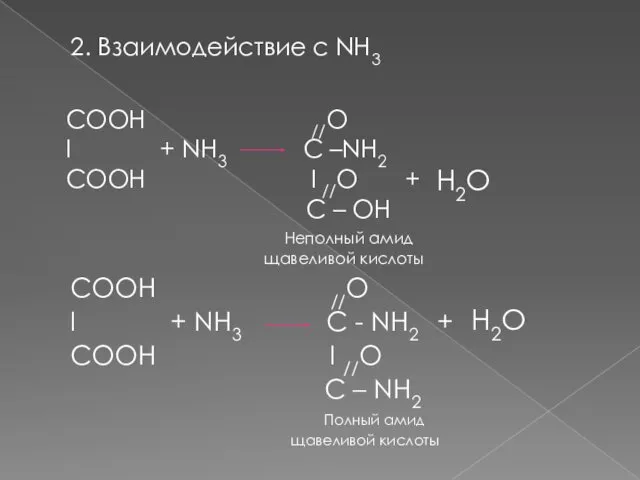
- 8. 2. Взаимодействие с NH3 СООH //O I + NH3 C - NH2 + СООH I //O
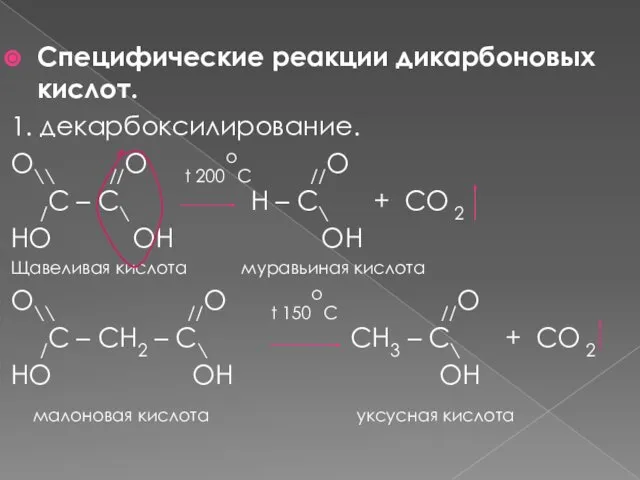
- 9. Специфические реакции дикарбоновых кислот. 1. декарбоксилирование. O\\ //O t 200oC //O /C – C\ H –
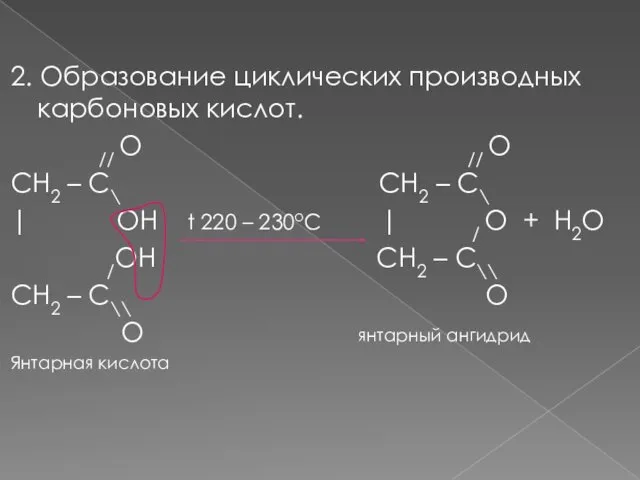
- 10. 2. Образование циклических производных карбоновых кислот. // O // O CH2 – C\ CH2 – C\
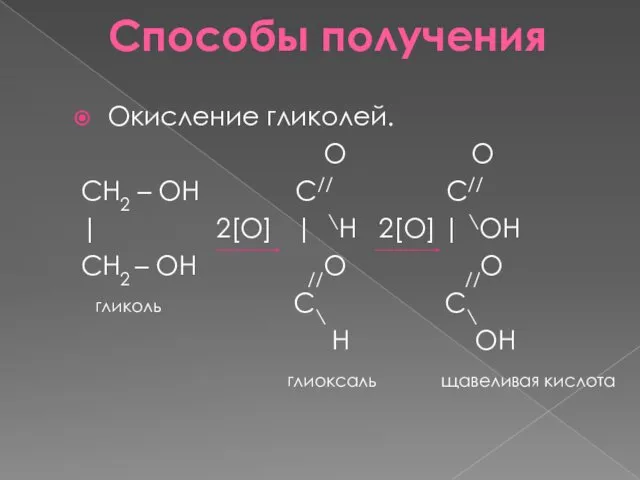
- 11. Способы получения Окисление гликолей. O O CH2 – OH C// C// | 2[O] | \H 2[O]
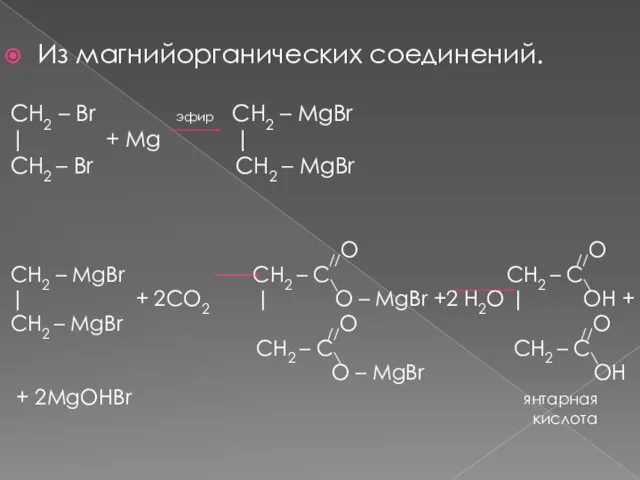
- 12. Из магнийорганических соединений. CH2 – Br эфир CH2 – MgBr | + Mg | CH2 –
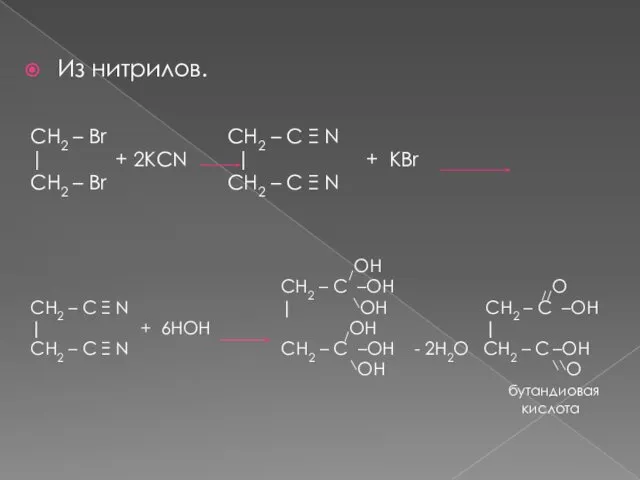
- 13. Из нитрилов. CH2 – Br CH2 – C Ξ N | + 2KCN | + KBr
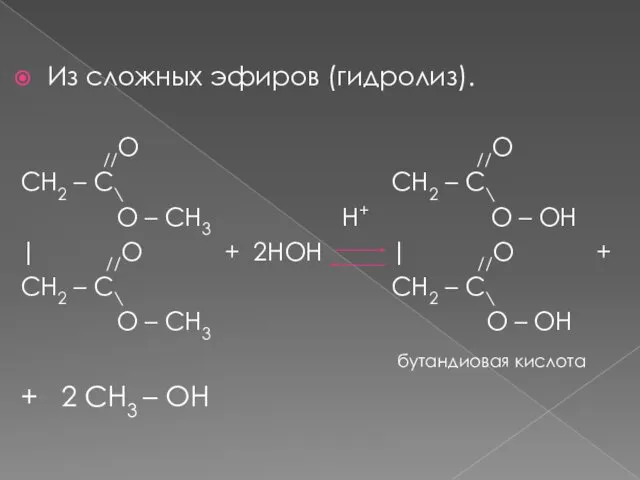
- 14. Из сложных эфиров (гидролиз). //O //O CH2 – C\ CH2 – C\ O – CH3 H+
- 15. Щавелевая кислота НООС – СООН Применение Щавелевую кислоту (этандиоевая) широко применяют: • в текстильной и кожевенной
- 16. Щавеливая кислота в виде кальцевых солей (оксалатов) содержится в листьях щавеля, кислицы, ревеня. Получение в промышленности:
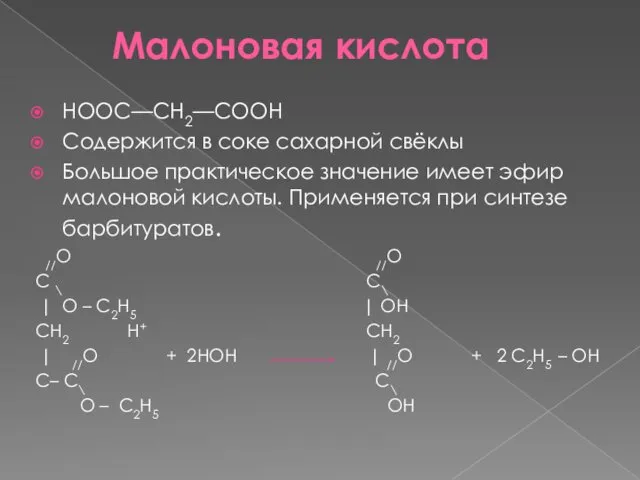
- 17. Малоновая кислота НООС—СН2—СООН Содержится в соке сахарной свёклы Большое практическое значение имеет эфир малоновой кислоты. Применяется
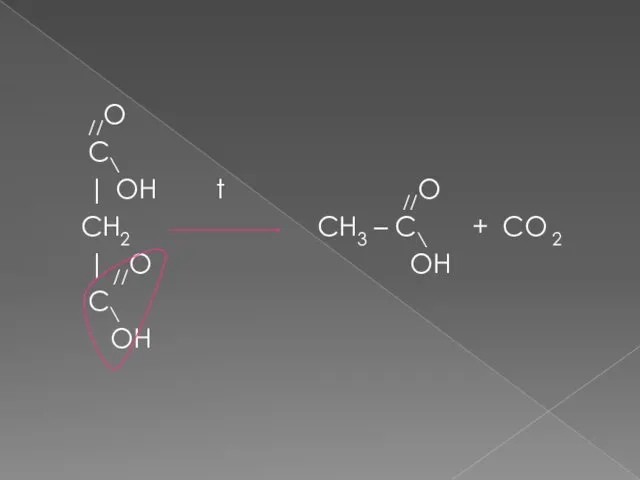
- 18. //O C\ | OH t //O CH2 CH3 – C\ + CO 2 | //O OH
- 20. Скачать презентацию




 Галогены
Галогены Горение и медленное окисление. Тепловой эффект химической реакции
Горение и медленное окисление. Тепловой эффект химической реакции Периодический закон Д.И. Менделеева. Химическая связь и ее типы
Периодический закон Д.И. Менделеева. Химическая связь и ее типы Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Хром және оның қосылыстары
Хром және оның қосылыстары Галогены. Галогеноводороды
Галогены. Галогеноводороды Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Презентация на тему: Кремний и его соединения
Презентация на тему: Кремний и его соединения Метод комплексонометрического титрования (лекция 8)
Метод комплексонометрического титрования (лекция 8) Корунд. Разновидности корунда
Корунд. Разновидности корунда Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Презентация по Химии "«Увлекательные факты из жизни Менделеева»" - скачать смотреть
Презентация по Химии "«Увлекательные факты из жизни Менделеева»" - скачать смотреть  Сульфаты и оксиды металлов
Сульфаты и оксиды металлов Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Материалы для газовой сварки
Материалы для газовой сварки Альдегиды. Кетоны
Альдегиды. Кетоны Умные материалы
Умные материалы Общая характеристика углерода
Общая характеристика углерода Строение газообразных, жидких и твёрдых тел
Строение газообразных, жидких и твёрдых тел Жири як компоненти їжі
Жири як компоненти їжі  Закись азота – наркотик!
Закись азота – наркотик! Адам мен жануар организміне бордың әсері
Адам мен жануар организміне бордың әсері Пральні порошки. Мила
Пральні порошки. Мила  Обобщение и систематизация знаний по теме Химические реакции
Обобщение и систематизация знаний по теме Химические реакции Презентация по Химии "Вода. Знакомая незнакомка" - скачать смотреть
Презентация по Химии "Вода. Знакомая незнакомка" - скачать смотреть  Фосфор
Фосфор Тепловой баланс котла
Тепловой баланс котла Химический источник электрического тока
Химический источник электрического тока