Содержание
- 2. Проверь свои знания: Кислород нельзя получить в результате реакции разложения: 1) воды; 2) бертолетовой соли; 3)
- 3. 4.Кислород при обычных условиях: 1) твердое вещество, голубоватого цвета, без вкуса, без запаха; 2) кислород при
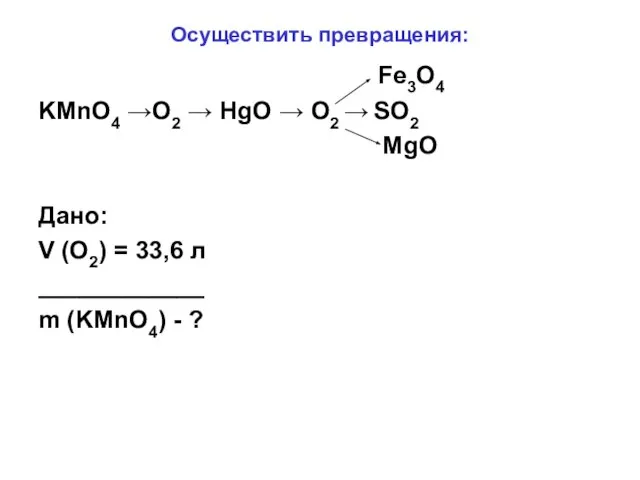
- 4. Осуществить превращения: Fe3O4 KMnO4 →O2 → HgO → O2 → SO2 MgO Дано: V (O2) =
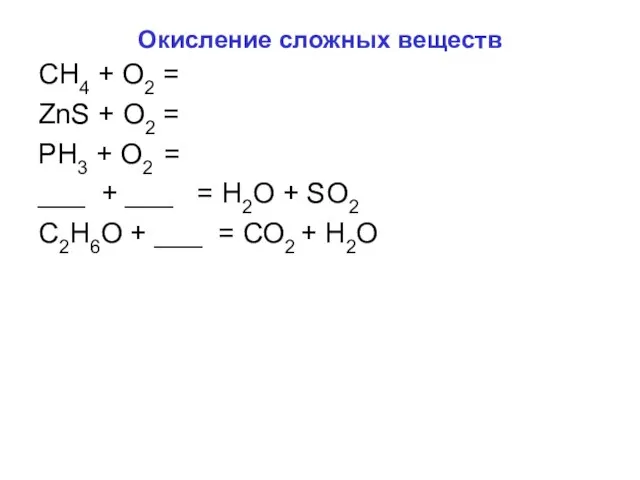
- 5. Окисление сложных веществ СН4 + О2 = ZnS + O2 = PH3 + O2 = ___
- 6. Реакции Экзотермические Эндотермические Реакции, протекающие с Реакции, протекающие с выделением энергии поглощением энергии С + О2
- 7. Приведите пример эндотермической реакции получения кислорода и вычислите сколько грамм этого вещества потребуется для получения 5,6л
- 9. Скачать презентацию




 Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1)
Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1) Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Физико-химические методы исследования (анализа) строения и реакционной способности органических соединений
Физико-химические методы исследования (анализа) строения и реакционной способности органических соединений Лекарственное растительное сырье, содержащее производные простых фенолов
Лекарственное растительное сырье, содержащее производные простых фенолов Мультимедийные иллюстрации по лекционному курсу «Биологическая химия»
Мультимедийные иллюстрации по лекционному курсу «Биологическая химия» Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Таблица взаимодействия с металлами
Таблица взаимодействия с металлами Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Изомерия алкенов
Изомерия алкенов Ковалентная связь
Ковалентная связь Методы измерения серы в нефтепродуктах
Методы измерения серы в нефтепродуктах Химические источники тока. Электролиз
Химические источники тока. Электролиз Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Степень окисления. Урок № 63
Степень окисления. Урок № 63 Белки - 4. Обмен сложных белков. Нуклеопротеиды
Белки - 4. Обмен сложных белков. Нуклеопротеиды Ксантановая камедь
Ксантановая камедь Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Спирты. Применение в производстве пищевых продуктов
Спирты. Применение в производстве пищевых продуктов Водень та його застосування в енергетиці
Водень та його застосування в енергетиці  Физические свойства воды
Физические свойства воды Углеводороды. Свойства алканов
Углеводороды. Свойства алканов Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Хімія і екологія
Хімія і екологія  Гидролиз. Лекция 03-2
Гидролиз. Лекция 03-2 Природный и попутный газы, их состав и использование
Природный и попутный газы, их состав и использование Ионообменная хроматография
Ионообменная хроматография