Содержание
- 2. Избыточная свободная поверхностная энергия G Разрежем кристалл плоскостью на две части и начнем их раздвигать Появились
- 3. Приповерхностная зона может перестраиваться. Перестройка захватывает несколько слоев, осуществляется сравнительно быстро в жидкостях и медленно –
- 4. Изменения структуры твердой фазы, реконструкция и релаксация Реконструкция Поверх-ность раздела Избыточная поверхностная энергия ΔF = σ
- 5. Адсорбция изменяет ситуацию на поверхности и также сопровождается различными типами ее перестройки, наиболее радикальна при химической
- 6. Поэтому приповерхностная часть адсорбента и окружающая среда находятся в динами-ческом равновесии, изменение внешних условий сопровождается деформациями
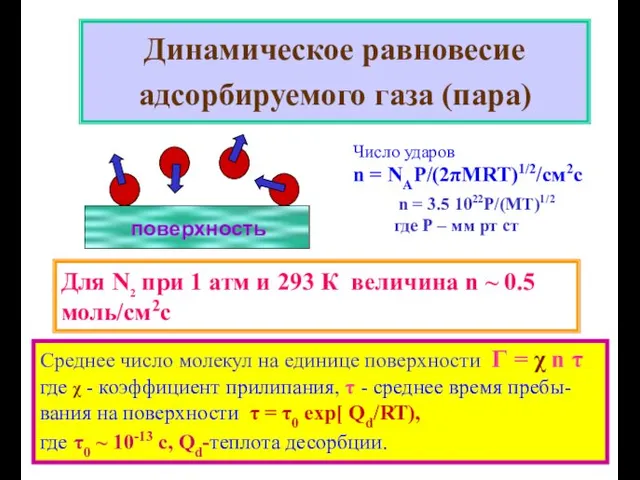
- 7. Динамическое равновесие адсорбируемого газа (пара) Среднее число молекул на единице поверхности Г = χ n τ
- 8. Динамическое равновесие адсорбируемого газа (пара) τ = τ0 exp[ Qd/RT) Ar, N2. O2 от пикосекунд (10-12)
- 9. Динамическое равновесие адсорбируемого газа (пара)
- 10. Изопотенциальные кривые физадсорбции He на поверхности кристалла Хе
- 11. Схема изменения адсорбционного потенциала U на поверхности Н
- 12. Заполнение неоднородной поверхности Степень заполнения поверхности при монослойной адсорбции θ = Ni/Nmax = Гi / Гmax,
- 13. Средняя площадка, приходящаяся на одну молекулу в заполненном монослое ω Гмах (μМоль/м2) = (Nmax/NA)/A Обозначим площадку
- 14. Область малых заполнений - изотерма адсорбции Генри n = NAP/(2πMRT)1/2/см2с при Т= Const уравнение изотермы: Г
- 15. Изотерма адсорбции Ленгмюра Это уравнение предложил в 1918 г Ирвинг Ленгмюр (1881-1957)- нобелевский лауреат 1932 г.
- 16. Изотерма адсорбции Ленгмюра Вид на поверхность сверху Поверхность хозяина, H Молекулы гостя G На поверхности занято
- 17. Изотерма адсорбции Ленгмюра Однородность поверхности (все адсорбционные центры эквивалентны) Адсорбция локализованная, т.е. частицы адсорбируются в определенных
- 18. Простейший квазихимический вывод: G + [Z] ⇔ [GZ] РG (1 - θ) θ [Z] – активный
- 19. Изотерма адсорбции Ленгмюра Из К = θ/Р(1- θ) следует θ = КР/(1 + К Р) =
- 20. Изотерма адсорбции Ленгмюра
- 21. Изотерма адсорбции Ленгмюра а = а0 К Р/(1 + К Р) Линеализируется в координатах Р/а =
- 22. А + [Z] ⇔ [AZ] константа скорости РА (1- θΣ) θА KA= θА/ РА(1- θΣ); B
- 23. Изотерма адсорбции Ленгмюра для смеси газов, адсорбирующихся на общих центрах из θi = KiРi(1- θΣ) и
- 24. При равновесии по схеме А2 + 2 [Z] ⇔2[AZ] адсорбция А2 в виде 2А требует наличия
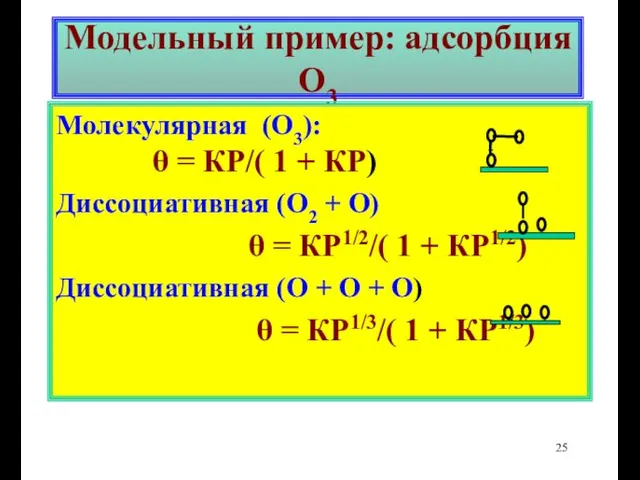
- 25. Модельный пример: адсорбция О3 Молекулярная (О3): θ = КР/( 1 + КР) Диссоциативная (О2 + О)
- 26. Условия равновесия двух фаз разделенных плоской поверхностью (1) Дифференциал энергии Гельмгольца (2) Интегрируя дифференциал при постоянных
- 27. Дифференцируя (3) и подставляя в (2) получаем уравнение Гиббса – Дюгема для объемной фазы (4) Редуцированное
- 28. Повторяя вышеприведенные выкладки для поверхности получаем уравнение Гиббса – Дюгема для поверхностной фазы (6) где A
- 29. Для однокомпонентной адсорбции уравнение изотермы принимает следующий вид (8) Используя условия равновесия (1) между поверхностью и
- 30. Для однородной поверхности в области предельно малого заполнения уравнение состояния поверхности тождественно уравнению состояния идеального газа
- 31. Область малых заполнений - изотерма адсорбции Генри (кинетический подход) n = NAP/(2πMRT)1/2/см2с при Т= Const уравнение
- 32. Уравнение состояния поверхностного газа с учетом размера частиц для делокализованной адсорбции (13) Повторяя выкладки предыдущих слайдов
- 33. Если в качестве уравнения состояния поверхностного газа взять уравнение Ван-дер-Ваальса (15) то получаем уравнение Хилла-де-Бура (16)
- 34. Если вместо делокализованной адсорбции рассмотреть локализованную то из уравнения Хилла-де-Бура мы получим уравнение Фаулера - Гугенхейма
- 35. Изотермы основанные на приближении Гиббса Изотерма Фаулера- Гугенхейма
- 36. Изотермы основанные на приближении Гиббса Изотерма Хилла – де Бура
- 37. Изотермы основанные на приближении Гиббса
- 38. Метод БЭТ Stephen Brunauer, Pаule H. Emmett Edward Teller J. Amer. Chem. Soc. 60, 2309, 1938.
- 39. Уравнение БЭТ (Брунауэр-Эмметт-Теллер) монослой Ленгмюра полимолекулярная адсорбция по БЭТ Модель БЭТ рассматривает адсорбцию на однородной поверхности
- 40. а = аmC h/{[1 - h] [1 + (C - 1)h]} где h = P/P0 Уравнение
- 41. Уравнение БЭТ Константы – емкость монослоя am и С определяются из линейной формы уравнения
- 42. Величину am (мМоль/г) используют для расчета удельной поверхности А А = аm NA ω где NA
- 43. Для расчета ω Брунауэр и Эмметт предложили уравнение ωсф = 1.091(М/NAρ) 2/3 которое получено при допущении
- 44. Метод БЭТ Стандартные измерения – N2, 77 K, ωN2 = 0.162 нм2 Но применение метода БЭТ
- 45. Метод БЭТ
- 46. Классическим также является уравнение Фрейндлиха для средней области заполнений θA= КPA1/n где n >1, причем значения
- 48. Скачать презентацию















![Простейший квазихимический вывод: G + [Z] ⇔ [GZ] РG (1 -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453446/slide-17.jpg)



![А + [Z] ⇔ [AZ] константа скорости РА (1- θΣ) θА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453446/slide-21.jpg)

![При равновесии по схеме А2 + 2 [Z] ⇔2[AZ] адсорбция А2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453446/slide-23.jpg)














![а = аmC h/{[1 - h] [1 + (C - 1)h]}](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453446/slide-39.jpg)






 Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Родючість ґрунтів , можливості її регулювання. Учень 9-Г класу Юрчак Владислав Керівник Садовська Т.Я.
Родючість ґрунтів , можливості її регулювання. Учень 9-Г класу Юрчак Владислав Керівник Садовська Т.Я. Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А. Хлороводород. Соляная кислота. Хлориды
Хлороводород. Соляная кислота. Хлориды СПИРТЫ Урок химии в 9-10 классе
СПИРТЫ Урок химии в 9-10 классе Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Влияние pH на микроорганизмы
Влияние pH на микроорганизмы Пирогова Т.В.учитель химии МОУ «Куженерская средняя общеобразовательная школа № 2»
Пирогова Т.В.учитель химии МОУ «Куженерская средняя общеобразовательная школа № 2»  Органические вещества
Органические вещества Мир химии.
Мир химии. Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae
Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae Презентация Изомерия
Презентация Изомерия  Ионные кристаллы
Ионные кристаллы  Алкены. Пропилен
Алкены. Пропилен Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона Ֆլավանոիդներ պարունակող դեղաբույսեր եվ հումք
Ֆլավանոիդներ պարունակող դեղաբույսեր եվ հումք Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Свойства идеального газа на примере воздуха
Свойства идеального газа на примере воздуха Методы решения ОВР с участием органических соединений
Методы решения ОВР с участием органических соединений Состояние электронов в атомах
Состояние электронов в атомах Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Оксид серы(IV). Сернистая кислота. Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Г
Оксид серы(IV). Сернистая кислота. Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Г Проект познавательно-исследовательской деятельности. Удивительная соль
Проект познавательно-исследовательской деятельности. Удивительная соль Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители
Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители Идеальный и реальный газ
Идеальный и реальный газ Природні джерела вуглеводнів Підготувала: Савчук Ірина
Природні джерела вуглеводнів Підготувала: Савчук Ірина  6 КАЗ Изохинолин туынд
6 КАЗ Изохинолин туынд