Содержание
- 2. Внимание, вопрос: 1.Простое или сложное строение имеет атом? Чем это можно подтвердить? 2.Из каких частей состоит
- 3. Внимание, вопрос: 6. Правильно ли записано распределение электронов по энергетическим уровням у указанных элементов? Почему? Мg
- 4. Подумайте! Почему на энергетических уровнях, содержащих довольно большое число электронов, электроны не сталкиваются между собой?
- 5. Движение электрона вокруг ядра в атоме водорода
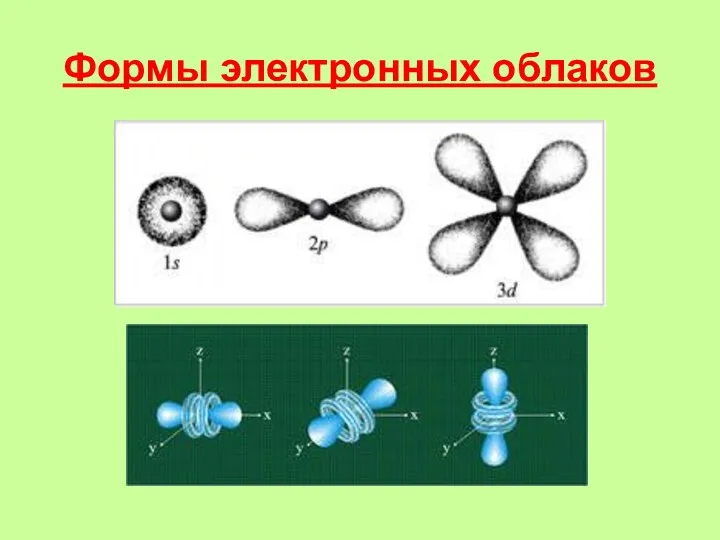
- 6. Формы электронных облаков
- 8. Схематическое изображение электронных орбиталей
- 9. Заполненная электронами s- орбиталь
- 10. Максимальное количество электронов на различных подуровнях На р – подуровне может находиться максимум 6 электронов; На
- 11. Деление энергетических уровней на подуровни
- 12. Прочтите и укажите, что это означает. 3р5; 4s1; 3d7; 5f12
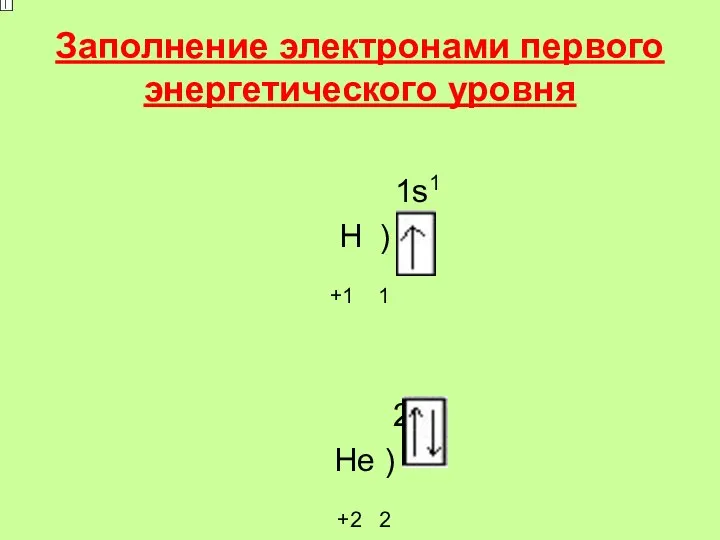
- 13. Заполнение электронами первого энергетического уровня 1s1 Н ) +1 1 2s2 He ) +2 2
- 14. Заполнение электронами s- подуровня второго энергетического уровня 1s2 2s1 Li ) ) + 3 2 1
- 15. Заполнение электронами р - подуровня второго энергетического уровня 1s2 2s2 2p1 B ) ) +5 2
- 16. Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1 Na ) ) ) +11 2 8 1
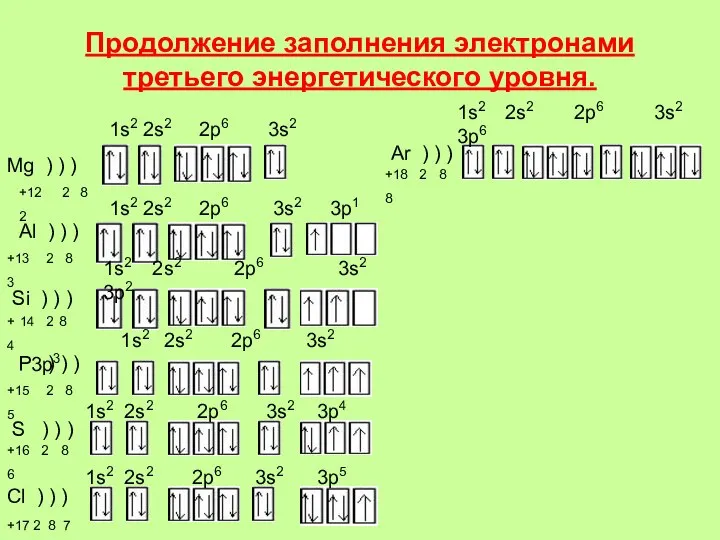
- 17. Продолжение заполнения электронами третьего энергетического уровня. Mg ) ) ) +12 2 8 2 Al )
- 18. Электронная конфигурация атомов калия и кальция К ) ) ) ) +19 2 8 8 1
- 19. Заполнение d- подуровня 3-го энергетического уровня. Sc ) ) ) ) +21 2 8 9 2
- 20. Заполнение р - подуровня 4-го энергетического уровня Ga ) ) ) ) +31 2 8 18
- 21. Электронная конфигурация атома Kr ) ) ) ) +36 2 8 18 8 Kr 1s2 2s2
- 22. Электронные конфигурации элементов первой группы главной подгруппы H 1s1 Li 1s2 2s1 Na 1s2 2s2 2p6
- 23. Заполнение электронами второго энергетического уровня Li 1s2 2s1 2p0 Be 1s2 2s2 2p0 B 1s2 2s2
- 24. Назовите элемент электронную конфигурацию которого вы видите на экране 1s2 2s2 2p6 3s2 3p6 3d10 4s2
- 26. Скачать презентацию




















 Минерал гранат
Минерал гранат Radiation dosimetry
Radiation dosimetry Физико-химические свойства воды. Водные ресурсы Земли
Физико-химические свойства воды. Водные ресурсы Земли Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Вакуумное фильтрование
Вакуумное фильтрование Инфузионая терапия новорожденных
Инфузионая терапия новорожденных Защитные материалы
Защитные материалы Наука плазмохимия
Наука плазмохимия Фосфор. Получение. Химические свойства
Фосфор. Получение. Химические свойства Brain элементтері
Brain элементтері Аттестационная работа. Программа элективного курса по химии экологическая химия
Аттестационная работа. Программа элективного курса по химии экологическая химия Теоретические основы органической химии
Теоретические основы органической химии Свойства фенола
Свойства фенола Катализ. Влияние катализатора на скорость химической реакции
Катализ. Влияние катализатора на скорость химической реакции Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Дослідження достовірності реклами з погляду хімії
Дослідження достовірності реклами з погляду хімії Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Трансмиссионное масло ADDINOL Eco Gear GLS
Трансмиссионное масло ADDINOL Eco Gear GLS ГИА по химии
ГИА по химии Оксиди, їх склад, назви.
Оксиди, їх склад, назви.  Оксид кремния
Оксид кремния Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие ГИА-9 Химия. А4
ГИА-9 Химия. А4 Каталитический крекинг
Каталитический крекинг Свойства аммиачной селитры
Свойства аммиачной селитры Растворение, растворимость веществ в воде
Растворение, растворимость веществ в воде