Содержание
- 2. Химия- важнейшая наука в жизни человека!
- 3. Химия
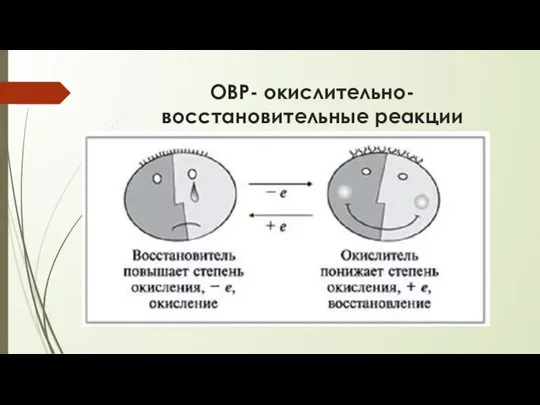
- 4. ОВР- окислительно-восстановительные реакции
- 5. Цель работы- познакомиться с методом решения ОВР с участием органических веществ. - изучить методы решения ОВР;
- 6. ОВР
- 7. Способы решения ОВР. Метод ионно-электронного баланcа Метод полуреакций Метод подстановки
- 8. Выводы по работе В ходе работы были рассмотрены методы решения ОВР, проанализированы возможности решения с их
- 9. Пример 1 CH3-CH2-CH=CH2 + KMnO4 + H2O = С2Н5-СООК + MnO2 + KOH+ КНСО3 С -1
- 10. Пример 2 + KMnO4 + H2SO4 = + CO2 + CH3COOH + MnSO4 + K2SO4 +
- 11. Практическая значимость Эта работа может быть интересна ученикам, собирающимся сдавать ЕГЭ по химии и (или) готовящимся
- 13. Скачать презентацию









 Производство HNO3
Производство HNO3 Рентген-флуоресцентті талдау. Микроэлементтер талдауында қолдану
Рентген-флуоресцентті талдау. Микроэлементтер талдауында қолдану Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Жидкие кристаллы Подготовила: Кальченко Алёна
Жидкие кристаллы Подготовила: Кальченко Алёна  Ақуыздардың құрылысы мен қызыметі
Ақуыздардың құрылысы мен қызыметі Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний
Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний  Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Диффузия и осмос
Диффузия и осмос Подготовка к контрольной работе «Неметаллы»
Подготовка к контрольной работе «Неметаллы» Химия: основные понятия
Химия: основные понятия Арены. Бензол
Арены. Бензол Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Ionic and molecular compounds
Ionic and molecular compounds Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно
Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно Круговорот кислорода
Круговорот кислорода Фосфор
Фосфор Викторина Своя игра по химии
Викторина Своя игра по химии Химические уравнения. Типы химических реакций
Химические уравнения. Типы химических реакций Химическая связь и ее типы
Химическая связь и ее типы Контрольная работа №1
Контрольная работа №1 Смещение химического равновесия. Принцип Ле Шателье-Брауна
Смещение химического равновесия. Принцип Ле Шателье-Брауна Хімічні методи підвищення продуктивності свердловини
Хімічні методи підвищення продуктивності свердловини Кислотно-основное титрование
Кислотно-основное титрование Химическая связь
Химическая связь Презентация Лекарства дома
Презентация Лекарства дома Влияние шампуня на состояние волос человека
Влияние шампуня на состояние волос человека