Содержание
- 2. Общие сведения Все хим. в-ва существуют в природе преимущественно в составе т. н. дисперных систем, т.е.
- 3. 1) по размеру частиц дисп. фазы Классификация дисперсных систем размер частиц дисперсной фазы, агрегатное состояние частиц
- 4. 2) по агрегатному состоянию д.с. и д.ф. Т - твёрдое (кристаллическое), Ж - жидкость, Г -
- 5. 3) Форма частиц дисперсной фазы (или топология) может быть разнообразной. Наиболее удобный способ классификации связан с
- 6. 5) по структурообразованию (взаим-вию между ч-цами д. ф.) свободно-дисперсные системы золь связано-дисперсные системы гель рыхлая неупорядоченная
- 7. РАСТВОРЫ Растворы – это многокомпонентные гомогенные (однофазные) системы переменного состава. Р-ры бывают жидкими, твёрдыми и газовыми.
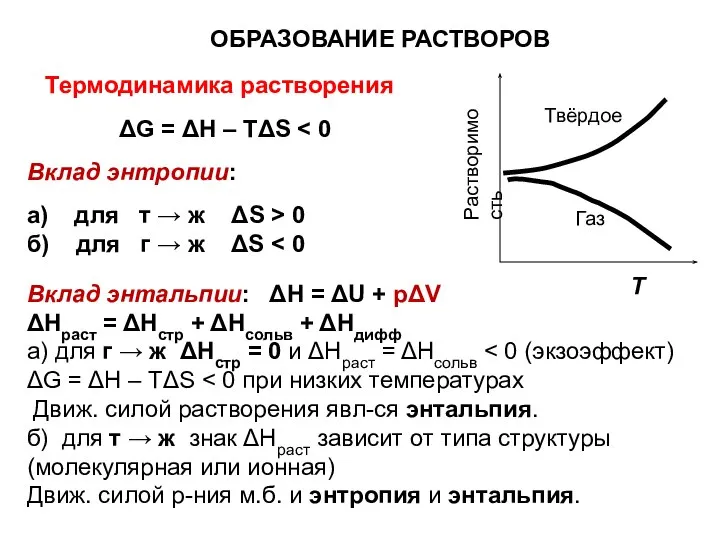
- 8. Термодинамика растворения ΔG = ΔН – ТΔS Вклад энтропии: а) для т → ж ΔS >
- 9. Кинетика растворения. Растворение веществ – процесс обратимый. Для кристаллических в-в ϑраст = Краст = const (при
- 10. Свойства растворов: Состав (концентрация), Давление пара растворителя над раствором, Температуры кипения и замерзания растворов, Осмотическое давление.
- 11. Количество вещества (моль и эквивалент) Моль – кол-во в-ва, содержащее столько атомов, мол-л, ионов или др.
- 12. Эквивалент – кол-во в-ва, к-рое соединяется с 1 моль атомов (ионов) водорода или замещает их в
- 13. а) массовые доли или процентная конц-ция показывает число граммов раств. в-ва, содержащихся в 100 г р-ра.
- 14. в) молярность или молярная конц-ция показывает число молей раст. в-ва, содержащихся в 1л р-ра. г) моляльность
- 15. е) Титр р-ра – число грамм раств. в-ва в 1 см3 (мл) р-ра. Закон эквивалентов: массы
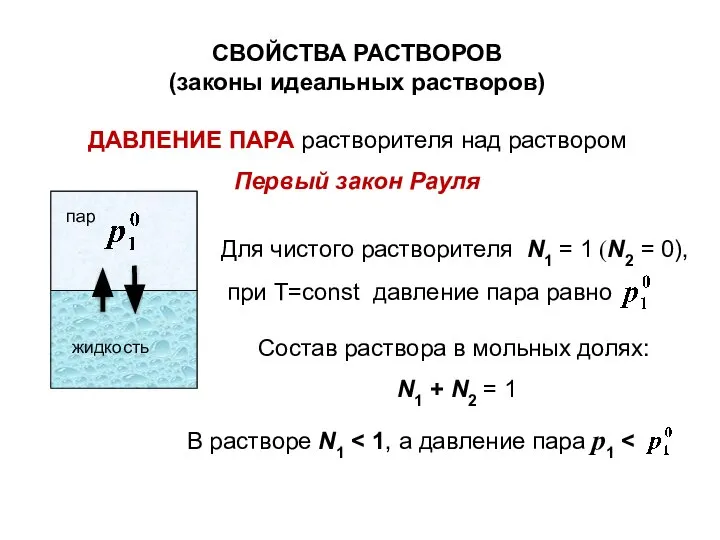
- 16. Для чистого растворителя N1 = 1 (N2 = 0), при Т=const давление пара равно СВОЙСТВА РАСТВОРОВ
- 17. робщ для чист. р-ля при N1 = 1, т.е. N2 = 0 р1 = р10 при
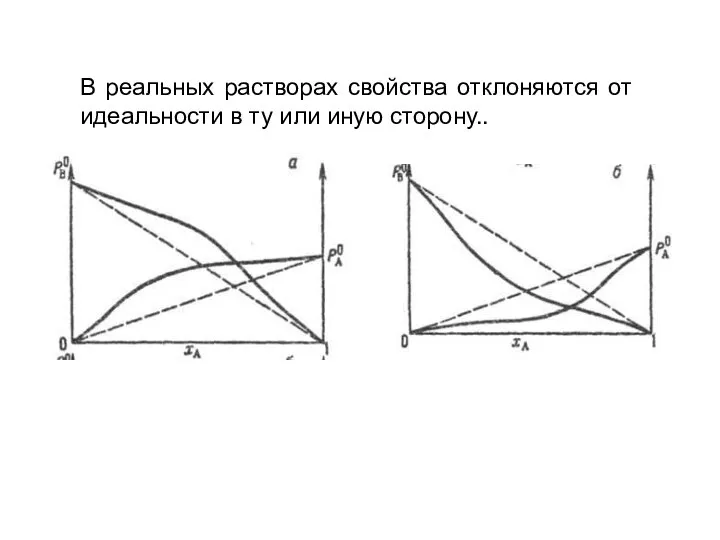
- 18. В реальных растворах свойства отклоняются от идеальности в ту или иную сторону..
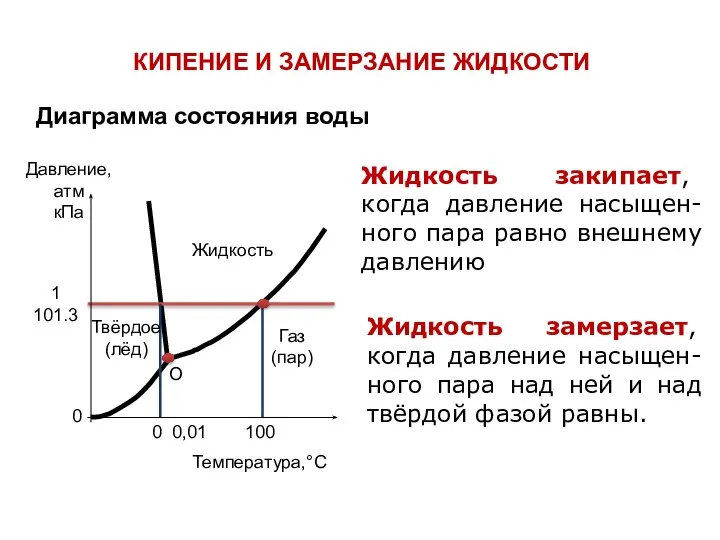
- 19. КИПЕНИЕ И ЗАМЕРЗАНИЕ ЖИДКОСТИ Жидкость закипает, когда давление насыщен-ного пара равно внешнему давлению Жидкость замерзает, когда
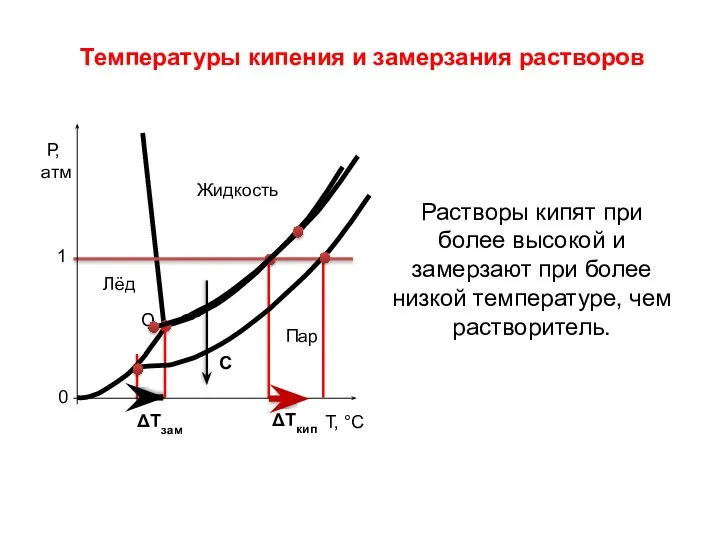
- 20. Температуры кипения и замерзания растворов Растворы кипят при более высокой и замерзают при более низкой температуре,
- 21. Второй закон Рауля – понижение т-ры кипения и повышение т-ры замерзания р-ра прямо пропорцио-нально моляльной конц-ции
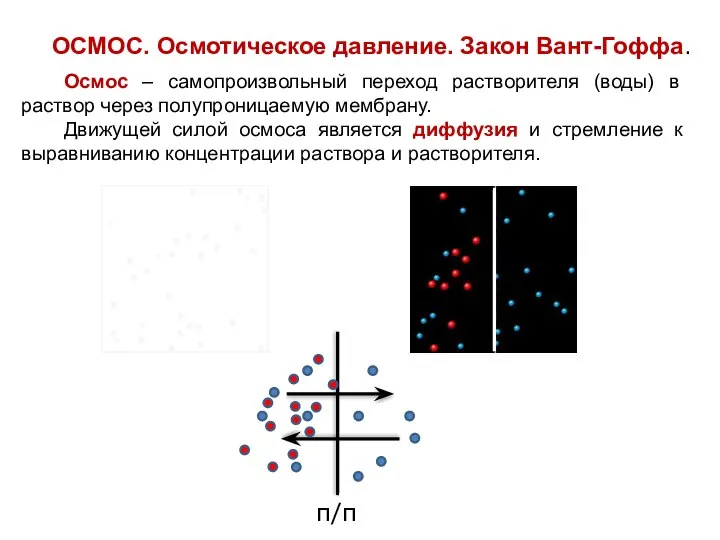
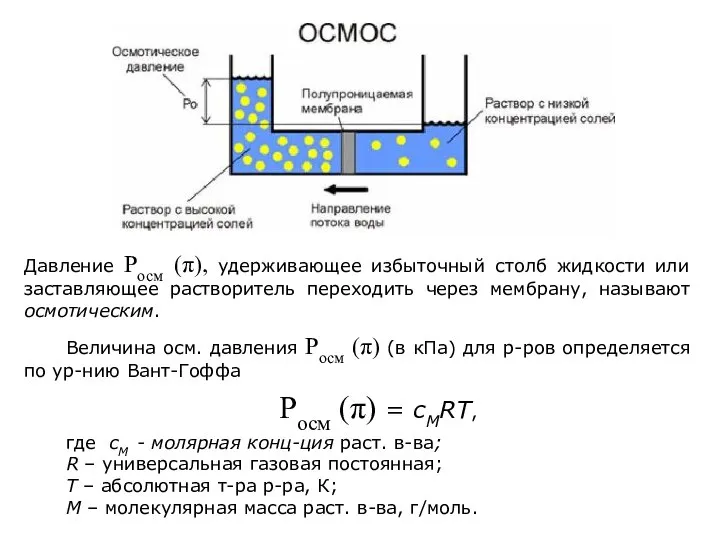
- 22. ОСМОС. Осмотическое давление. Закон Вант-Гоффа. Осмос – самопроизвольный переход растворителя (воды) в раствор через полупроницаемую мембрану.
- 23. п/п п/п
- 24. Величина осм. давления Росм (π) (в кПа) для р-ров определяется по ур-нию Вант-Гоффа Росм (π) =
- 25. Особенности р-ров солей, кислот и оснований Имеются в-ва, р-ры к-рых сильно отклоняются от законов Рауля и
- 26. Итак, соли, кислоты и основания, растворяясь в воде, создают значительно большее осм. давление, чем эквимолекулярные кол-ва
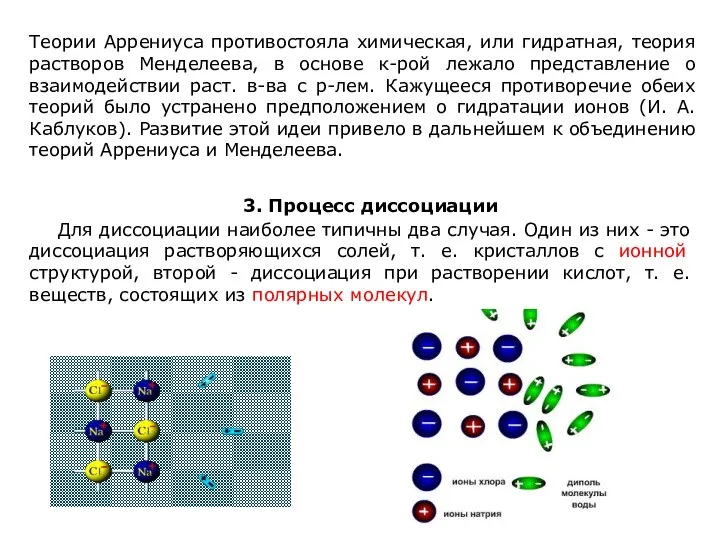
- 27. Теории Аррениуса противостояла химическая, или гидратная, теория растворов Менделеева, в основе к-рой лежало представление о взаимодействии
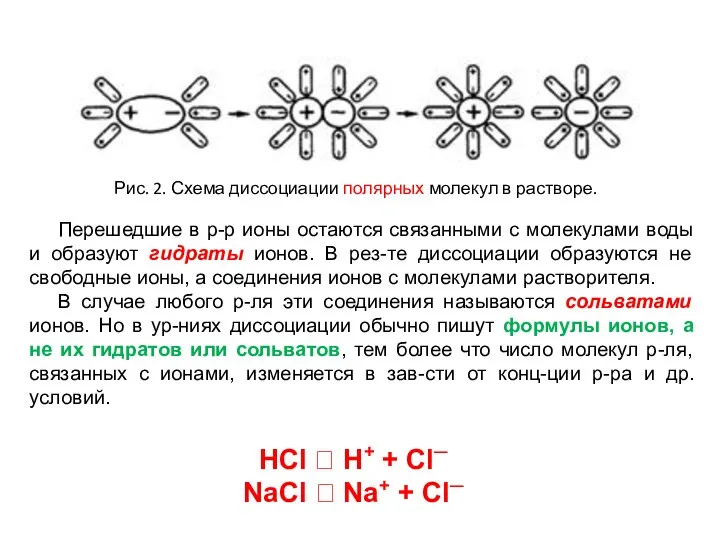
- 28. Рис. 2. Схема диссоциации полярных молекул в растворе. Перешедшие в р-р ионы остаются связанными с молекулами
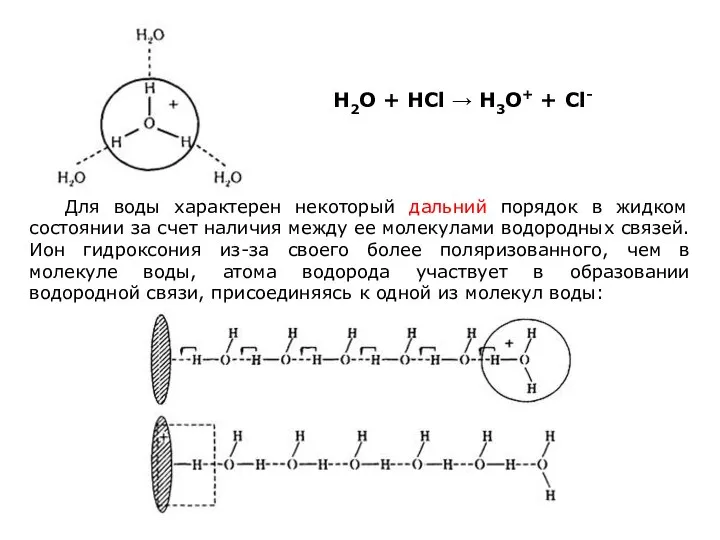
- 29. Для воды характерен некоторый дальний порядок в жидком состоянии за счет наличия между ее молекулами водородных
- 30. 4. Степень диссоциации. Сила электролитов Еще Вант-Гофф установил, что коэффициент i выражается дробными числами, к-рые с
- 31. В р-ре устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Степень электролит. диссоциации электролита в водных
- 32. 5. Константа диссоциации К равновесию, к-рое устанавливается в р-ре слабого эл-та между мол-ми и ионами, можно
- 33. Если обозначить конц-цию эл-та, распадающегося на два иона, через cМ, а степень его диссоциации в данном
- 34. Ступенчатая диссоциация КД = КД1·КД2 K1 > K2 > K3
- 35. Диссоциация воды Чистая вода очень плохо проводит эл. ток, но все же обладает измеримой эл. проводимостью
- 36. для воды и разбавленных водных р-ров при неизменной т-ре произведение конц-ций ионов Н+ и ОН- есть
- 37. pH = -lg[H+] Водородный показатель
- 39. Скачать презентацию
























![pH = -lg[H+] Водородный показатель](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397121/slide-36.jpg)
 Цинк. Нахождение в природе
Цинк. Нахождение в природе Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Общая фармакология
Общая фармакология Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Структурные превращения стали 15Х5М при различных режимах термической обработки
Структурные превращения стали 15Х5М при различных режимах термической обработки Живая химия
Живая химия Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3)
Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3) Оксиды углерода
Оксиды углерода Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Липатова Яна
Липатова Яна Фотохимический смог
Фотохимический смог Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП
Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП Амиды кислот. Азо- и диазосоединения
Амиды кислот. Азо- и диазосоединения «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Мои первые химические опыты
Мои первые химические опыты Яковлева Татьяна Алексеевна Ярославль, 2009 г.
Яковлева Татьяна Алексеевна Ярославль, 2009 г.  Ионообменная хроматография
Ионообменная хроматография Металлы Общая характеристика
Металлы Общая характеристика Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов
Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов Презентация по Химии "щелочные метал" - скачать смотреть бесплатно
Презентация по Химии "щелочные метал" - скачать смотреть бесплатно Chemical bonds
Chemical bonds Коллигативные свойства растворов
Коллигативные свойства растворов Аспірин Даниленко, Реутенко 11-А
Аспірин Даниленко, Реутенко 11-А  Химические свойства алкинов
Химические свойства алкинов Девиз урока: «Зажечь, увлечь и подвести»
Девиз урока: «Зажечь, увлечь и подвести»  Презентация по Химии "Галогены и их соединения" - скачать смотреть
Презентация по Химии "Галогены и их соединения" - скачать смотреть  Цемент. (9 класс)
Цемент. (9 класс)