Содержание
- 2. Электрохимическая система При равновесии ΔG = 0 , то ток в цепи: I = 0 ΔG=ΔrG
- 3. Соотношение количество вещества - величина тока в электрохимических(электродных) процессах анодный процесс Ме1→ Mе1+n + nē ≡
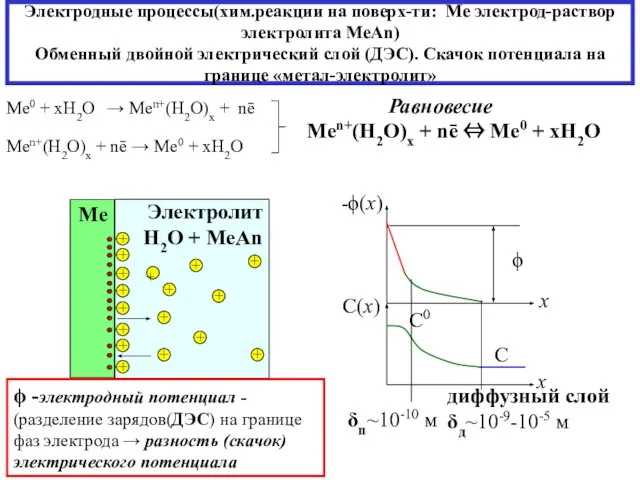
- 4. Электродные процессы(хим.реакции на поверх-ти: Ме электрод-раствор электролита MeAn) Обменный двойной электрический слой (ДЭС). Скачок потенциала на
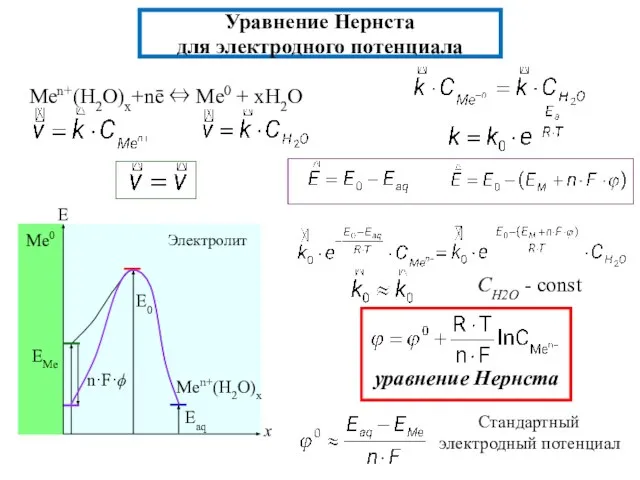
- 5. Уравнение Нернста для электродного потенциала Men+(H2O)x+nē ⇔ Me0 + xH2O
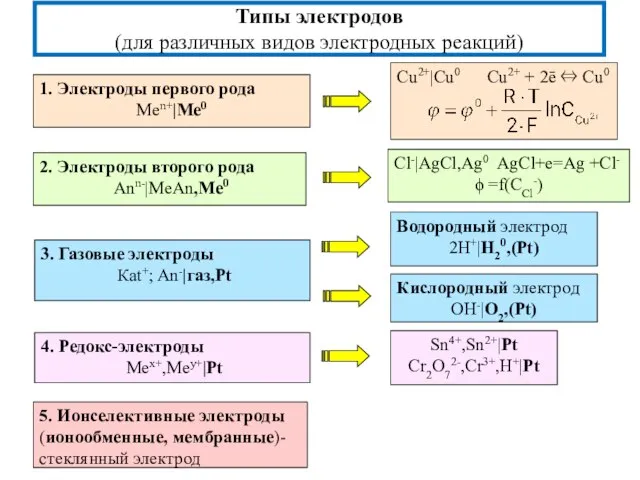
- 6. Типы электродов (для различных видов электродных реакций) 1. Электроды первого рода Men+|Me0 2. Электроды второго рода
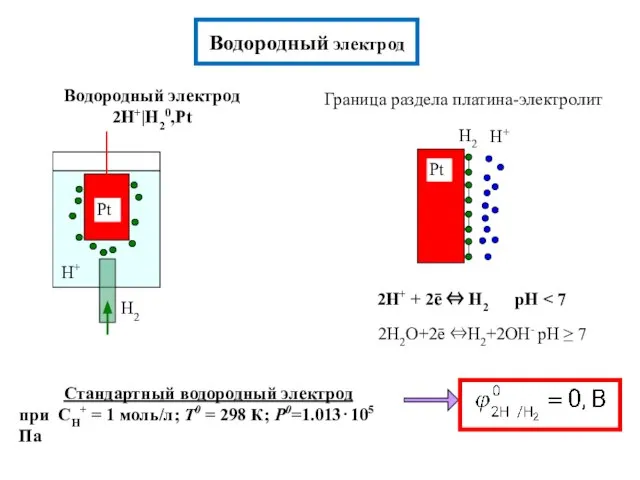
- 7. Водородный электрод Граница раздела платина-электролит Водородный электрод 2H+|H20,Pt 2H+ + 2ē ⇔ H2 pH Стандартный водородный
- 8. Водородная шкала электродных потенциалов А(−) Me0|Men+||2H+|H20(Pt) (+)К или А(−) (Pt)H20, |2H+||Men+|Me0 (+)К если CH+ = 1
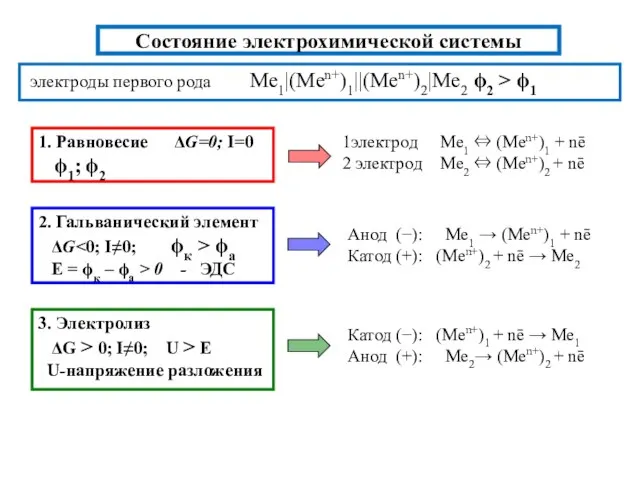
- 9. Состояние электрохимической системы электроды первого рода Me1|(Men+)1||(Men+)2|Me2 ϕ2 > ϕ1 1. Равновесие ΔG=0; I=0 ϕ1; ϕ2
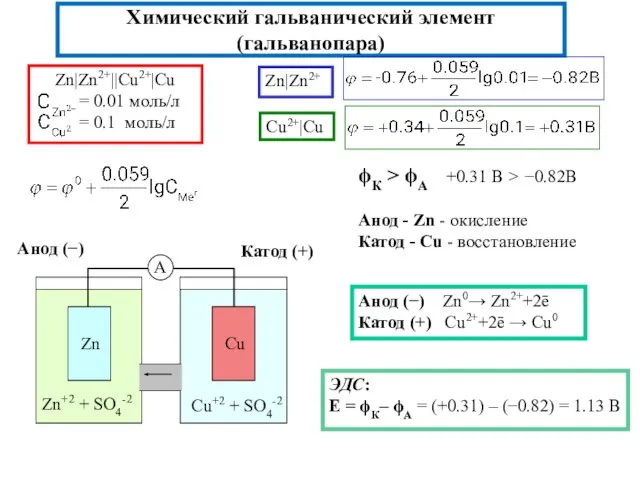
- 10. Химический гальванический элемент(гальванопара) ЭДС: E = ϕК– ϕА = (+0.31) – (−0.82) = 1.13 В Cu2+|Cu
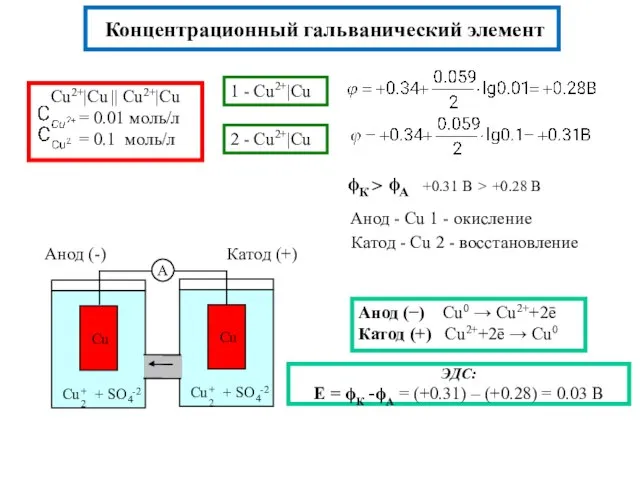
- 11. ЭДС: Е = ϕК -ϕА = (+0.31) – (+0.28) = 0.03 В Концентрационный гальванический элемент Анод
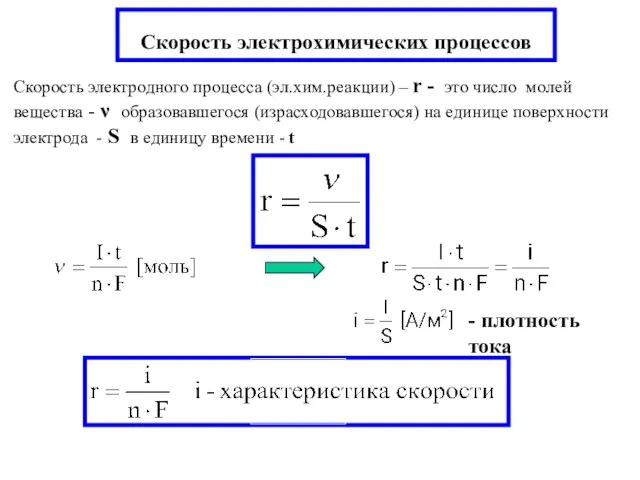
- 12. Скорость электрохимических процессов
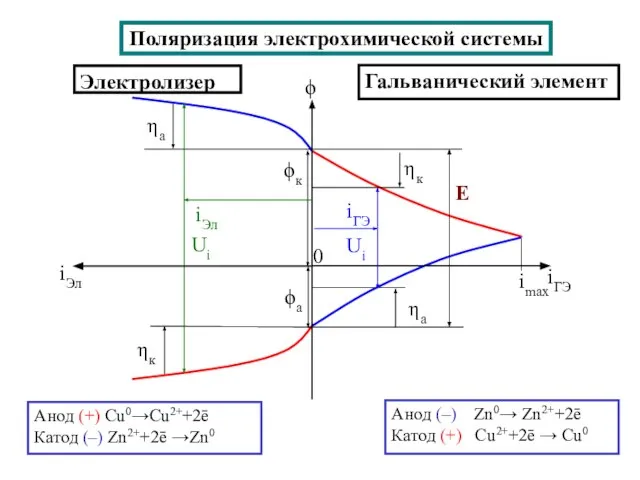
- 13. Поляризация электродов – [η] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ =
- 14. Поляризация электрохимической системы
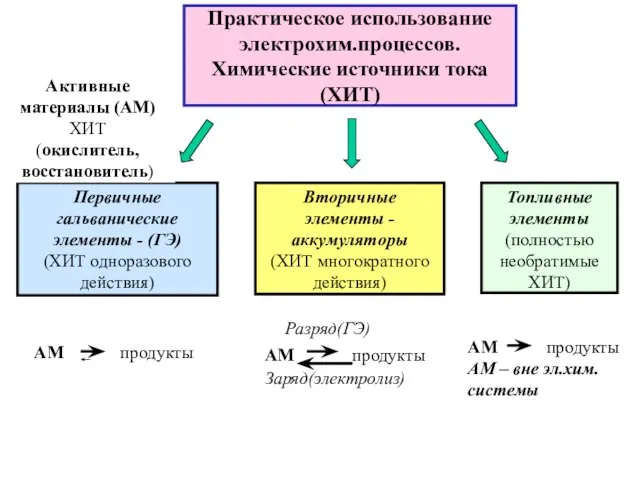
- 15. Практическое использование электрохим.процессов. Химические источники тока (ХИТ) АМ продукты Активные материалы (АМ) ХИТ (окислитель, восстановитель)
- 16. Основные характеристики ХИТ ЭДС гальванического элемента (Е, В) -напряжение без нагрузки Номинальное напряжение (U, В) -напряжение
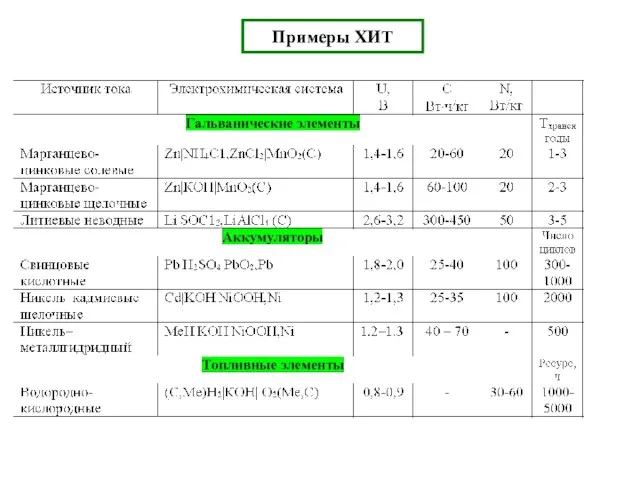
- 17. Примеры ХИТ
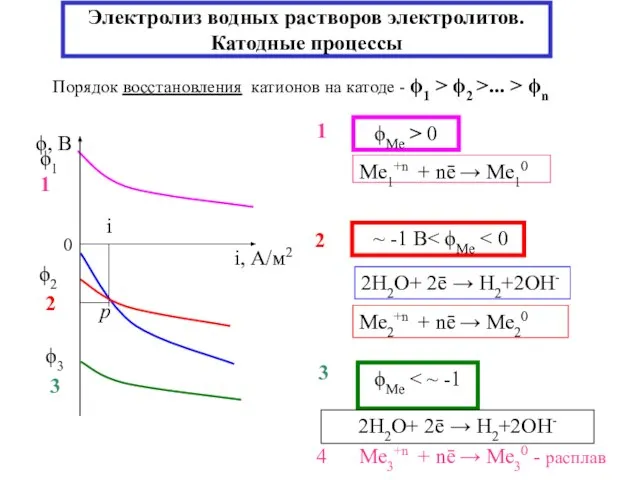
- 18. Электролиз водных растворов электролитов. Катодные процессы Порядок восстановления катионов на катоде - ϕ1 > ϕ2 >...
- 20. Скачать презентацию



![Поляризация электродов – [η] (сближение потенциалов катода и анода и уменьшение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/541822/slide-12.jpg)

 Составление уравнений ОВР
Составление уравнений ОВР Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры
Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры Органічні речовини в живій природі
Органічні речовини в живій природі  Обмен нуклеотидов
Обмен нуклеотидов Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза
Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты
Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты  Бензол и его свойства
Бензол и его свойства Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2
Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2 Занимательные задачи по химии
Занимательные задачи по химии Вода - растворитель
Вода - растворитель Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Типы химических реакций (11 класс)
Типы химических реакций (11 класс) Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов «terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың
«terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың углерод и его свойства
углерод и его свойства Олигонуклеотидный синтез
Олигонуклеотидный синтез Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения
Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения Любопытная органическая химия
Любопытная органическая химия Роль органической химии в жизни человека
Роль органической химии в жизни человека Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Соединения галогенов.
Соединения галогенов. Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора