Содержание
- 3. Электролитическая диссоциация - Это процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 4. Механизм диссоциации веществ с разным типом связи: Ионная связь
- 5. Ковалентная полярная связь
- 6. Правила составления ионных уравнений 1. Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не
- 8. Алгоритм составления ионных уравнений Записать молекулярное уравнение реакции 3NaOH + FeCl3 = Fe(OH)3 + 3NaCl С
- 10. Скачать презентацию
Слайд 2
Слайд 3
Электролитическая диссоциация -
Это процесс распада электролита на ионы при растворении
Электролитическая диссоциация -
Это процесс распада электролита на ионы при растворении
его в воде или расплавлении.
Слайд 4
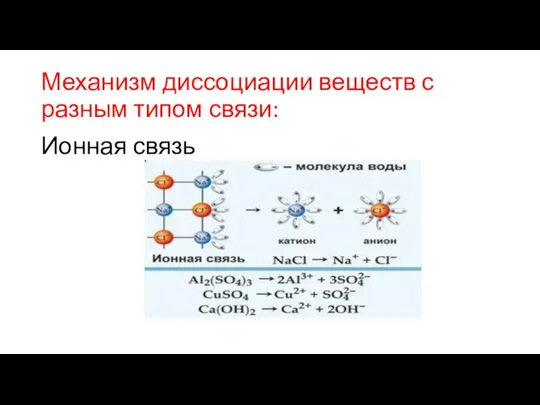
Механизм диссоциации веществ с разным типом связи:
Ионная связь
Механизм диссоциации веществ с разным типом связи:
Ионная связь
Слайд 5
Ковалентная полярная связь
Ковалентная полярная связь
Слайд 6
Правила составления ионных уравнений
1. Простые вещества, оксиды, а также нерастворимые
Правила составления ионных уравнений
1. Простые вещества, оксиды, а также нерастворимые
кислоты, основания и соли не диссоциируют.
2. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
2. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Слайд 7
Слайд 8
Алгоритм составления ионных уравнений
Записать молекулярное уравнение реакции
3NaOH + FeCl3 =
Алгоритм составления ионных уравнений
Записать молекулярное уравнение реакции
3NaOH + FeCl3 =
Fe(OH)3 + 3NaCl
С помощью таблицы растворимости определить растворимость каждого вещества.
р р н р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3. Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl-
4. Найти одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сократить их слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 ↓ + 3Na+ + 3Cl-
5. Составить сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓
С помощью таблицы растворимости определить растворимость каждого вещества.
р р н р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3. Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl-
4. Найти одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сократить их слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 ↓ + 3Na+ + 3Cl-
5. Составить сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓






 Химические и физические явления
Химические и физические явления Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Сплавы со специальными свойствами
Сплавы со специальными свойствами Поли- и гетерофункциональные соединения
Поли- и гетерофункциональные соединения Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Кремний и его соединения
Кремний и его соединения Всі відомості Автор презентації – Розмаїтий Дмитро 7-Б клас
Всі відомості Автор презентації – Розмаїтий Дмитро 7-Б клас  Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Композиционные материалы
Композиционные материалы Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии
Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии  Растворы. Часть 2
Растворы. Часть 2 Органическая химия. Установочная лекция
Органическая химия. Установочная лекция Биохимические изменения компонентов молока в процессе переработки
Биохимические изменения компонентов молока в процессе переработки CaSO4:Tb3+ кристалында радиациялық ақаулардың пайда болуының нәтижелерін теориялық мәләметтерге сәйкестігін зерттеу
CaSO4:Tb3+ кристалында радиациялық ақаулардың пайда болуының нәтижелерін теориялық мәләметтерге сәйкестігін зерттеу Кислотно-основні рівноваги в біологічних системах. (Лекція 2)
Кислотно-основні рівноваги в біологічних системах. (Лекція 2) Исследование явления адсорбции на поверхности твердых тел (метод бумажной хроматографии). Асоян Пайлак Зарифи Джамшед 9 “a” класс ГБОУ лицей № 389 “ЦЭО” Руководитель: Скрижеева Е.В.
Исследование явления адсорбции на поверхности твердых тел (метод бумажной хроматографии). Асоян Пайлак Зарифи Джамшед 9 “a” класс ГБОУ лицей № 389 “ЦЭО” Руководитель: Скрижеева Е.В. Производство серной кислоты
Производство серной кислоты Органическая химия. История развития
Органическая химия. История развития Химическая связь
Химическая связь Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Псевдогалогены и их соединения
Псевдогалогены и их соединения Розчини електролітів
Розчини електролітів Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Презентация Предельные углеводороды
Презентация Предельные углеводороды  Біоорганічна хімія. Реакційна здатність біоорганічних сполук
Біоорганічна хімія. Реакційна здатність біоорганічних сполук Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Железо и его соединения
Железо и его соединения