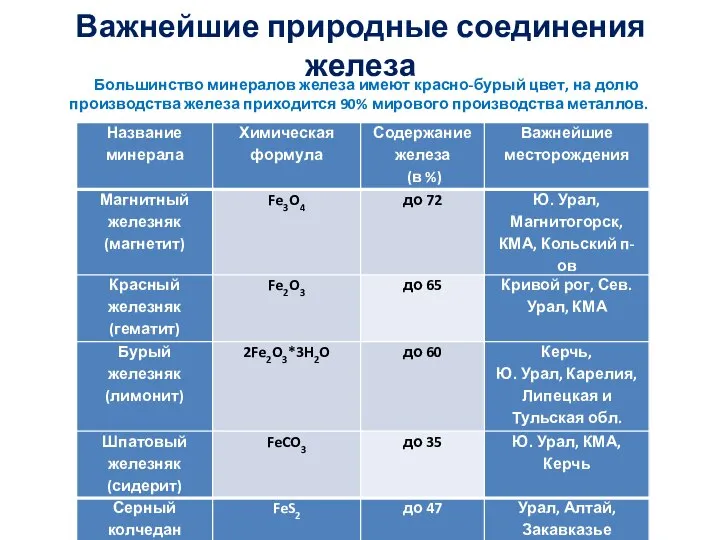
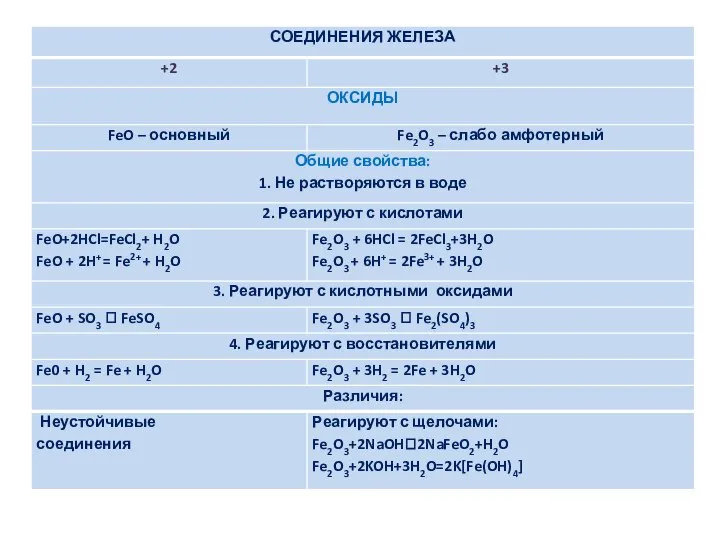
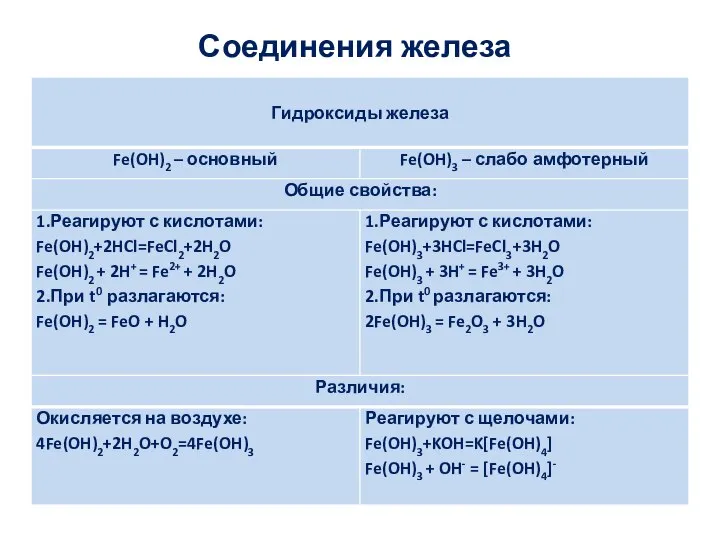
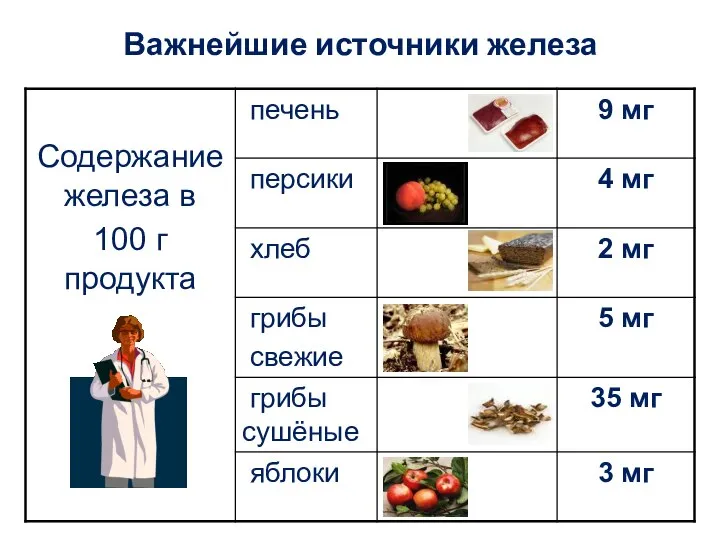
Применение соединений железа
FeSO4 * 7H2O – железный купорос; применяется в текстильной
промышленности при крашении тканей, в сельском хозяйстве для протравы семян и борьбы с вредителями сельского хозяйства, получение чернила.
FeCl2 – хлорид железа (II); применяется для получения чистого железа, компонент антианемических препаратов, катализатор в органическом синтезе.
FeCl3 – хлорид железа (III); применяется в технике как окислитель в производстве органических красителей, в текстильной промышленности – для протравки тканей при подготовке их к окраске, в медицине как кровоостанавливающее средство, компонент тонирующих растворов в фотографии, коагулянт при очистке воды, для определения фенолов.
Fe2(SO4)3 – сульфат железа (III); применяется как химический реактив при гидрометаллургической переработке медных руд, как коагулянт при очистке сточных вод, для получения квасцов, пигмента Fe2O3.






 Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Алканы. Циклоалканы
Алканы. Циклоалканы Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Химические свойства алканов
Химические свойства алканов Аналитическая химия
Аналитическая химия Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс "
Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс " Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.
Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.  Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Природные каменные материалы
Природные каменные материалы Количество вещества (8 класс)
Количество вещества (8 класс) Кислоты. Номенклатура кислот
Кислоты. Номенклатура кислот Темір. Жай заттармен
Темір. Жай заттармен Гигиена питания школьников
Гигиена питания школьников Химические свойства алкадиенов и алкинов
Химические свойства алкадиенов и алкинов Мінеральні добрива
Мінеральні добрива Карбид кремния
Карбид кремния Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11
Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11 Строение атома. Периодичность свойств элементов и их соединений
Строение атома. Периодичность свойств элементов и их соединений Взаимодействие кислоты с основанием
Взаимодействие кислоты с основанием Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением Алка́ны
Алка́ны Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Презентація уроку «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів» Підготувала: учитель хімії ви
Презентація уроку «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів» Підготувала: учитель хімії ви Химический элемент водород
Химический элемент водород Презентация по Химии "Алканы 10 класс" - скачать смотреть
Презентация по Химии "Алканы 10 класс" - скачать смотреть  Узагальнення знань з теми «Вуглеводні»
Узагальнення знань з теми «Вуглеводні» Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Алкены. 10 класс
Алкены. 10 класс