Содержание
- 2. Современная модель атома Атом – электронейтральная частица Ядро атома – положительно заряженное Электроны – отрицательно заряженные
- 3. Состав ядра атома Протоны. Масса = 1, заряд = +1 Нейтроны. Масса = 1, заряд =
- 4. Изотопы Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся количеством нейтронов в ядре атома.
- 5. Частицы микромира Корпускулярно-волновой дуализм Электрон – частица с массой m1= 9*10-28, скорость 108 см/сек, заряд -1
- 6. Важные понятия Электронное облако – пространство около ядра атома, где сосредоточены вся масса электрона и электронная
- 7. Квантовые числа Квантовые числа описывают состояние электрона в атоме n – главное квантовое число, характеризует общую
- 8. Квантовые числа l – побочное квантовое число, определяет запас энергии электрона на энергетическом подуровне, а так
- 9. Квантовые числа ml – магнитное квантовое число соответствует распределению АО в пространстве около ядра Определяет количество
- 10. Квантовые числа ms – магнитное спиновое квантовое число (спин) характеризует квантовое свойство электрона Это собственный момент
- 11. (Пример) H 1S1 n=1 L=0 ml=0 ms =+1/2
- 12. Принципы заполнения электронных оболочек принцип Паули «Два электрона в атоме не могут одинаковые квантовые числа». правило
- 13. Несоблюдение принципа Паули При несоблюдении принципа Паули на АО в атоме были бы электроны с одинаковыми
- 14. Несоблюдение правила Хунда При несоблюдении правила Хунда суммарный спин не будет максимальным, а это соответствует большему
- 15. Электронные семейства s-элементы, если заполняется s-подуровень (элементы I и II А групп и гелий) p-элементы, если
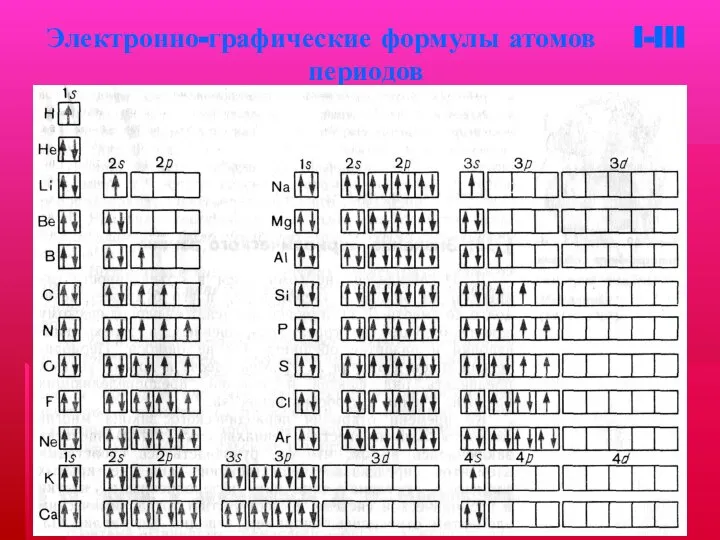
- 16. Электронно-графические формулы атомов I-III периодов
- 17. Домашнее задание на 17 ноября: 1. Пар.52, стр.238-244 2.Напишите электронно-графические формулы двух S и двух Р-элементов
- 18. Электронно-графические формулы атомов IV-VII периодов
- 19. «Провал» электрона В атомах некоторых элементов электрон с s-подуровня внешнего энергетического уровня переходит на d-подуровень предвнешнего
- 23. Задание Определить элемент: Составить электронные и электронно-графические формулы элемента и определите какой это элемент:
- 25. Скачать презентацию





















 Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Практическая работа по химии. Строение пламени
Практическая работа по химии. Строение пламени Кислоты
Кислоты Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Молярный объём
Молярный объём Псевдогалогены и их соединения
Псевдогалогены и их соединения Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС
Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич
Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови План розміщення добрив у польовій сівозміні. (Лабораторна робота 22)
План розміщення добрив у польовій сівозміні. (Лабораторна робота 22) Нанохімія та нанотехнології
Нанохімія та нанотехнології Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н.
Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н. МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ
МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ Ароматические системы
Ароматические системы Неорганические вещества
Неорганические вещества Буферные растворы
Буферные растворы Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Химические и физические явления
Химические и физические явления Отдельные классы дисперсных систем
Отдельные классы дисперсных систем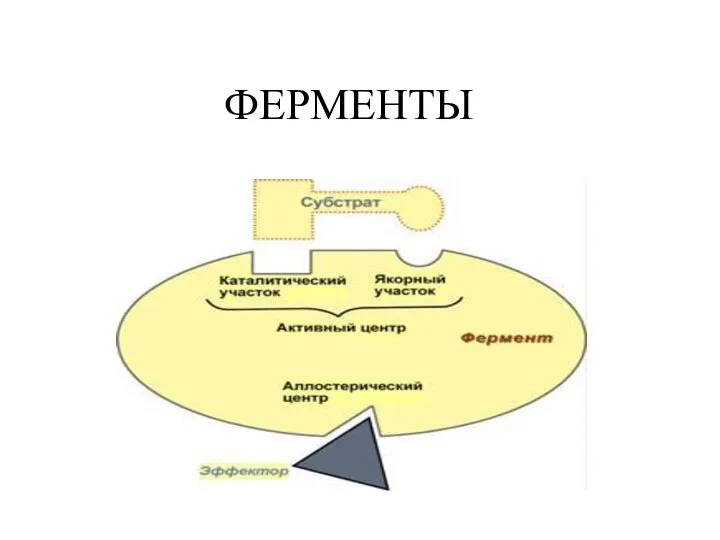 Ферменты. Значение ферментов
Ферменты. Значение ферментов Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Элементы 7 группы побочной подгруппы
Элементы 7 группы побочной подгруппы Современная система контроля и обеспечения качества лекарственных средств в Украине
Современная система контроля и обеспечения качества лекарственных средств в Украине Сложные эфиры
Сложные эфиры