Содержание
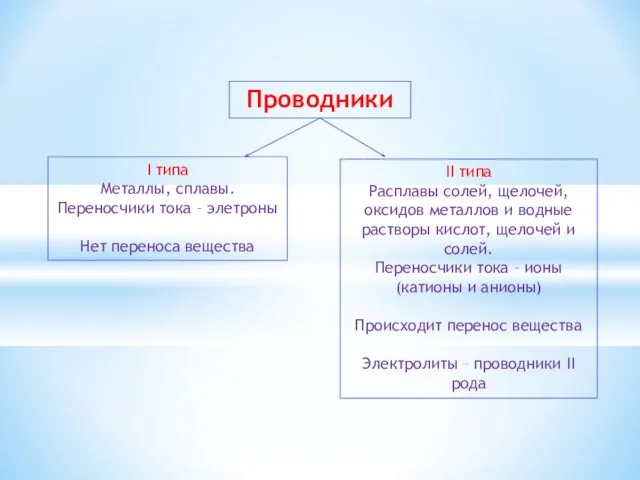
- 2. Проводники I типа Металлы, сплавы. Переносчики тока – элетроны Нет переноса вещества II типа Расплавы солей,
- 3. Сила тока, напряжение и сопротивление проводников связано уравнением: I = U/R
- 4. Электропроводность – способность вещества проводить электрический ток L = 1/R [ом-1] Зависит от: 1) природы электролита
- 5. Электропроводность Удельная χ = 1/ρ [ом-1⋅м-1] χ-каппа Молярная λ = 1000 χ /C [ом-1⋅м2⋅моль-1] λ -
- 6. Известно, что: R = ρ ⋅ l/S, или ρ = R⋅S / l, иначе L =
- 7. Удельная электропроводность – электропроводность раствора, заключенного между 2-мя параллельными электродами площадью 1м2 и расположенными на расстоянии
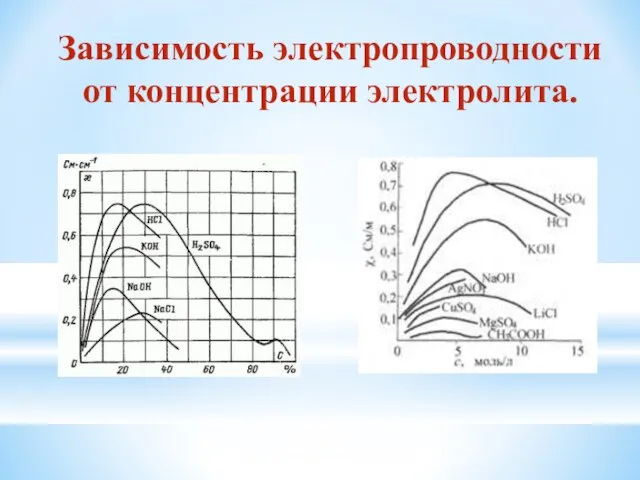
- 8. Зависимость электропроводности от концентрации электролита.
- 9. Молярная электропроводность – электропроводность объема раствора, содержащего 1 моль/л электролита, находящегося между 2-мя параллельными электродами на
- 10. Молярная (эквивалентная) электропроводность возрастает с разбавлением. При С → 0 λ → max Причины: 1) исчезает
- 11. Молярная (эквивалентная) электропроводность при бесконечном разведении (λ∞) зависит только от скорости движения ионов. Кольрауш (1875 г)
- 12. Из всех катионов – катионы Н+ и анионов – гидроксид-ионы ОН- обладают аномально большой подвижностью. Имеет
- 13. При полной диссоциации электролита α=1, а λ=λ∞, отсюда α = λ / λ∞ Оствальд установил, что:
- 14. Организм человека можно отнести к группе своеобразных полимеров – биополимеров, это химические соединения, состоящие из большого
- 15. Живая ткань, особенно ткань нервной системы, обладает сложнейшей комплексной электропроводностью. На практике в качестве диагностического признака
- 16. Электропунктурная диагностика (ЭПД) – метод диагностики заболеваний, основанный на измерении электропроводности биологически активных точек (БАТ). Реография
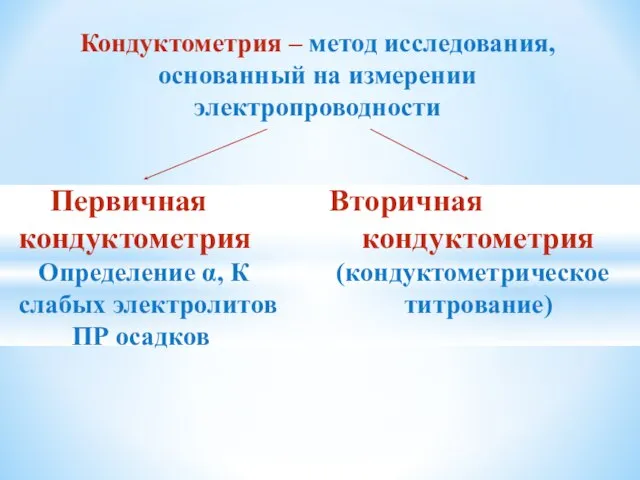
- 17. Кондуктометрия – метод исследования, основанный на измерении электропроводности Первичная Вторичная кондуктометрия кондуктометрия Определение α, К (кондуктометрическое
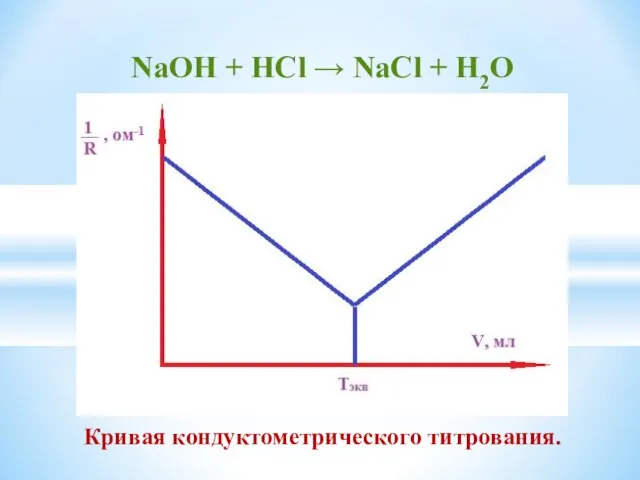
- 18. NaОН + HСl → NaCl + H2O Кривая кондуктометрического титрования.
- 19. Электрохимия изучает взаимное превращение химической энергии в электрическую и наоборот. 2 типа электрохимии Химическая Химическая энергия
- 20. В электрическую энергию можно превратить энергию только окислительно-восстановительного процесса. Гальванический элемент – это устройство, в котором
- 21. Электрохимические цепи – системы, состоящие из двух электродов, помещенных в раствор электролита или в два разных
- 22. Гальванические элементы Химические Концентрационные В химических цепях источником электрической энергии является энергия Гиббса, протекающей в системе
- 23. В гальваническом элементе есть: - металл (электрод) – проводник I рода - раствор электролита – проводник
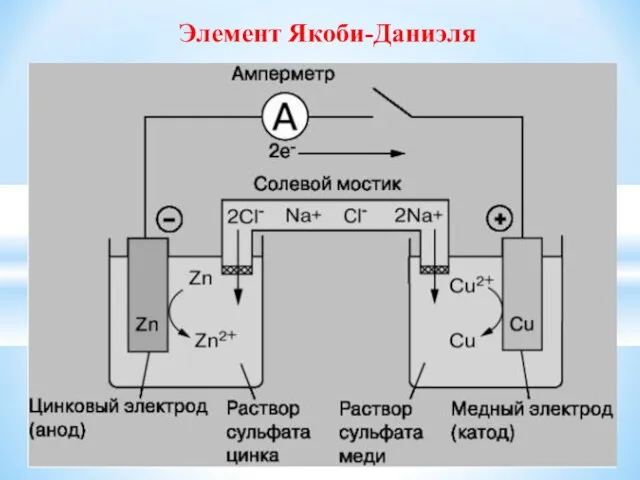
- 24. Элемент Якоби-Даниэля
- 25. Работа гальванического элемента можно рассматривать как результат окислительно- восстановительной реакции Zn – 2e → Zn2+ ΔGo
- 26. Электродвижущая сила (Е) гальванического элемента равна разности потенциалов правого и левого электродов Е = ϕправ -
- 27. Если ЭДС элемента положительна, то реакция протекает самопроизвольно, т.е. Е > 0 и ΔG где z
- 28. При погружении металла в воду или раствор его соли часть ионов металла Мz+ переходит в раствор.
- 29. Абсолютное значение электродного потенциала определить невозможно. На практике измеряют разность потенциалов исследуемого электрода и некоторого стандартного
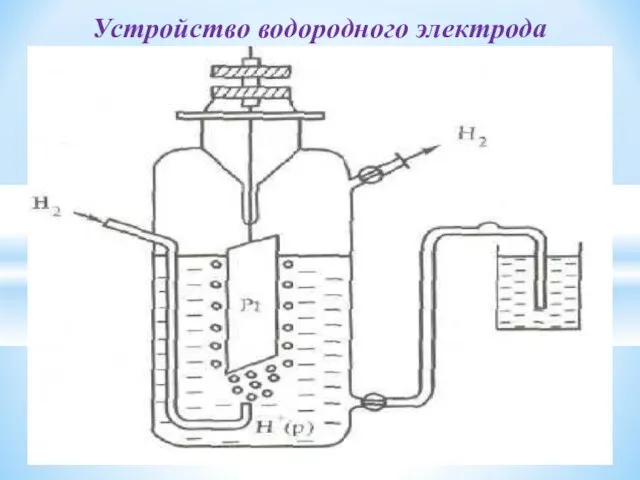
- 30. Устройство водородного электрода
- 31. Концентрационные элементы состоят из двух одинаковых электродов, помещенных в растворы с разной концентрацией соли С1 и
- 32. Все используемые электроды делят: 1) Электроды I рода, они обратимы относительно катионов. Это металлические электроды, опущенные
- 33. К электродам сравнения относят: 1) водородный электрод. 2) хлорсеребряный электрод. 3) каломельный электрод. Хлорсеребряный электрод состоит
- 34. Окислительно-восстановительные (редокс) электроды – такие полуэлементы, в которых материал электрода (Pt, Pd) в реакции не участвует,
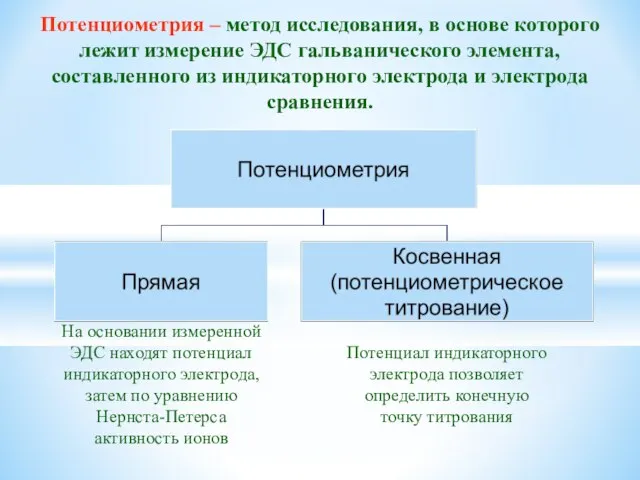
- 35. Потенциометрия – метод исследования, в основе которого лежит измерение ЭДС гальванического элемента, составленного из индикаторного электрода
- 36. Для определения рН раствора составляется гальванический элемент. Для 2Н+ + 2е ↔ Н2
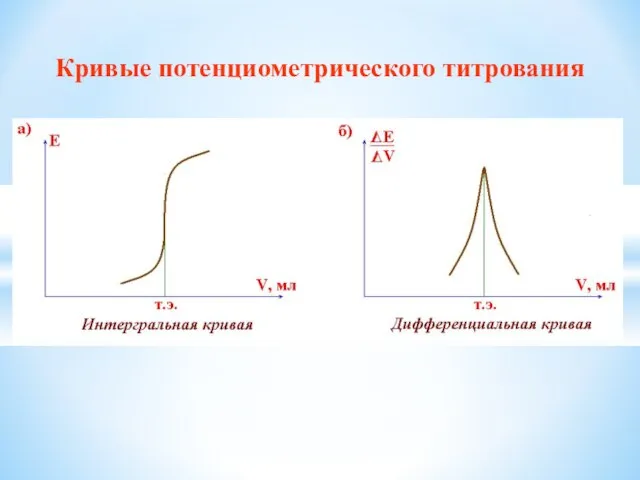
- 37. Кривые потенциометрического титрования
- 39. Скачать презентацию

![Электропроводность – способность вещества проводить электрический ток L = 1/R [ом-1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/501563/slide-3.jpg)
![Электропроводность Удельная χ = 1/ρ [ом-1⋅м-1] χ-каппа Молярная λ = 1000](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/501563/slide-4.jpg)

























 Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення 6 классов ферментов и тривиальные названия некоторых основных групп
6 классов ферментов и тривиальные названия некоторых основных групп Алюминий AL- химический элемент
Алюминий AL- химический элемент ХИМИЧЕСКИЕ ВЕЩЕСТВА И ОПАСНЫЕ ОБЪЕКТЫ.
ХИМИЧЕСКИЕ ВЕЩЕСТВА И ОПАСНЫЕ ОБЪЕКТЫ. Знання хімії в різні епохи
Знання хімії в різні епохи Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно
Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно Значення хімії у повсякденному житті Значення хімії у побуті
Значення хімії у повсякденному житті Значення хімії у побуті  Виды частиц в органической химии. Типы реакций
Виды частиц в органической химии. Типы реакций Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Презентация исследовательской работы на тему: «Витамин С и его значение» Ученика 8а класса Чипизубова Дениса ЖМСОШ№1
Презентация исследовательской работы на тему: «Витамин С и его значение» Ученика 8а класса Чипизубова Дениса ЖМСОШ№1 IIIB (d-элемент). Скандий
IIIB (d-элемент). Скандий Промышленная очистка воды
Промышленная очистка воды Oxygen, O2
Oxygen, O2 Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Молярный объём. Относительная плотность
Молярный объём. Относительная плотность Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Пленки Лэнгмюра - Блоджетт
Пленки Лэнгмюра - Блоджетт Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Поліетилен
Поліетилен Физические и химические явления. Химические реакции
Физические и химические явления. Химические реакции Исследовательская (проектная) работа Вулкан в домашних условиях
Исследовательская (проектная) работа Вулкан в домашних условиях Метаболизм белков и аминокислот
Метаболизм белков и аминокислот Работа студентки II курса Козловой Екатерины
Работа студентки II курса Козловой Екатерины  Предмет коллоидной химии. Общая характеристика дисперсных систем
Предмет коллоидной химии. Общая характеристика дисперсных систем «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс)