Химические свойства астата
Астат отличается упругостью паров, мало растворим в воде, лучше
растворяется в органических растворителях.
Астат в водном растворе восстанавливается диоксидом серы SO2, как и металлы, он осаждается даже из самых сильнокислых растворов сероводородом(H2S). Вытесняется из сернокислых растворов цинком.
Как и все галогены, астат образует нерастворимую соль Ag(5), она способна окисляться до состояния At(5), как и йод.
Астат реагирует с бромом и йодом, при этом образуются межгалогенные соединения – йодид астата и бромид астата.




 Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Хром және оның қосылыстары
Хром және оның қосылыстары Металл и ржавчина: взаимодействие и способы защиты
Металл и ржавчина: взаимодействие и способы защиты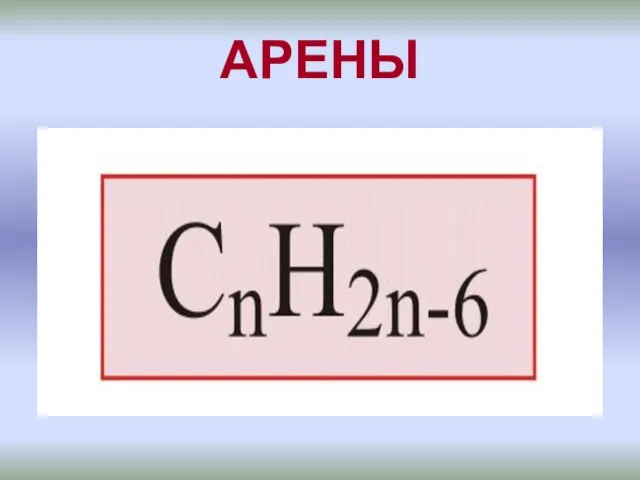 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Диссертация «Анализ и моделирование колебательно-вращательных спектров высокого разрешения молекулы двуокиси азота»
Диссертация «Анализ и моделирование колебательно-вращательных спектров высокого разрешения молекулы двуокиси азота» Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Аттестационная работа. Задачи на смеси и сплавы
Аттестационная работа. Задачи на смеси и сплавы Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений
Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений Сульфиды. Лекция 8
Сульфиды. Лекция 8 The alkali metals
The alkali metals Классификация химических реакций
Классификация химических реакций Оксиды углероды
Оксиды углероды Презентация по химии Применение кислорода
Презентация по химии Применение кислорода Дисперсные системы. Коллоидные растворы
Дисперсные системы. Коллоидные растворы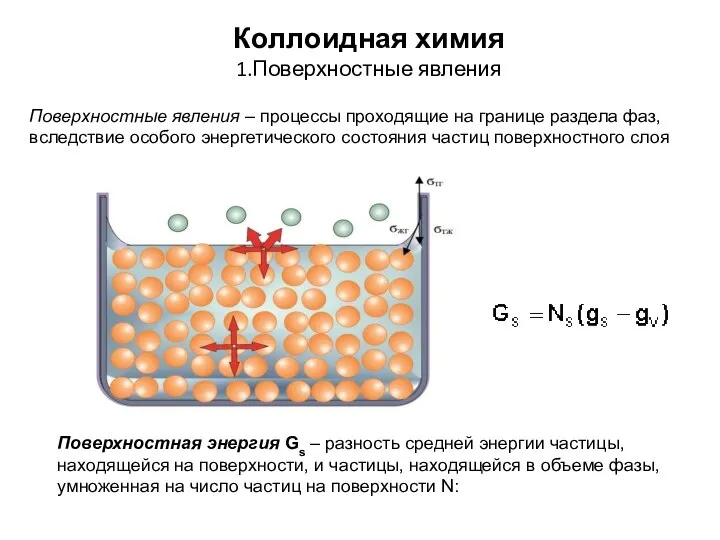 Коллоидная химия. Поверхностные явления
Коллоидная химия. Поверхностные явления Презентация по Химии "Степень окисления" - скачать смотреть
Презентация по Химии "Степень окисления" - скачать смотреть  Состав, строение, классификация кислот
Состав, строение, классификация кислот Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу
Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу Пральні порошки. Мила
Пральні порошки. Мила  Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов
Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов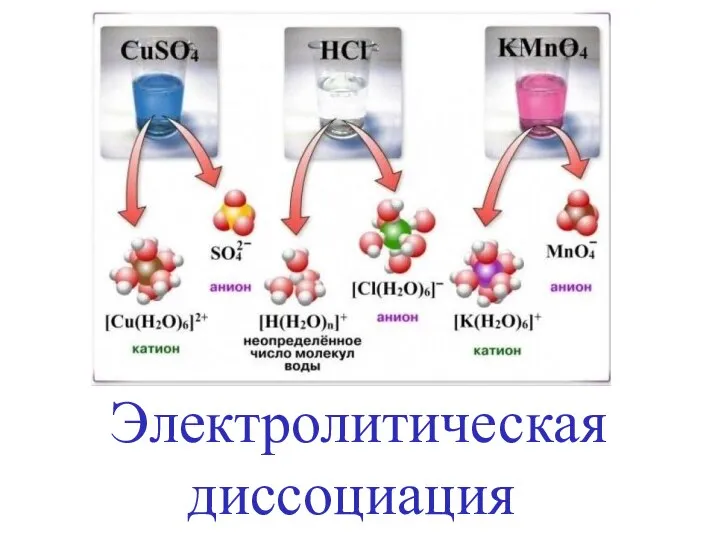 Электролитическая диссоциация
Электролитическая диссоциация Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Окислительно-восстановительные реакции с участием органических веществ
Окислительно-восстановительные реакции с участием органических веществ Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда Елементи VІ групи головної підгрупи
Елементи VІ групи головної підгрупи Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся