Содержание
- 2. Девиз урока «Смысл нельзя дать, его нужно найти» Виктор Франкл
- 3. Кто был этот ученый? Он родился в 1859 году в старинном шведском городе Упсале. В гимназии
- 4. История возникновения теории электролитической диссоциации связана с именем шведского физико-химика Аррениуса. Он был разносторонним ученым: его
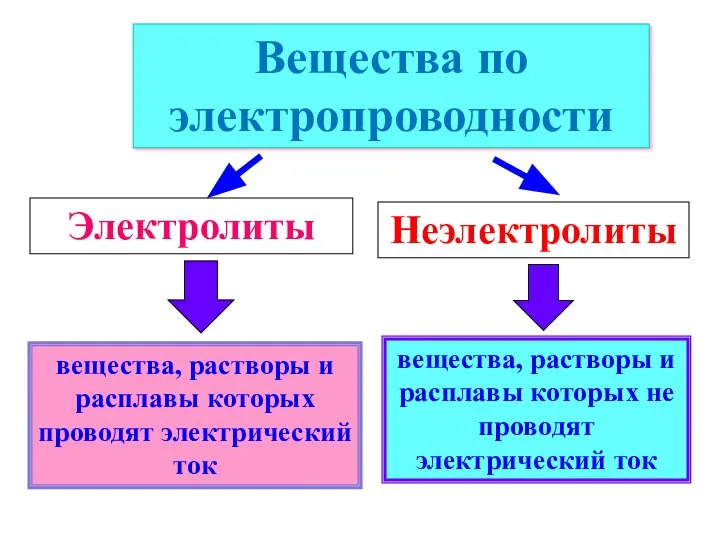
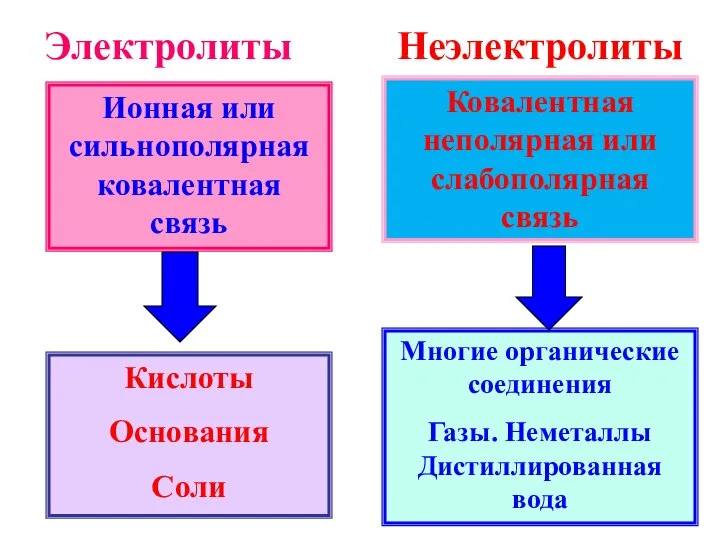
- 5. вещества, растворы и расплавы которых проводят электрический ток Вещества по электропроводности Электролиты Неэлектролиты вещества, растворы и
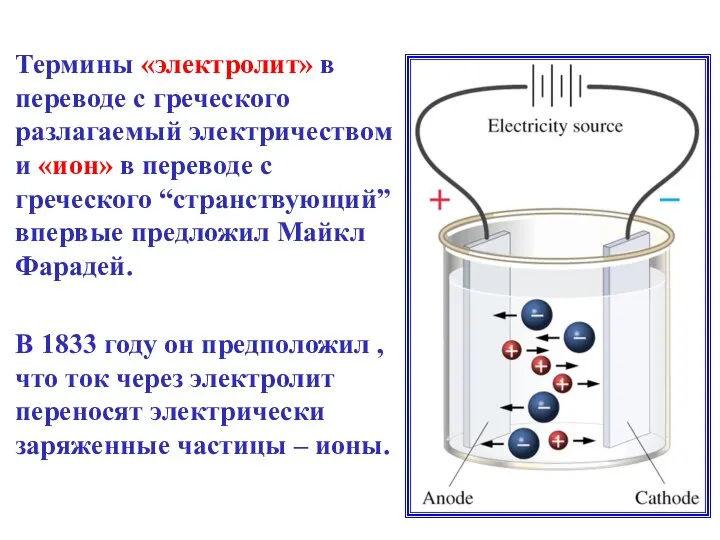
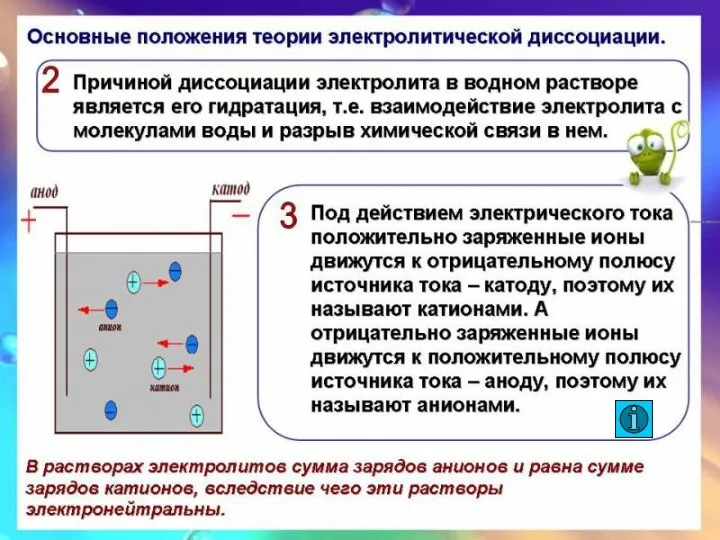
- 6. Термины «электролит» в переводе с греческого разлагаемый электричеством и «ион» в переводе с греческого “странствующий” впервые
- 7. Аррениус занимался изучением электропроводности сильно разбавленных водных растворов. В мае 1883 года после длительной экспериментальной проверки
- 8. Причины электролитической диссоциации Сторонники физической теории растворов (Вант-Гофф, Аррениус и Освальд) считали, что процесс растворения -
- 9. Причины электролитической диссоциации И.А. Каблуков и В.А. Кистяковский применили химическую теорию Д.И. Менделеева и доказали что
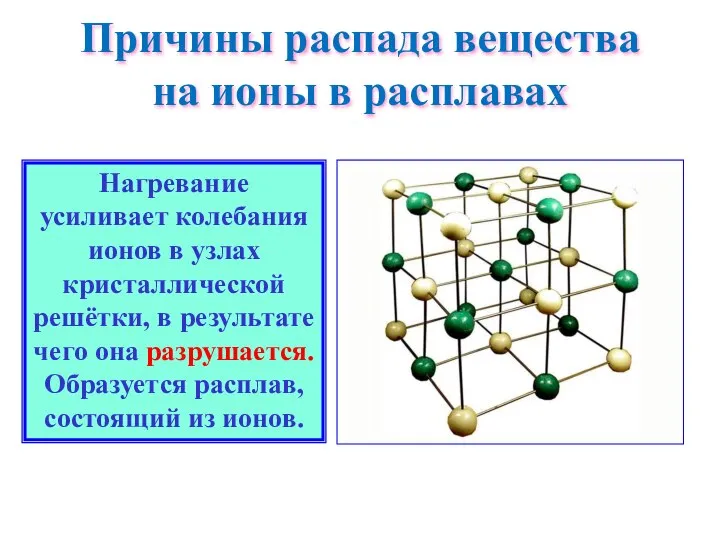
- 10. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки, в
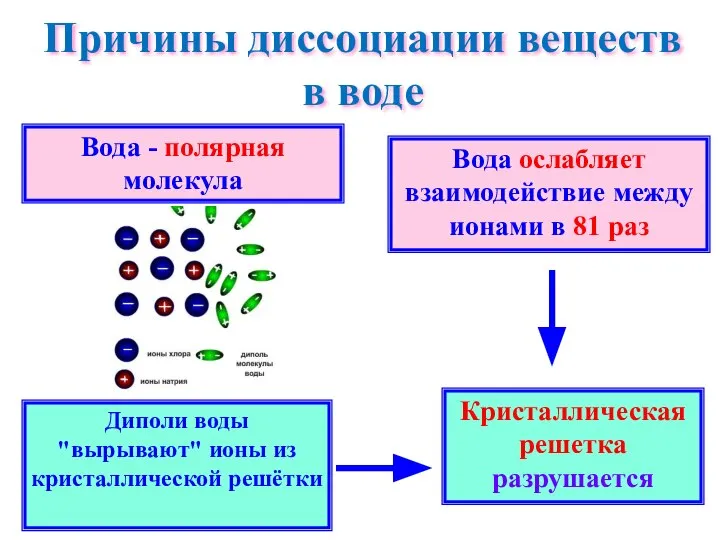
- 11. Причины диссоциации веществ в воде Вода - полярная молекула Вода ослабляет взаимодействие между ионами в 81
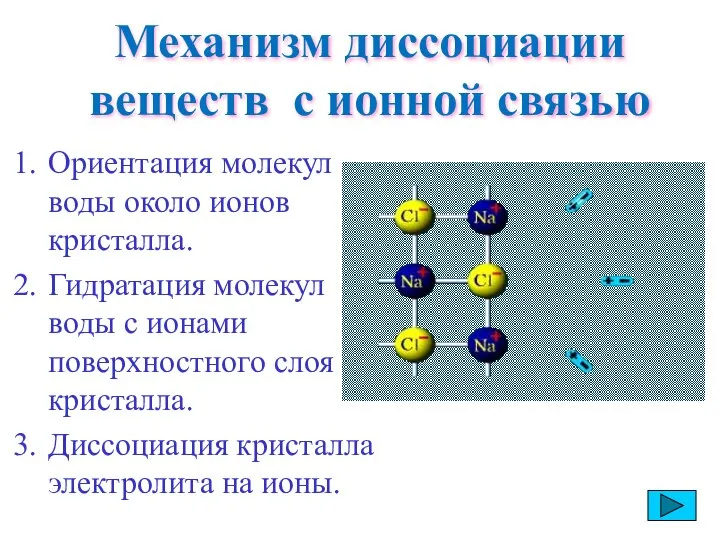
- 12. Механизм диссоциации веществ с ионной связью Ориентация молекул воды около ионов кристалла. Гидратация молекул воды с
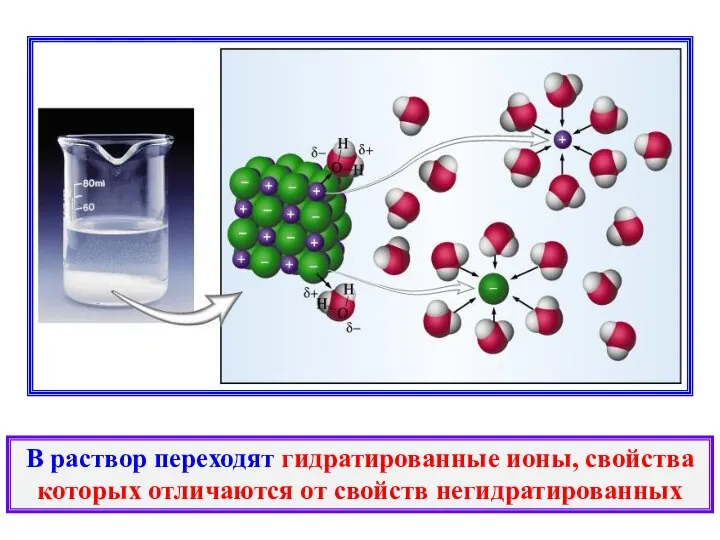
- 13. В раствор переходят гидратированные ионы, свойства которых отличаются от свойств негидратированных
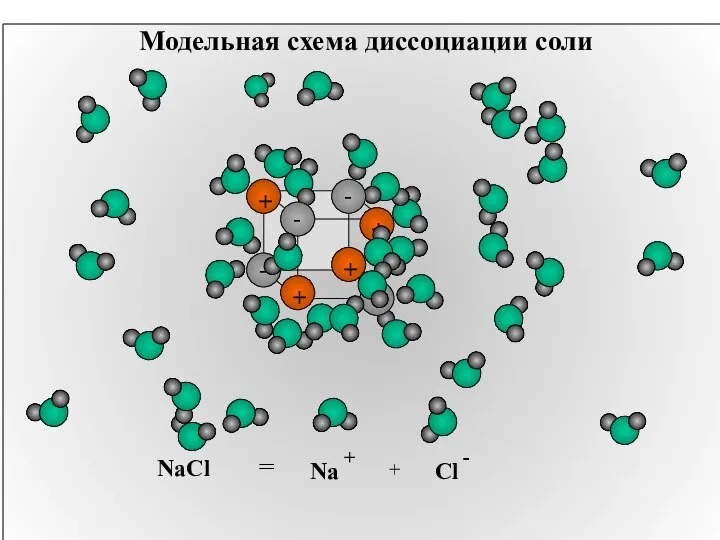
- 14. Модельная схема диссоциации соли NaCl = + Na +
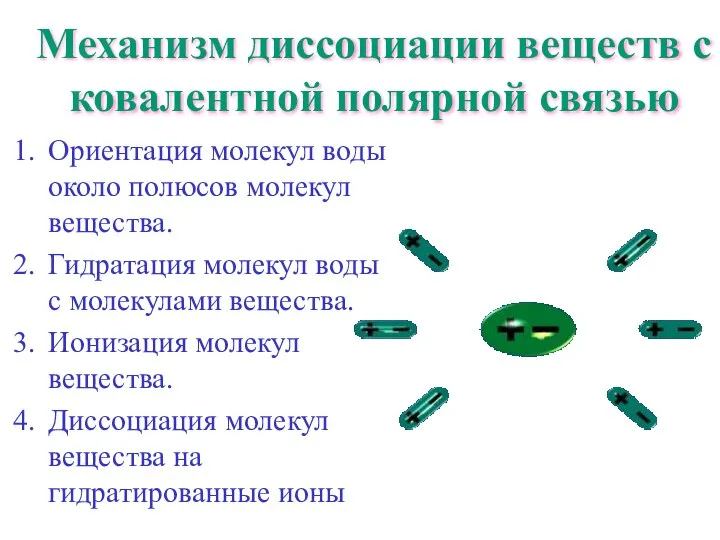
- 15. Механизм диссоциации веществ с ковалентной полярной связью Ориентация молекул воды около полюсов молекул вещества. Гидратация молекул
- 16. Ионная или сильнополярная ковалентная связь Кислоты Основания Соли Ковалентная неполярная или слабополярная связь Многие органические соединения
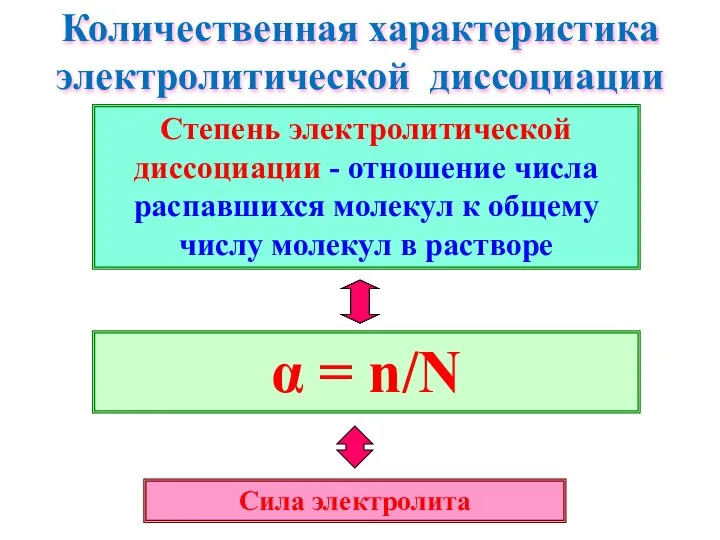
- 20. Количественная характеристика электролитической диссоциации α = n/N Сила электролита Степень электролитической диссоциации - отношение числа распавшихся
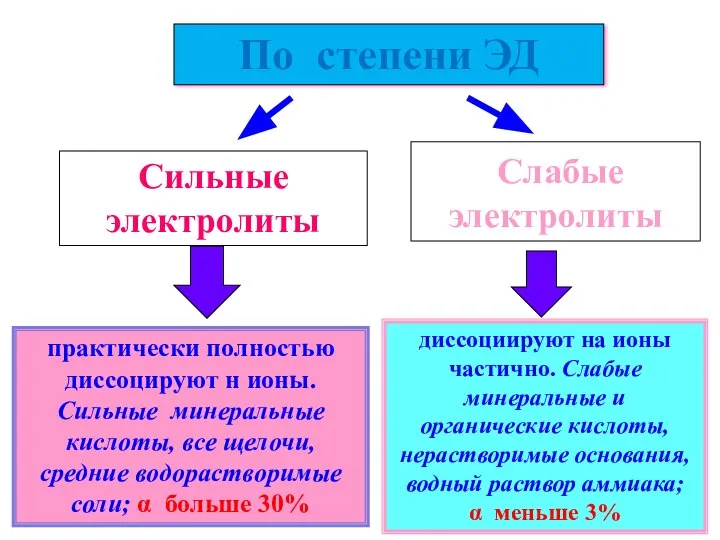
- 21. практически полностью диссоцируют н ионы. Сильные минеральные кислоты, все щелочи, средние водорастворимые соли; α больше 30%
- 22. Основные положения ТЭД Электролитическая диссоциация для слабых электролитов – процесс обратимый. Обратный процесс – ассоциация. Не
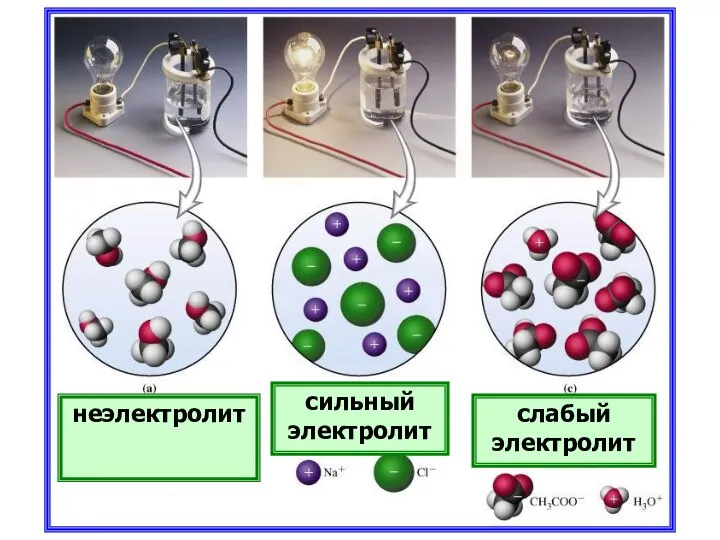
- 23. неэлектролит сильный электролит слабый электролит
- 27. Значение теории электролитической диссоциации ТЭД позволила объяснить свойства водных растворов электролитов и объяснила теорию кислот и
- 28. Значение теории электролитической диссоциации Обосновала механизм многих органических реакций и помогла физиологам в изучении состава и
- 29. Выводы ТЭД была предложена в 1887 году шведским ученым Сванте Августом Аррениусом. Классическая теория электролитический диссоциации
- 31. Скачать презентацию















 Ксантановая камедь
Ксантановая камедь Неметаллы VIА-подгруппы
Неметаллы VIА-подгруппы НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю
НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю  Презентация по химии Хлороводород. Соляная кислота.
Презентация по химии Хлороводород. Соляная кислота.  Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах Роль химии в современной цивилизации
Роль химии в современной цивилизации Растворы
Растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Композиционные материалы
Композиционные материалы Строение и свойства неорганических веществ. Кислоты и основания
Строение и свойства неорганических веществ. Кислоты и основания Химия и современный быт человека
Химия и современный быт человека Органическая химия. Фенолы
Органическая химия. Фенолы Валентность. Составление химических формул по валентности
Валентность. Составление химических формул по валентности Гиббс теңдеуі бойынша сұйықтық газ шекарасындағы адсорбциондық тепе-теңдік. Гельмгольц және Гибсс. Дәріс 4
Гиббс теңдеуі бойынша сұйықтық газ шекарасындағы адсорбциондық тепе-теңдік. Гельмгольц және Гибсс. Дәріс 4 Электролиз
Электролиз Угольная кислота H2CO3
Угольная кислота H2CO3 Органика из аптеки
Органика из аптеки Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Презентация по Химии "«Основные химические понятия»" - скачать смотреть
Презентация по Химии "«Основные химические понятия»" - скачать смотреть  Обобщение и систематизация знаний по теме «Химическая связь и строение атома»
Обобщение и систематизация знаний по теме «Химическая связь и строение атома» Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Көмірсулар
Көмірсулар Минералы соединения ртути
Минералы соединения ртути