Содержание
- 2. В органической химии окисление определяют как процесс, при котором в результате превращения функциональной группы соединение переходит
- 3. ОКИСЛИТЕЛИ Для окисления органических веществ обычно используют соединения переходных металлов, кислород, озон, пероксиды и соединения серы,
- 4. ОКИСЛИТЕЛИ При окислении органических веществ хром (VI) в любой среде восстанавливается до хрома (III), однако, окисление
- 5. АЛКЕНЫ В зависимости от природы окислителя и условий реакции образуются различные продукты: двухатомные спирты, альдегиды, кетоны,
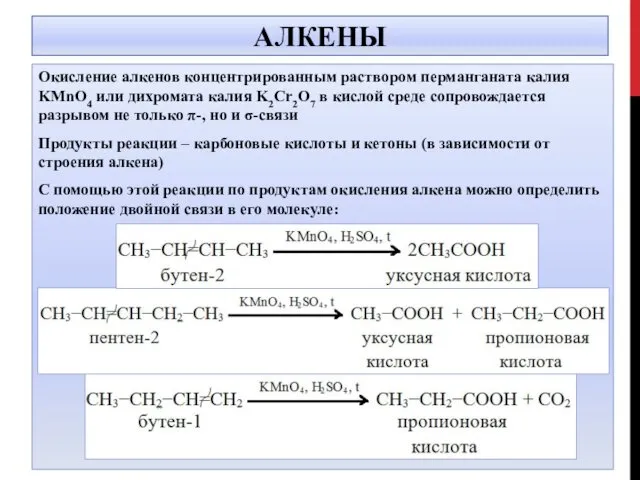
- 6. АЛКЕНЫ Окисление алкенов концентрированным раствором перманганата калия KMnO4 или дихромата калия K2Cr2O7 в кислой среде сопровождается
- 7. АЛКЕНЫ 5СН3 –СН=СН-СН3 +8KMnO4 +12H2SO4 → 10 CH3COOH +8MnSO4+4K2SO4+12H2O 5СН3 –СН=СН-CH2-СН3 +8KMnO4 +12H2SO4 → 5CH3COOH +5CH3CH2COOH
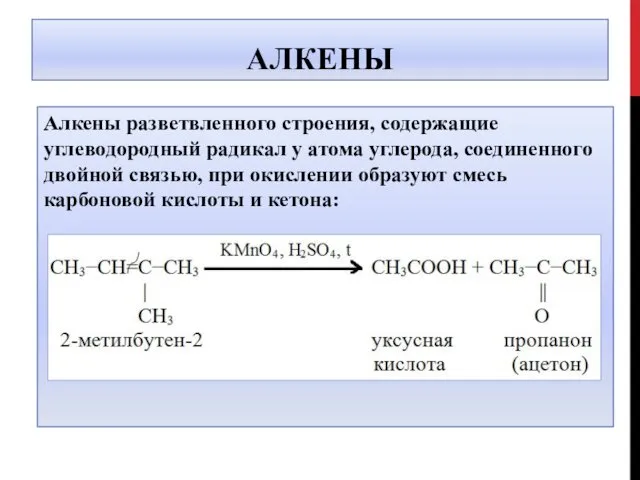
- 8. АЛКЕНЫ Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют
- 9. АЛКЕНЫ 5CH3-CH=C-CH3 + 6 KMnO4 +9H2SO4 → │ CH3 5 CH3COOH + 5O=C-CH3 + 6MnSO4 +
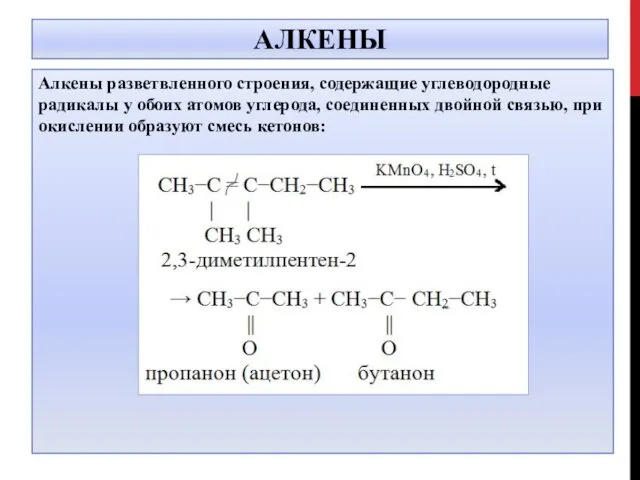
- 10. АЛКЕНЫ Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении
- 11. АЛКЕНЫ 5CH3-C=C-CH3 + 4KMnO4 +6H2SO4 → │ │ CH3CH3 10O=C-CH3 + 4MnSO4 + 2K2SO4+6H2O │ CH3
- 12. АЛКЕНЫ В результате каталитического окисления алкенов кислородом воздуха получают эпоксиды: В жестких условиях при сжигании на
- 13. АЛКАДИЕНЫ CH2=CH−CH=CH2 В окисляемой молекуле две концевых двойных связи, следовательно, образуются две молекулы углекислого газа. Углеродный
- 14. АЛКИНЫ Алкины легко окисляются перманганатом калия и дихроматом калия по месту кратной связи При действии на
- 15. АЛКИНЫ Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия: 3CH≡CH +8KMnO4→3KOOC –
- 16. АЛКИНЫ Окисление перманганатам калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной
- 17. АЛКИНЫ CH3C≡CCH2CH3 + K2Cr2O7 + 4H2SO4→CH3COOH+CH3CH2COOH + Cr2(SO4)3+K2SO4+3H2O 3CH3C≡CH+4 K2Cr2O7 +16 H2SO4 →CH3COOH+3CO2++ 4Cr2(SO4)3 + 4K2SO4
- 18. ЦИКЛОАЛКАНЫ И ЦИКЛОАЛКЕНЫ При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) циклоалканы и циклоалкены образуют двухосновные
- 19. АРЕНЫ Бензол Устойчив к окислителям при комнатной температуре Не реагирует с водными растворами перманганата калия, дихромата
- 20. АРЕНЫ Гомологи бензола Окисляются относительно легко. Окислению подвергается боковая цепь, у толуола – метильная группа. Мягкие
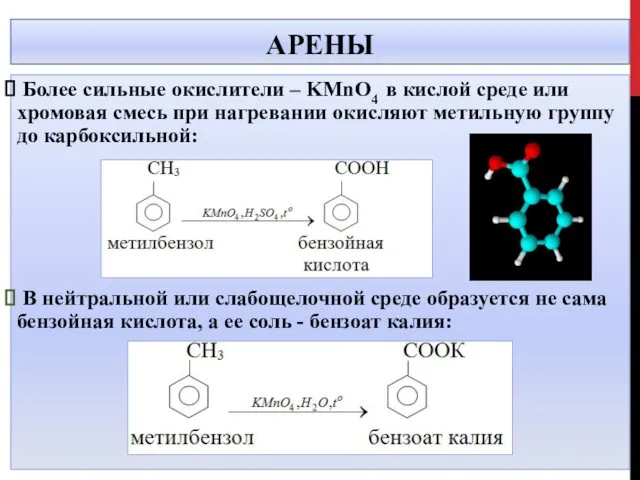
- 21. АРЕНЫ Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную
- 22. АРЕНЫ В кислой среде 5С6Н5СН3+6КMnO4+9 H2SO4→5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O В нейтральной среде C6H5CH3 +2KMnO4 = C6H5COOK
- 23. АРЕНЫ Под действием сильных окислителей (KMnO4 в кислой среде или хромовая смесь) боковые цепи окисляются независимо
- 24. АРЕНЫ Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
- 25. АРЕНЫ В нейтральной или слабощелочной среде при окислении перманганатом калия образуются соль карбоновой кислоты и карбонат
- 26. АРЕНЫ 5 C6H5-C2H5 + 12 KMnO4 + 18 H2SO4 -> 5 C6H5-COOH + 5 CO2 +
- 27. СТИРОЛ Окисление стирола (винилбензола) раствором перманганата калия в кислой и нейтральной среде: 3 C6H5−CH═CH2 + 2
- 28. СПИРТЫ Наиболее подходящие окислители для первичных и вторичных спиртов: KMnO4, хромовая смесь. Первичные спирты, кроме метанола,
- 29. СПИРТЫ Метанол окисляется до СО2: Этанол под действием Cl2 окисляется до уксусного альдегида: Вторичные спирты окисляются
- 30. СПИРТЫ Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко
- 31. ФЕНОЛЫ Окисляются легко благодаря наличию гидроксогруппы, соединенной с бензольным кольцом Фенол окисляется пероксидом водорода в присутствии
- 32. АЛЬДЕГИДЫ И КЕТОНЫ Альдегиды окисляются легко, при этом альдегидная группа окисляется до карбоксильной: 3CH3СHO + 2KMnO4
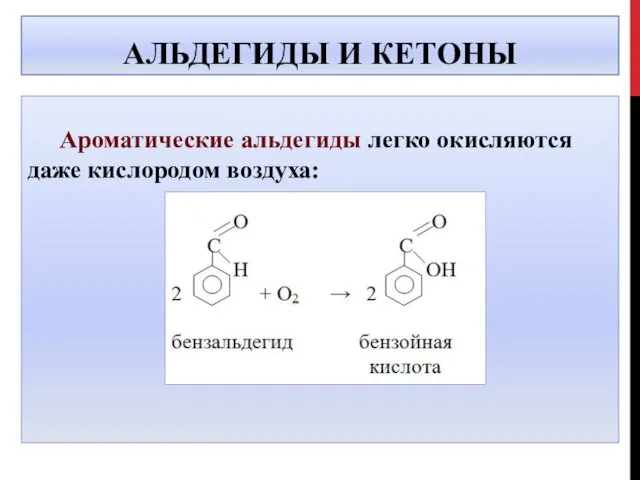
- 33. АЛЬДЕГИДЫ И КЕТОНЫ Ароматические альдегиды легко окисляются даже кислородом воздуха:
- 34. АЛЬДЕГИДЫ И КЕТОНЫ Качественные реакции на альдегиды: окисление гидроксидом меди(II) реакция «серебряного зеркала» Соль, а не
- 35. АЛЬДЕГИДЫ И КЕТОНЫ Кетоны окисляются с трудом, слабые окислители на них не действуют Под действием сильных
- 36. АЛЬДЕГИДЫ И КЕТОНЫ В случае несимметричного строения кетона окисление преимущественно осуществляется со стороны менее гидрированного атома
- 37. МУРАВЬИНАЯ КИСЛОТА Среди предельных одноосновных кислот легко окисляется только муравьиная кислота. Это связано с тем, что
- 38. НЕПРЕДЕЛЬНЫЕ КАРБОНОВЫЕ КИСЛОТЫ Легко окисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их
- 39. ЩАВЕЛЕВАЯ КИСЛОТА Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии):
- 41. Скачать презентацию





























 Полимеры, пластмассы и волокна
Полимеры, пластмассы и волокна Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Химический элементы в нашей жизни
Химический элементы в нашей жизни Застосуваня електролізу
Застосуваня електролізу Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов
Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов Конструкция ферментатора
Конструкция ферментатора Презентация по Химии "Кто хочет стать отличником" - скачать смотреть
Презентация по Химии "Кто хочет стать отличником" - скачать смотреть  Химическая термодинамика
Химическая термодинамика Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет
Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет Основания. Zn(OH)2 гидроксид цинка
Основания. Zn(OH)2 гидроксид цинка Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Биохимия углеводов
Биохимия углеводов Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений
Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений Аммиак
Аммиак Фармацевтические эмульсии
Фармацевтические эмульсии Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ  Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД Кислоты
Кислоты Металлическая связь
Металлическая связь Природный газ
Природный газ Ферменттер – тіршілік негізі
Ферменттер – тіршілік негізі Возможные роли АФК в старении
Возможные роли АФК в старении Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут)
Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут) студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Водородный электрод
Водородный электрод