Содержание
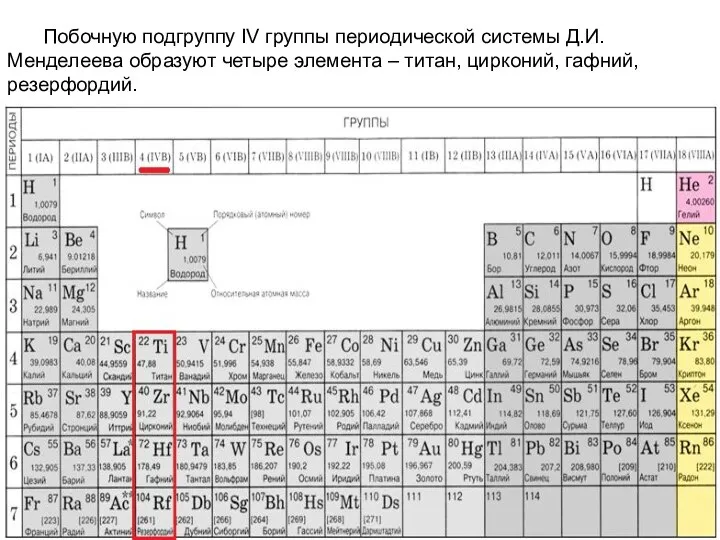
- 2. Побочную подгруппу IV группы периодической системы Д.И. Менделеева образуют четыре элемента – титан, цирконий, гафний, резерфордий.
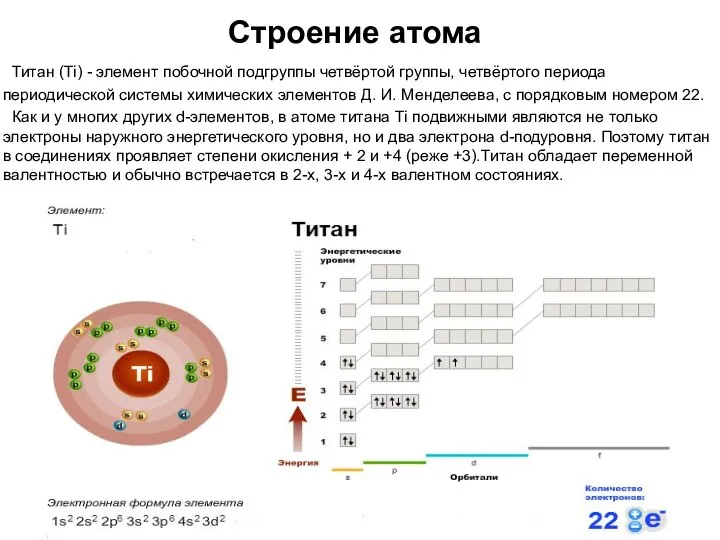
- 3. Строение атома Титан (Ti) - элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов
- 4. Нахождение в природе Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре
- 5. Нахождение в природе Важнейшими минералами, содержащими титан, являются: титаномагнетиты FeTiO3 *nFe3O4, ильменит FeTiO3, рутил TiO2. Титановые
- 6. Физические свойства Титан серебристо - белый металл. Сравнительно легкий, немного тяжелее алюминия, но примерно в три
- 7. Химические свойства Благодаря образованию на поверхности металла плотной защитной оксидной пленки он обладает исключительно высокой стойкостью
- 8. Химические свойства При нагревании на воздухе до 1200 °C Ti загорается ярким белым пламенем с образованием
- 9. Получение Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно
- 10. Получение Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана
- 11. Получение TiO2 + 2C + 2Cl2 = TiCl4 + 2CO Образующиеся пары TiCl4 при 850 °C
- 12. Получение Полученную титановую «губку» переплавляют и очищают. Рафинируют титан йодидным способом или электролизом, выделяя Ti из
- 13. Применение Титан и его сплавы в связи с их легкостью, прочностью, термической и коррозионной стойкостью применяются
- 14. Применение Титан, как и тантал, не действует на живые ткани организма, поэтому он применяется в хирургии
- 16. Скачать презентацию











 Мұнайлардың жіктелуі
Мұнайлардың жіктелуі Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Синтез полимерных комплексонов на основе аминокислот
Синтез полимерных комплексонов на основе аминокислот Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010
Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010 Деление ядер урана
Деление ядер урана  Физические и химические явления
Физические и химические явления Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов
Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов Отношение масс элементов в веществе. Массовые доли элементов в веществе
Отношение масс элементов в веществе. Массовые доли элементов в веществе Витамины и коферменты
Витамины и коферменты Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Алкены
Алкены Моносахариды
Моносахариды Предмет химии. Вещества
Предмет химии. Вещества Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования
Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования Метод изолирования Васильевой
Метод изолирования Васильевой Галогены
Галогены Хімія в побуті
Хімія в побуті Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.
Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.  Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Використання вуглеводнів
Використання вуглеводнів Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Алканы: изомерия и номенклатура
Алканы: изомерия и номенклатура Презентация по Химии "Закон збереження маси" - скачать смотреть
Презентация по Химии "Закон збереження маси" - скачать смотреть