Содержание
- 2. Строение и свойства атомов …nS2nP4 -строение внешнего энергетического уровня Количество электронов на внешнем энергетическом уровне постоянно
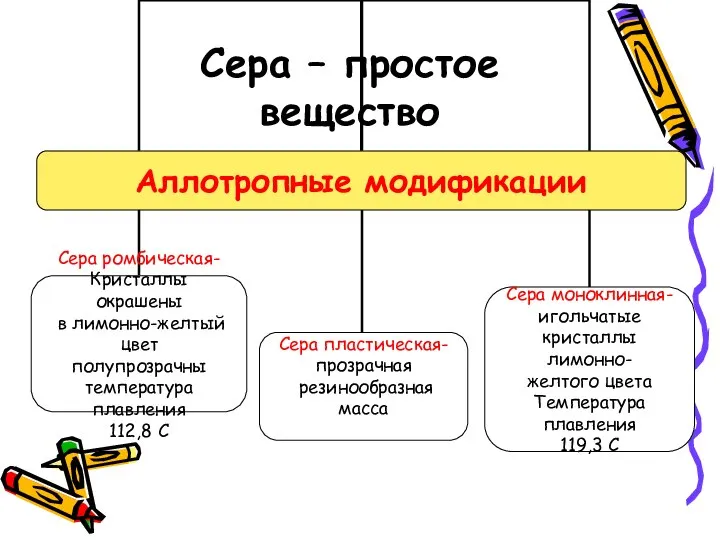
- 3. Сера – простое вещество
- 4. Химические свойства Сера проявляет окислительные свойства при взаимодействии с металлами и водородом, а также с менее
- 5. Окислительные свойства серы При обычных условиях сера взаимодействует со всеми щелочными и щелочно-земельными металлами, медью, ртутью,
- 6. Восстановительные свойства серы При взаимодействии с простыми веществами S + O2 = SO2 При взаимодействии со
- 7. Сера в природе Самородная (S0) Сульфидная (S2-) FeS2. ZnS. PbS Сульфатная (SO42-) гипс, глауберова соль Выдающийся
- 8. Применение серы Сера применялась в Древнем Египте уже за тысячи лет до н.э. для приготовления красок,
- 9. Соединения серы Сероводород и сульфиды Оксид серы (IV), сернистая кислота, ее соли (сульфиты) Оксид серы (VI),
- 10. Сероводород и сульфиды H2S –бесцветный газ с резким запахом, очень ядовит, однако в небольших дозах проявляет
- 11. Оксид серы (IV) SO2 – бесцветный газ с характерным резким запахом, проявляет типичные свойства кислотных оксидов,
- 12. Оксид серы (VI) Оксид серы (VI) SО3 - ангидрид серной кислоты - бесцветная жидкость SО3 получают
- 13. Серная кислота Н2SO4 - сильная двухосновная кислота. В воде она диссоциирует ступенчато, образуя гидросульфат- и сульфат-
- 14. Серная кислота концентрированная сильно по свойствам отличается от разбавленной: при взаимодействии с металлами H2 не выделяется,
- 15. Разбавление серной кислоты При разбавлении серной кислоты необходимо кислоту очень медленно вливать в воду, тщательно перемешивая
- 17. Скачать презентацию













 Тяжелые р – элементы -полуметаллы
Тяжелые р – элементы -полуметаллы Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования
Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно
Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно Фармацевтическая разработка липосомального крема с экстрактами лопуха войлочного и крапивы двудомной для укрепления волос
Фармацевтическая разработка липосомального крема с экстрактами лопуха войлочного и крапивы двудомной для укрепления волос Методы упрочнения металлических сплавов. Тема 2.3
Методы упрочнения металлических сплавов. Тема 2.3 Химиялық ыдыстар
Химиялық ыдыстар Химия и биохимия игристых вин
Химия и биохимия игристых вин Растворение, растворимость веществ в воде
Растворение, растворимость веществ в воде Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Получение солей. Лекция №13. Подготовка к ЕГЭ
Получение солей. Лекция №13. Подготовка к ЕГЭ Физико-химия поверхностных явлений. Основы адсорбционной терапии
Физико-химия поверхностных явлений. Основы адсорбционной терапии Елементарний склад живих організмів
Елементарний склад живих організмів Фиды специфичности ферментов. Субстратная специфичность
Фиды специфичности ферментов. Субстратная специфичность Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение
Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение Горение водорода
Горение водорода Увеличение плотности дислокаций
Увеличение плотности дислокаций БИОГЕННАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Работу выполнила: ученица 11 класса « Б » средней школы №8
БИОГЕННАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Работу выполнила: ученица 11 класса « Б » средней школы №8  Презентация по Химии "Вещества, входящие в состав живых организмов" - скачать смотреть бесплатно
Презентация по Химии "Вещества, входящие в состав живых организмов" - скачать смотреть бесплатно Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Применение композиционных угольно-цеолитных адсорбентов для очистки промышленных сточных вод
Применение композиционных угольно-цеолитных адсорбентов для очистки промышленных сточных вод Кислоты, их состав и название. Цель урока: 1. Сформировать понятия о кислотах. 2. Рассмотреть состав, название и классификацию ки
Кислоты, их состав и название. Цель урока: 1. Сформировать понятия о кислотах. 2. Рассмотреть состав, название и классификацию ки Татьяна Леонидовна Быкова, учитель химии, Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школ
Татьяна Леонидовна Быкова, учитель химии, Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школ Презентация по Химии "Периодический закон и Периодическая система химических элементов Д.И.Менделеева" - скачать смотреть
Презентация по Химии "Периодический закон и Периодическая система химических элементов Д.И.Менделеева" - скачать смотреть  Презентация по Химии "Оксиды получение, свойства, применение" - скачать смотреть бесплатно
Презентация по Химии "Оксиды получение, свойства, применение" - скачать смотреть бесплатно Электролиз
Электролиз  Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Ароматические углеводороды. (Лекция 7)
Ароматические углеводороды. (Лекция 7)