Содержание
- 2. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ - явления, связанные с существованием межфазных границ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ ИЗУЧАЮТСЯ КОЛЛОИДНОЙ ХИМИЕЙ
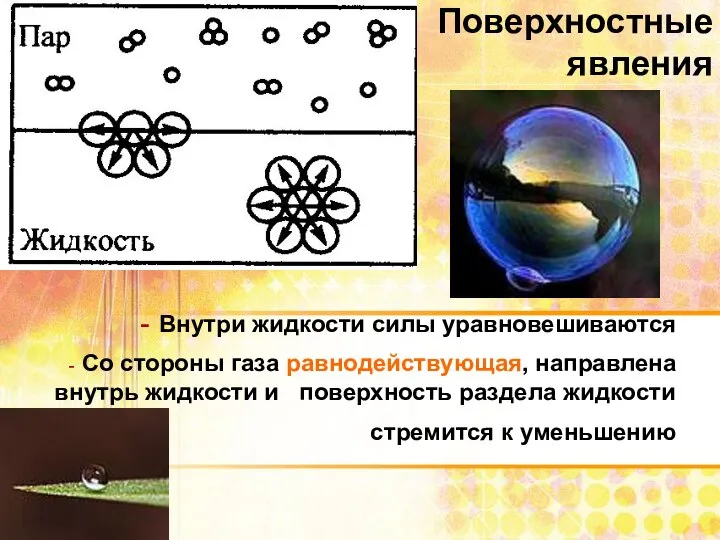
- 3. Поверхностные явления Внутри жидкости силы уравновешиваются Со стороны газа равнодействующая, направлена внутрь жидкости и поверхность раздела
- 4. Поверхностные явления Увеличение площади поверхности раздела фаз связано с переходом молекул из глубины фазы на поверхность.
- 5. Поверхностное натяжение σ — это работа, необходимая для создания 1 м2 поверхности [σ]= Дж/м2 Поверхностное натяжение
- 6. Поверхностное натяжение Поверхностное натяжение зависит от: природы жидкости σ(Н2О)=72,8 Дж/м2; σ(сыворотки крови)=45,4 Дж/м2). температуры (↑t ↓σ
- 7. СОРБЦИЯ
- 8. Медико-биологическое значение темы: 1. Усвоение питательных и лекарственных веществ 2. Перенос О2 и СО2 из лёгких
- 9. Сорбция-изменение концентрации одного или нескольких компонентов в гетерогенной системе Сорбция – процесс поглощения одного вещества другим
- 10. Адсорбция Адсорбция – самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с объемом фазы
- 11. Уравнение Гиббса Г - количество адсорбированного вещества [моль/м2] а – равновесная активность вещества в объеме раствора
- 12. Поверхностная активность Способность растворенного вещества изменять поверхностное натяжение – поверхностная активность (g) Мера поверхностной активности:
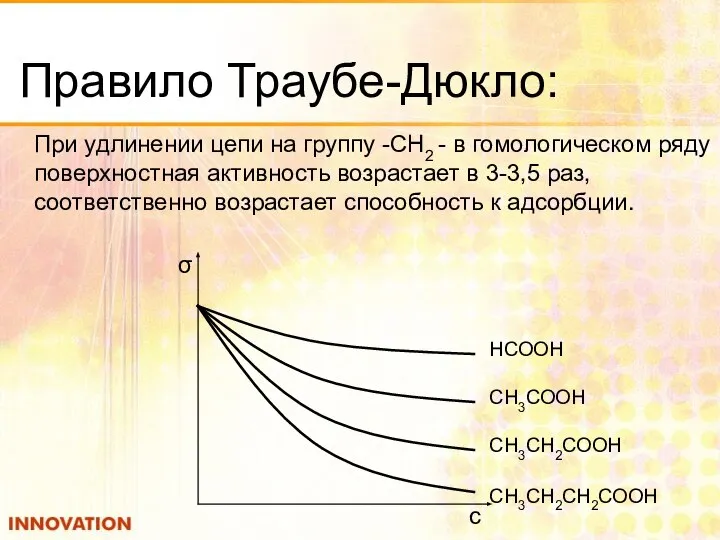
- 13. Правило Траубе-Дюкло: При удлинении цепи на группу -СН2 - в гомологическом ряду поверхностная активность возрастает в
- 14. ПАВ, ПИВ, ПНВ Поверхностно-активные вещества (ПАВ): уменьшают σ растворителя. σ раствора О. ПАВ: спирты, органические кислоты,
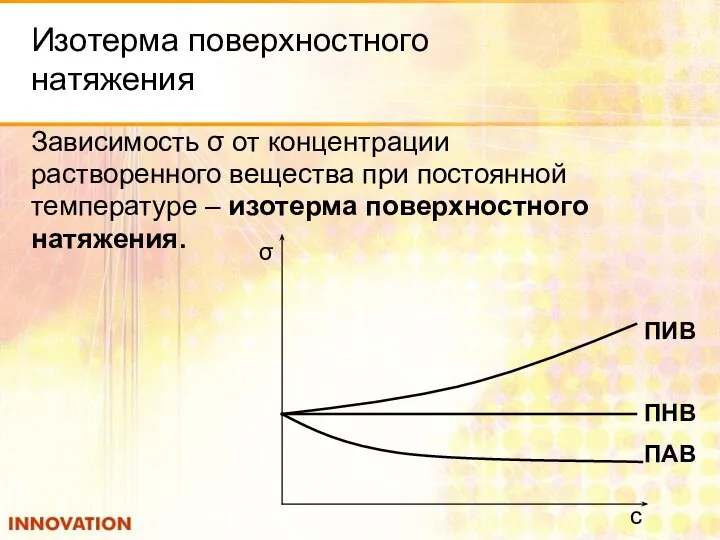
- 15. Изотерма поверхностного натяжения Зависимость σ от концентрации растворенного вещества при постоянной температуре – изотерма поверхностного натяжения.
- 16. Строение молекулы ПАВ: Молекула ПАВ состоит из: неполярной гидрофобной углеводородной группы (“хвост”) полярной гидрофильной группы (“голова”):
- 17. АДСОРБЦИЯ НА ГРАНИЦЕ РАСТВОР-ГАЗ
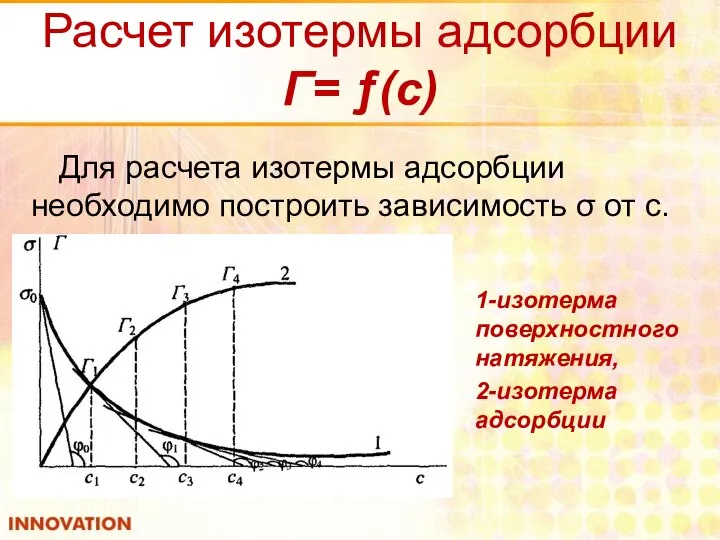
- 18. Расчет изотермы адсорбции Г= ƒ(с) Для расчета изотермы адсорбции необходимо построить зависимость σ от с. 1-изотерма
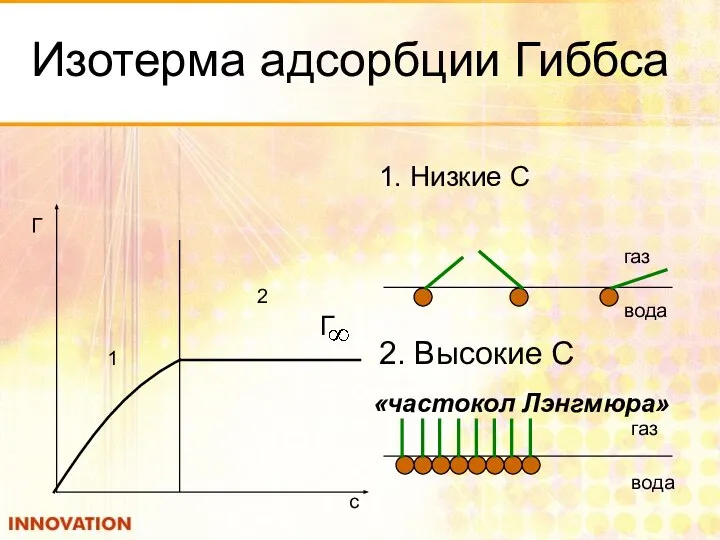
- 19. Изотерма адсорбции Гиббса 1. Низкие С 1 2 Г c газ вода 2. Высокие С газ
- 20. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО-ГАЗ
- 21. Адсорбция твердыми телами Величина адсорбции зависит от: Размера поверхности адсорбента чем > Sповерхности, тем > адсорбция.
- 22. Уравнение Фрейндлиха А = x/m = k · p1/n Г = x/m = КФ · Cn
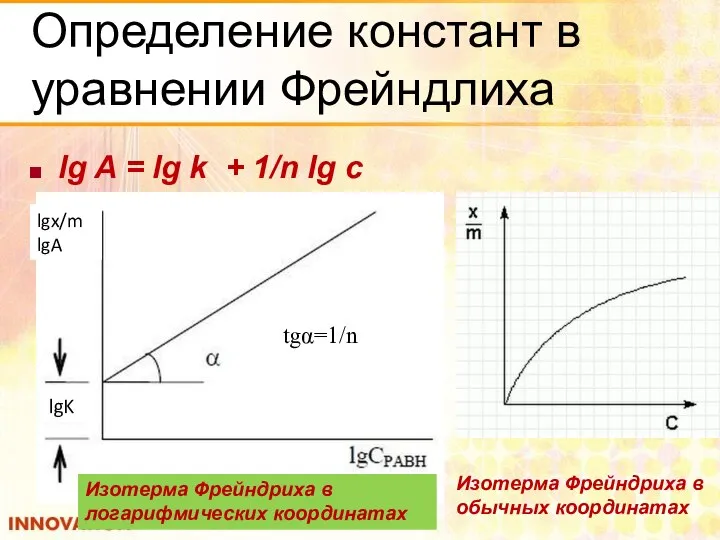
- 23. Определение констант в уравнении Фрейндлиха lg A = lg k + 1/n lg c lgx/m lgA
- 24. Теория Ленгмюра 1) На каждом абсорбционном месте на поверхности адсорбента может находиться только одна молекула или
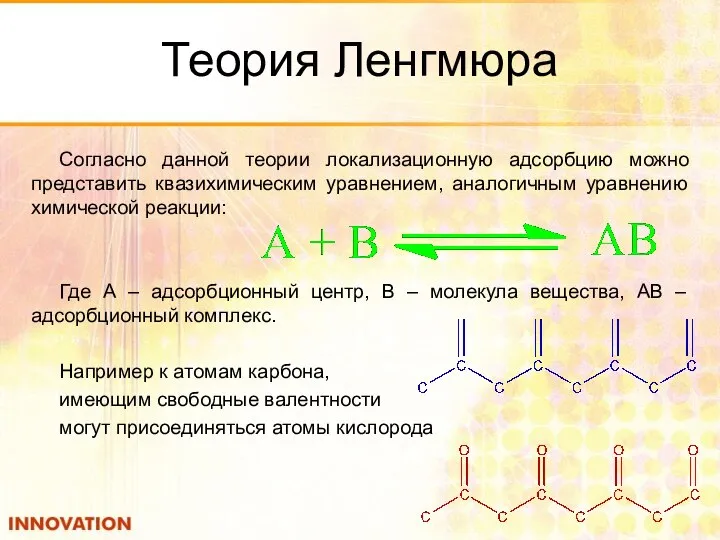
- 25. Теория Ленгмюра Согласно данной теории локализационную адсорбцию можно представить квазихимическим уравнением, аналогичным уравнению химической реакции: Где
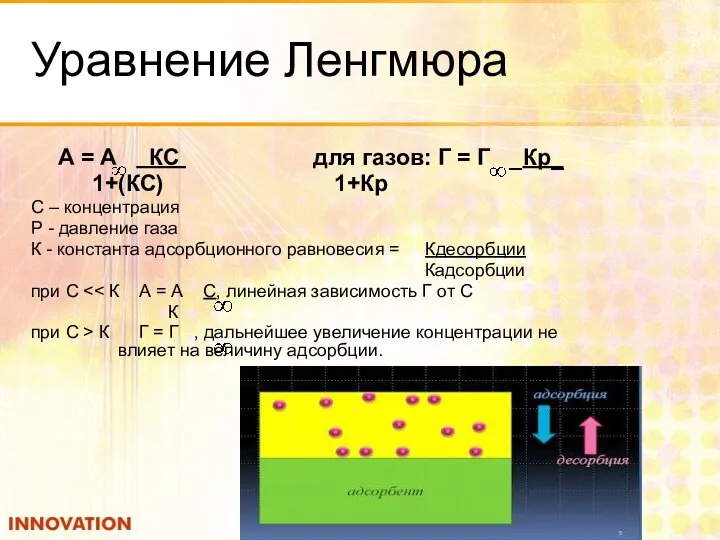
- 26. Уравнение Ленгмюра А = А КС для газов: Г = Г _Кр_ 1+(КС) 1+Кр С –
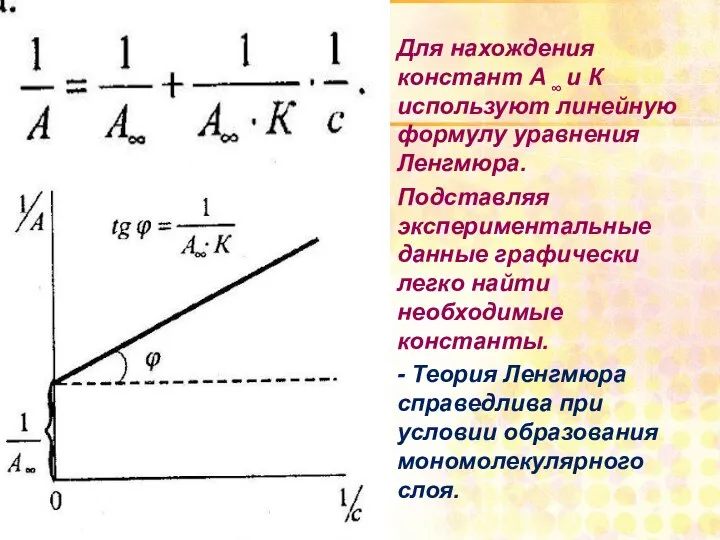
- 27. Для нахождения констант А ∞ и К используют линейную формулу уравнения Ленгмюра. Подставляя экспериментальные данные графически
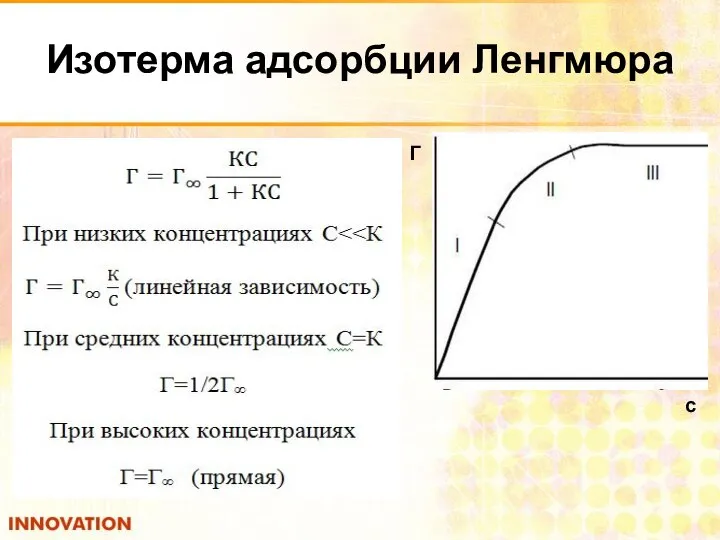
- 28. Изотерма адсорбции Ленгмюра с Г
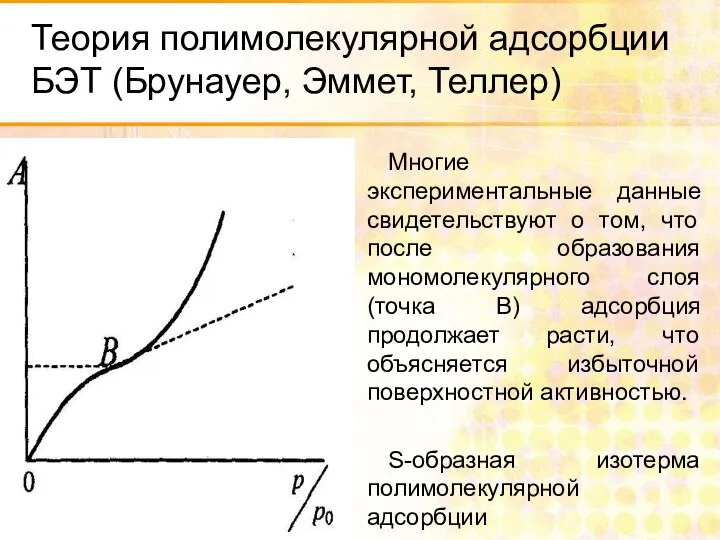
- 29. Теория полимолекулярной адсорбции БЭТ (Брунауер, Эммет, Теллер) Многие экспериментальные данные свидетельствуют о том, что после образования
- 30. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – РАСТВОР При изучении адсорбции из растворов на твердых адсорбентах различают
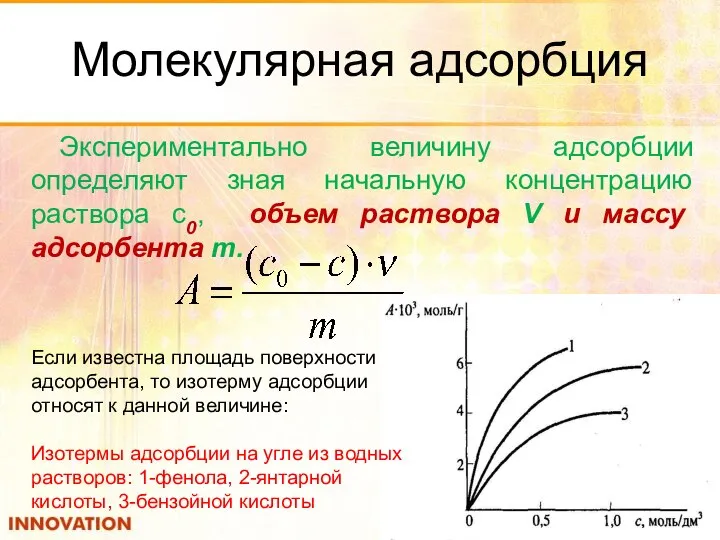
- 31. Молекулярная адсорбция Экспериментально величину адсорбции определяют зная начальную концентрацию раствора с0, объем раствора V и массу
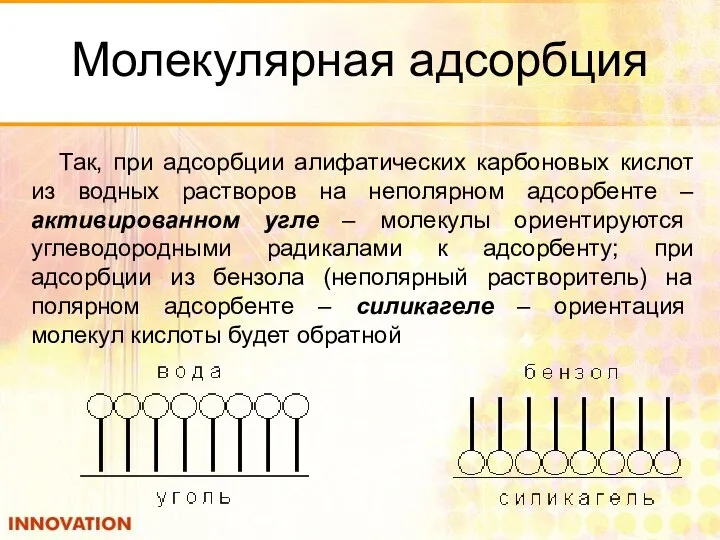
- 32. Молекулярная адсорбция Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте – активированном
- 33. Вывод Из приведенного выше подтверждается тот факт, что: Для адсорбции ПАВ из неполярных или малополярных растворителей
- 34. Ионообменная адсорбция Ионообменная адсорбция – процесс, в котором адсорбент и раствор обмениваются между собой в эквивалентных
- 35. Хроматография Хроматография - динамический метод анализа, основанный на многократно повторяющихся процессах сорбции и десорбции.
- 36. Хроматография – физико-химический метод, используется для разделения веществ аналитические цели препаративные цели Служит для идентификации и
- 37. Из истории хроматографии Михаил Семёнович Цвет (1872—1919) День рождения хроматографии – 21 марта 1903г. Доклад М.С.
- 38. «Никакое другое открытие не оказало на исследования в органической химии такого огромного продолжительного влияния, как анализ
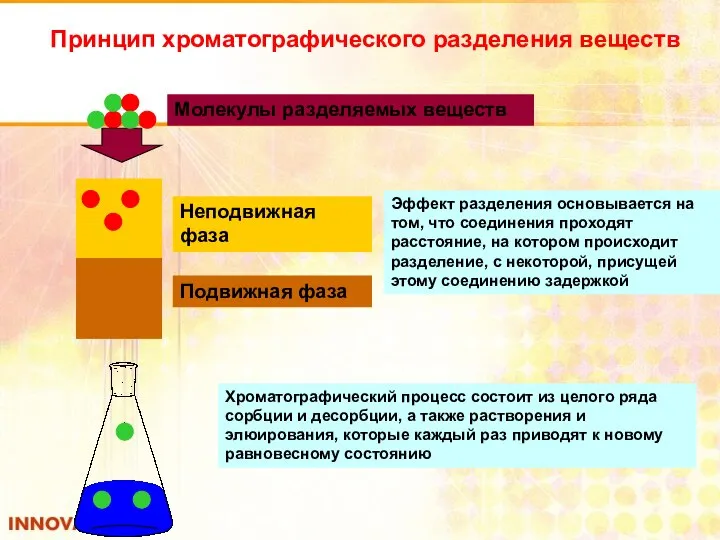
- 39. Принцип хроматографического разделения веществ Неподвижная фаза Подвижная фаза Молекулы разделяемых веществ Эффект разделения основывается на том,
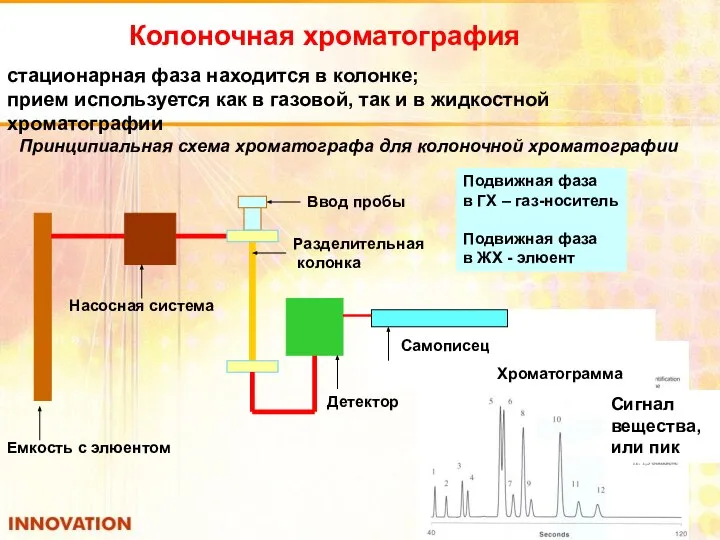
- 40. Колоночная хроматография стационарная фаза находится в колонке; прием используется как в газовой, так и в жидкостной
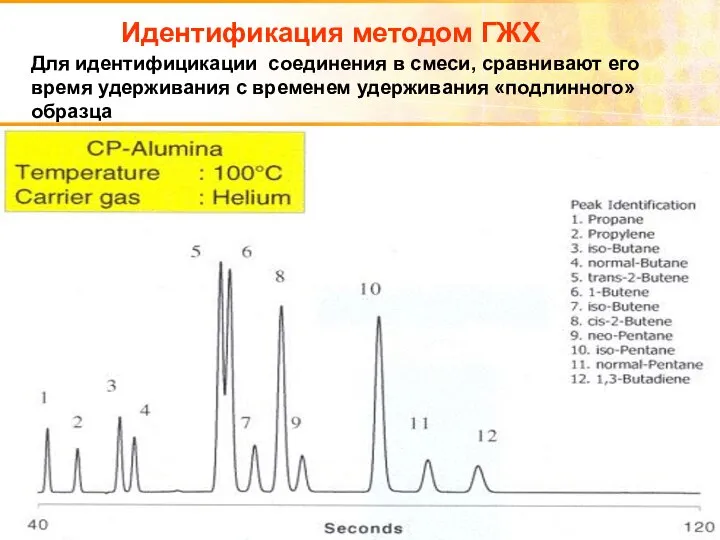
- 41. Идентификация методом ГЖХ Для идентифицикации соединения в смеси, сравнивают его время удерживания с временем удерживания «подлинного»
- 42. ВЭЖХ Agilent Technologies
- 43. ВЭЖХ Милихром
- 44. ВЭЖХ HP
- 45. ГЖХ “Agilent Technologies”
- 46. Энтеросорбция Метод лечения различных заболеваний, основанный на способности энтеросорбентов связывать и выводить из организма различные экзогенные
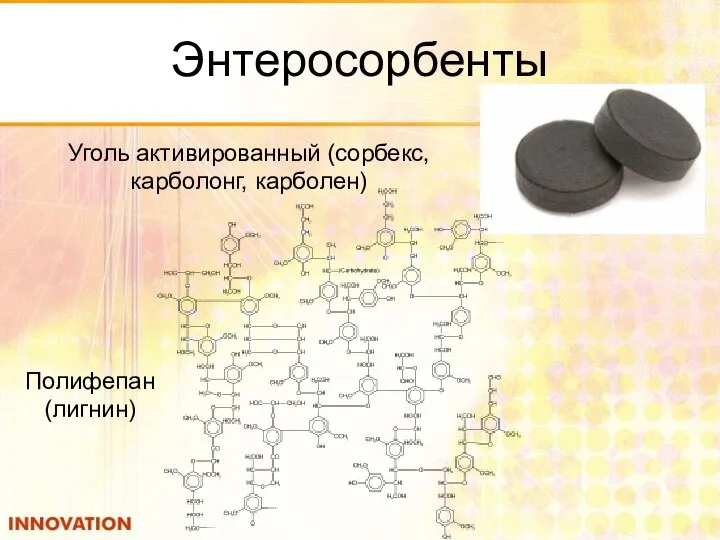
- 47. Энтеросорбенты Полифепан (лигнин) Уголь активированный (сорбекс, карболонг, карболен)
- 48. Энтеросорбенты Смекта Кремнийорганический сорбент Энтеросгель
- 49. Энтеросорбция Энтеросорбция является составной частью эфферентной терапии (от латинского efferens — выводить). Кроме энтеросорбции, в эту
- 50. Гемодиализ Гемодиализ (от гемо- и διάλυσις — разложение, отделение) — метод внепочечного очищения крови при острой
- 51. Перитонеальный диализ Перитонеальный диализ(анат. peritoneum брюшина: греч. dialysis разложение, отделение)метод очищения крови от эндогенных и экзогенных
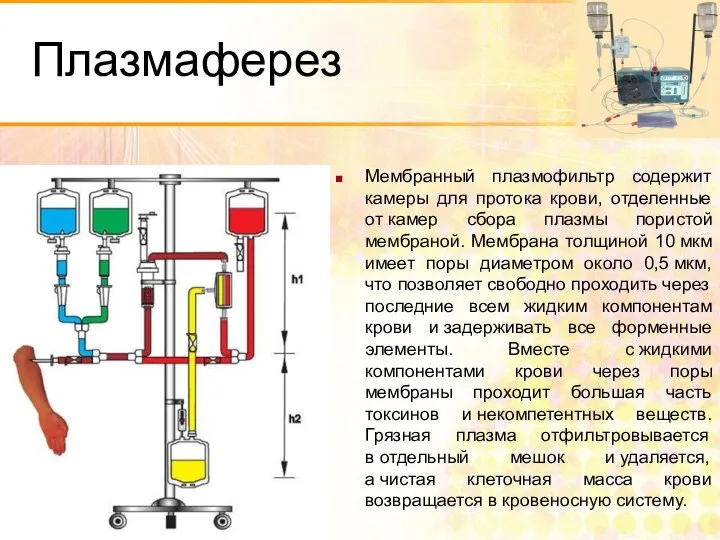
- 52. Плазмаферез Мембранный плазмофильтр содержит камеры для протока крови, отделенные от камер сбора плазмы пористой мембраной. Мембрана
- 54. Скачать презентацию







![Уравнение Гиббса Г - количество адсорбированного вещества [моль/м2] а – равновесная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651662/slide-10.jpg)






















 Общенаучные методы исследований
Общенаучные методы исследований Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Липиды
Липиды «Азот»және «Фосфор»элементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
«Азот»және «Фосфор»элементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД Пәнге кіріспе. Жалпы технологиялық түсініктер мен терминдер. Өнеркәсіптік регламент негізгі нормативті-техникалық құжат ретінде
Пәнге кіріспе. Жалпы технологиялық түсініктер мен терминдер. Өнеркәсіптік регламент негізгі нормативті-техникалық құжат ретінде Вода та її властивості
Вода та її властивості Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Строение электронных оболочек атомов Задачи урока: Познакомиться со строением электронных оболочек атомов Научиться составлят
Строение электронных оболочек атомов Задачи урока: Познакомиться со строением электронных оболочек атомов Научиться составлят Физико-химиеские методы анализа (ФХМА)
Физико-химиеские методы анализа (ФХМА) Исследование минерализата в клинической фармации
Исследование минерализата в клинической фармации Разложение отходов. 11 класс
Разложение отходов. 11 класс Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся
Виконала Учениця 11-А класу Рокосівської ЗОШ Білецька Олеся  Органическая химия. Пособие
Органическая химия. Пособие История чернил
История чернил Факторы влияющие на скорость химической реакции
Факторы влияющие на скорость химической реакции Презентация по Химии "Солі" - скачать смотреть бесплатно
Презентация по Химии "Солі" - скачать смотреть бесплатно Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері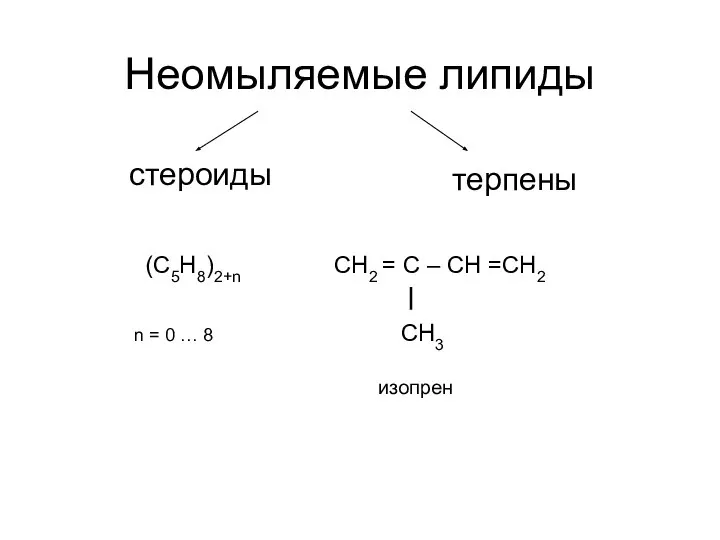 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Оксид кремния
Оксид кремния Мұнай. Табиғи және синтетикалық каучук
Мұнай. Табиғи және синтетикалық каучук Материаловедение. Теория термической обработки стали. (Тема 8)
Материаловедение. Теория термической обработки стали. (Тема 8) Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны Материаловедение. Неметаллические материалы. (Тема 16)
Материаловедение. Неметаллические материалы. (Тема 16) Синтетический каучук
Синтетический каучук Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Химический брейн-ринг
Химический брейн-ринг