Содержание
- 2. Атомные характеристики тяжелых р – элементов s2[__] p2[__]__]__] s2[__] p3[__]__]__] s2[__] p4[__]__]__] IV V VI 937
- 3. Прогнозирование свойств тяжелых р - элементов
- 4. Проявление свойств «металличности» и «неметалличности» у атомов элементов и их соединений. Физические свойства.
- 6. Химические свойства.
- 7. Вывод: Тяжелые р – элементы, называемые полуметаллами, будут сочетать в себе свойства «металличности» и «неметалличности». В
- 8. Литературные данные 1). Общая химия в формулах, определениях, схемах. Под редакцией В.Ф. Тикавого. Минск. Издательство Университетское,
- 9. Для элементов IVA подгруппы ПСЭ
- 10. Для элементов VА подгруппы ПСЭ
- 11. Для элементов VIA подгруппы ПСЭ
- 14. Экспериментальная часть
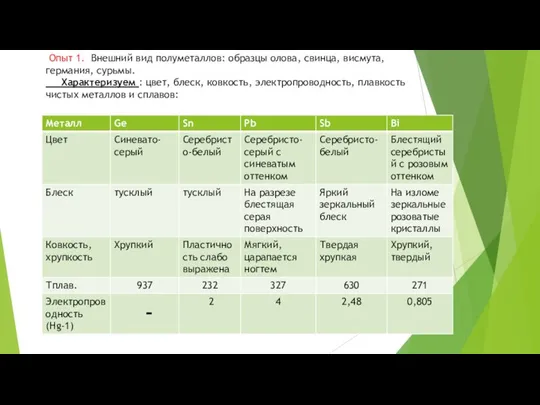
- 15. Опыт 1. Внешний вид полуметаллов: образцы олова, свинца, висмута, германия, сурьмы. Характеризуем : цвет, блеск, ковкость,
- 16. Германий
- 17. Свинец
- 18. Олово
- 19. Сурьма
- 20. Висмут
- 21. Опыт 2. Взаимодействие полуметаллов с простыми веществами. Образование прочных оксидных плёнок на металлах при взаимодействии с
- 22. Опыт 3. Отношение свинца к разбавленным HCl, H2SO4, H3PO4, CH3COOH конц. кислотам. Выполнение опыта: зачистим наждачной
- 24. Отметим наблюдения в таблице. Растворимость свинца в кислотах, окисляющих ионом Н+
- 25. Вывод Свинец нерастворим в соляной, серной и фосфорной кислотах вследствие образования на его поверхности малорастворимых пленок
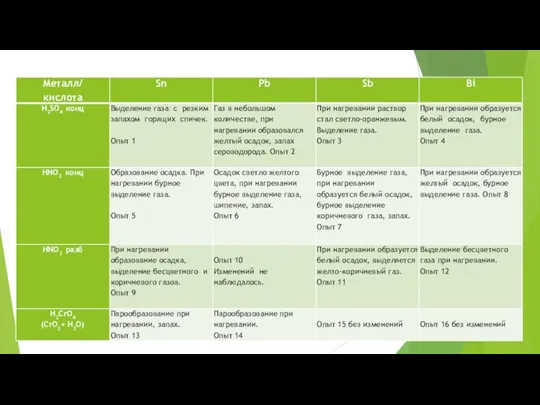
- 26. Опыт 4. Отношение полуметаллов к кислотам, окисляющим анионом кислоты (HNO3 конц, H2CrO4, H2SO4 конц). Исследуемые полуметаллы
- 28. Опыт 4.1 Sn + 2H2SO4 = SnSO4 + SO2 + 2H2O Sn - 2e = Sn+2
- 29. Опыт 4.2 8Pb + 19 H2SO4 = 8Pb (HSO4)2 + SO2 + 10H2O + S +
- 30. Опыт 4.3 21H2SO4
- 31. Опыт 4.4
- 32. Опыт 4.5
- 33. Опыт 4.6
- 34. Опыт 4.7
- 35. Опыт 4.8
- 36. Опыт 4.9
- 37. Опыт 4.10
- 38. Опыт 4.11
- 39. Опыт 4.12 Sn + H2CrO4 = … Продолжение напишите сами
- 40. Опыт 4.13 Pb + H2CrO4 = … Предлагаем дописать уравнения самостоятельно
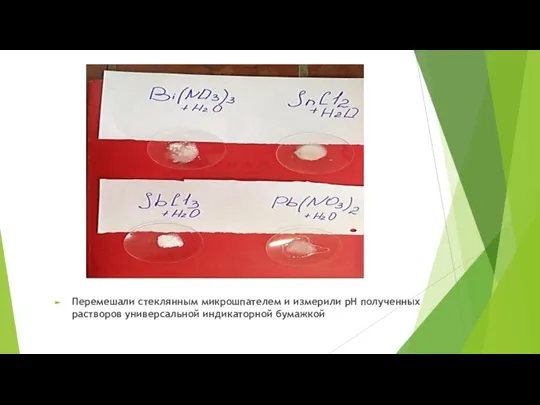
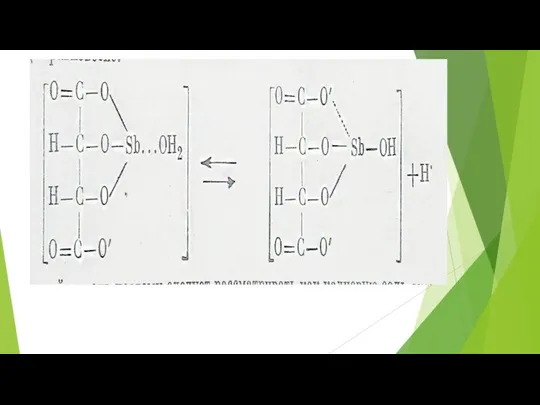
- 41. Опыт 5. Склонность солей полуметаллов к гидролизу. Соли: Bi(NO3)3, SnCl2, SbCl3, Pb(NO3)2; лакмус и УИБ. 5а)Выполнение
- 42. Перемешали стеклянным микрошпателем и измерили рН полученных растворов универсальной индикаторной бумажкой
- 44. Уравнения реакций гидролиза катионов полуметаллов.
- 45. Опыт 5.2
- 46. Перемешали стеклянным микрошпателем и измерили рН полученных растворов универсальной индикаторной бумажкой (отметили растворение солей в ацетоне)
- 47. Bi(NO3) PH=1 В ацетоне гидролиз уменьшается, величины pH увеличиваются
- 48. Опыт 6. Исследование окислительно -восстановительных свойств полуметаллов и их соединений. Выполнение опыта: В пробирку поместили 1-2
- 49. Опыт 6.2 Выполнение опыта: В пробирку поместить 1-2 см³ водного раствора CuSO₄ и опустить туда зачищенную
- 50. Опыт 6.3 Выполнение опыта: Получили в пробирке раствор станнита натрия Na₂SnO₂, для чего в пробирку поместили
- 51. Восстановление висмута станнитом натрия в щелочной среде:
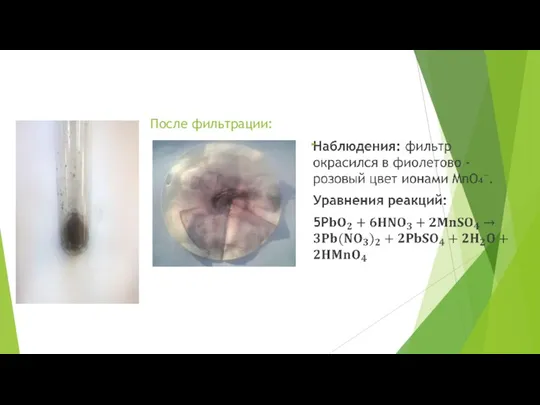
- 52. Опыт 6.4 Выполнение опыта: Поместим в пробирку немного PbO₂ (0,5 микрошпателя), прибавляем 1 см³ концентрированной HNO₃.
- 53. После фильтрации:
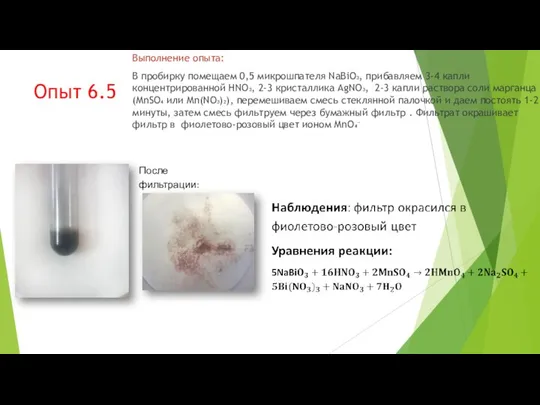
- 54. Опыт 6.5 Выполнение опыта: В пробирку помещаем 0,5 микрошпателя NaBiO₃, прибавляем 3-4 капли концентрированной HNO₃, 2-3
- 55. Опыт 6.6 Выполнение опыта: В пробирку помещаем 2-3 стружки магния, прибавляем 2-3 капли раствора соли сурьмы
- 56. Опыт 7.1 Процессы комплексообразования полуметаллов. Образование комплексной соли висмута.
- 57. Выполнение опыта. В пробирку поместим 2-3 капли соли висмута и 1 каплю разб. KJ, появится черный
- 58. Опыт 7.2 Образование комплекса свинца (II). Выполнение опыта. В пробирку с раствором Pb(NO3)2 вносим 1-2 капли
- 60. Опыт 7.3) Выполнение опыта . Обазование оксалатного комплекса олова (II) В пробирку поместили 2-3 капли ацетонового
- 61. Опыт 7.4 Na2S2O3 осаждает белый осадок из растворов солей свинца ( II ) PbS2O3 , растворимый
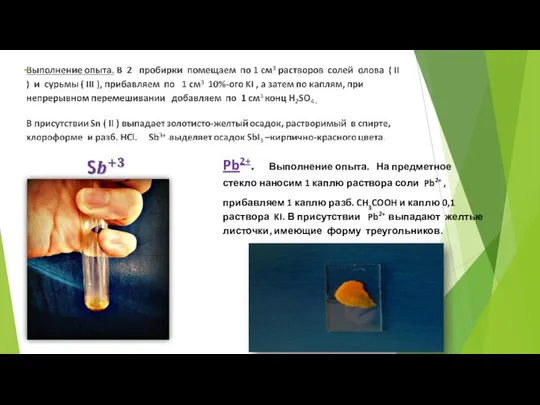
- 63. Качественные реакции для распознавания катионов полуметаллов. Sb3+. Выполнение опыта. К 2-3 каплям раствора SbCl3 прибавляем 2-3
- 64. Pb2+. Выполнение опыта. На предметное стекло наносим 1 каплю раствора соли Pb2+ , прибавляем 1 каплю
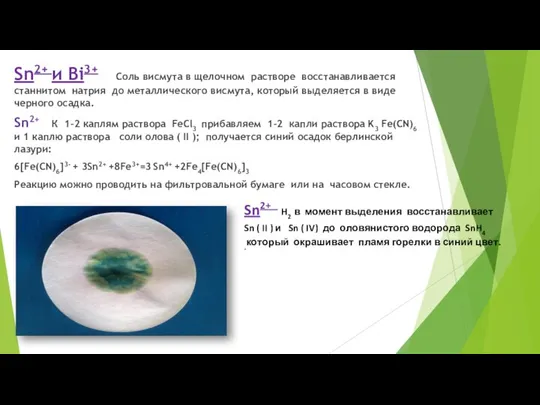
- 65. Sn2+ и Bi3+ Соль висмута в щелочном растворе восстанавливается станнитом натрия до металлического висмута, который выделяется
- 66. Выполнение опыта. К 3-5 каплям раствора соли олова ( II ) в фарфоровой чашке приливаем около
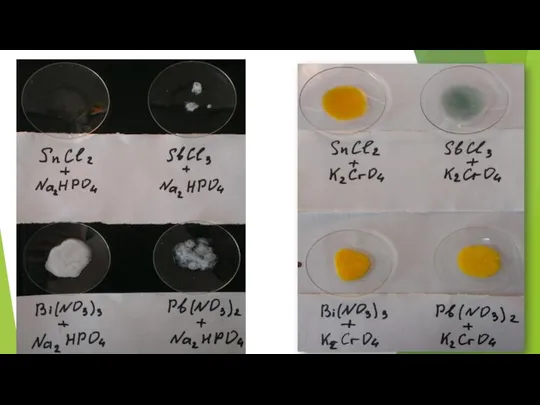
- 67. Исследование реакций осаждения солей полуметаллов . Опыт 8.1: Образование сульфидов. Выполнение: На полоске фильтровальной бумаги 4
- 68. Когда соли впитаются в бумагу, сверху нанести по 1 капли раствора Na2S.
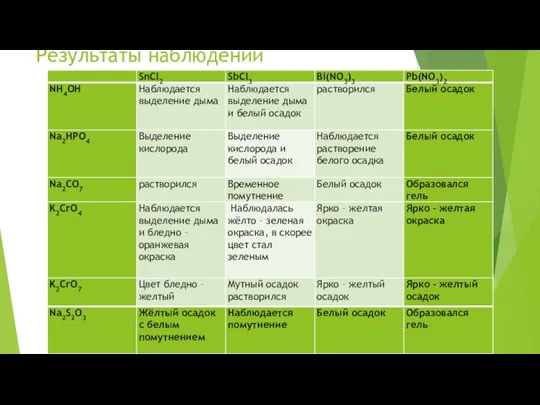
- 74. Результаты наблюдений
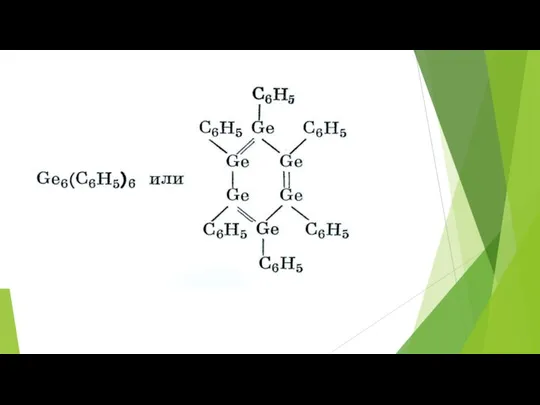
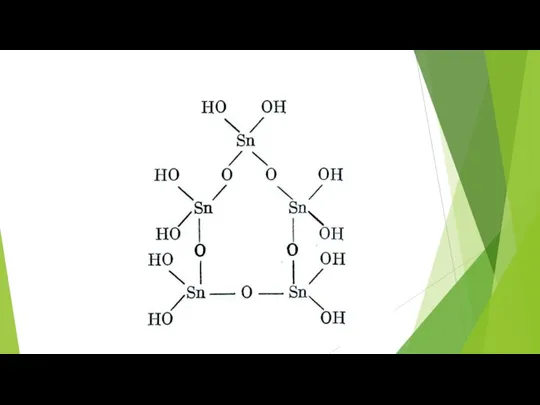
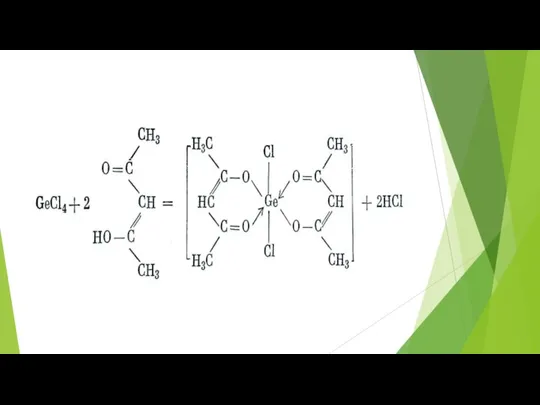
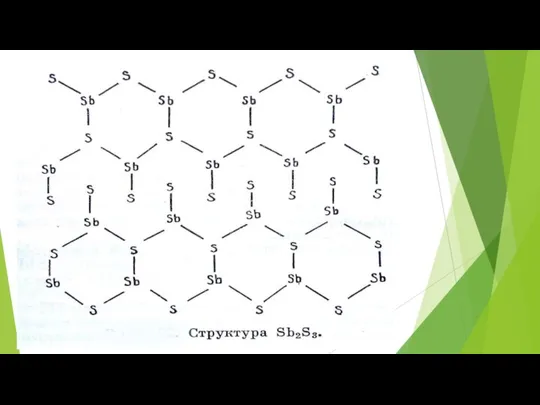
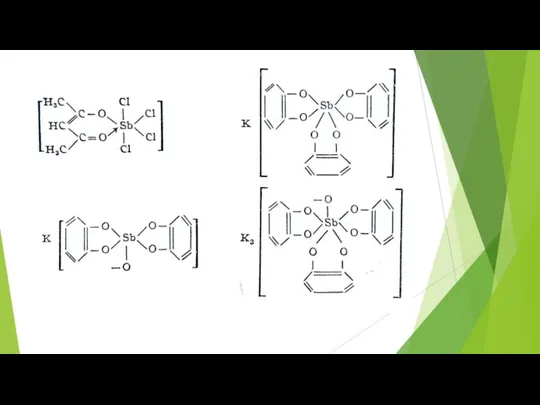
- 75. Склонность полуметаллов к полимеризации
- 83. Скачать презентацию
![Атомные характеристики тяжелых р – элементов s2[__] p2[__]__]__] s2[__] p3[__]__]__] s2[__]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395931/slide-1.jpg)































































 Этанол (этиловый спирт)
Этанол (этиловый спирт) Кометика Liv Delano - презентация_
Кометика Liv Delano - презентация_ Хемосинтез. Автотрофное питание
Хемосинтез. Автотрофное питание Сложные эфиры в жизни человека
Сложные эфиры в жизни человека Вода. Физические и химические свойства воды
Вода. Физические и химические свойства воды Углеводы. 10 класс
Углеводы. 10 класс Презентация Свойства черных и цветных металлов
Презентация Свойства черных и цветных металлов  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Растворы. Гетерогенные равновесия растворов с осадком
Растворы. Гетерогенные равновесия растворов с осадком Тема урока "Основания" - презентация_
Тема урока "Основания" - презентация_ “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Оксиды
Оксиды Вуглеводи, як компонент їжі. Їхня роль в організмі людини
Вуглеводи, як компонент їжі. Їхня роль в організмі людини Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть
Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть  Строение электронных оболочек атомов
Строение электронных оболочек атомов Тотықтырғыштар
Тотықтырғыштар Производная в химии
Производная в химии Классификация кислот
Классификация кислот Катализатор. Анализ кинетических данных
Катализатор. Анализ кинетических данных Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Биотрансформация чужеродных соединений в организме. (Лекция 5)
Биотрансформация чужеродных соединений в организме. (Лекция 5) Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть
Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть  Краткая история химии
Краткая история химии Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Методы разделения и концентрирования
Методы разделения и концентрирования Л3.12 Композицитонные материалы
Л3.12 Композицитонные материалы