Содержание
- 2. РАЗДЕЛ 1 ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ
- 3. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ Определение: Химическая технология это последовательность промышленных операций по подготовке и химическому взаимодействию
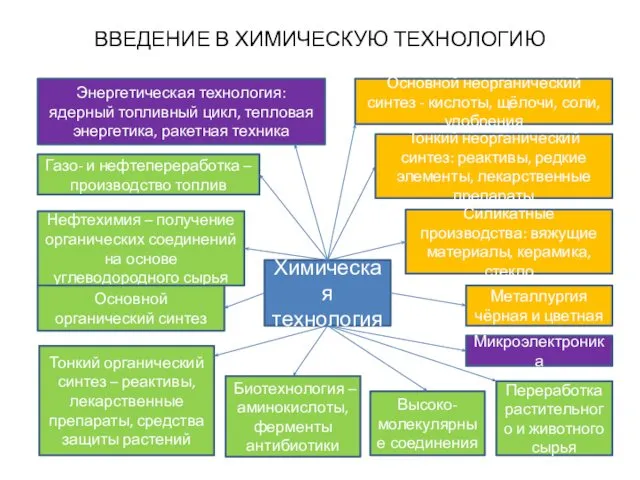
- 4. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ Химическая технология Металлургия чёрная и цветная Газо- и нефтепереработка – производство топлив
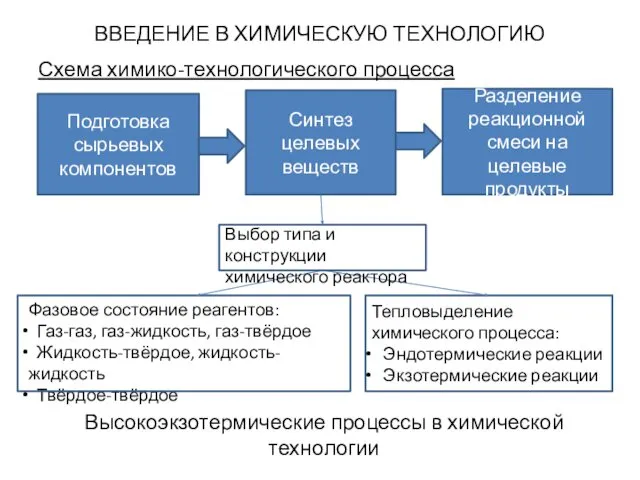
- 5. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ Схема химико-технологического процесса Подготовка сырьевых компонентов Синтез целевых веществ Разделение реакционной смеси
- 6. УРАВНЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ Уравнение химической реакции это схема процесса, не учитывающая наличие стадий превращения: n1X1 pc
- 7. ПРОСТЫЕ И СЛОЖНЫЕ РЕАКЦИИ Простая реакция – это реакция непосредственно между валентно-насыщенными молекулами исходных веществ. Крайне
- 8. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Направление протекания химической реакции и энергия Гиббса Энергия Гиббса (изобарно-изотермический потенциал, свободная энтальпия):
- 9. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Характер изменения энергии Гиббса позволяет судить о принципиальной возможности протекания процесса Изменение энергии
- 10. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Кинетическое определение энергии Гиббса: ΔG = RTlnK, где K – константа равновесия реакции.
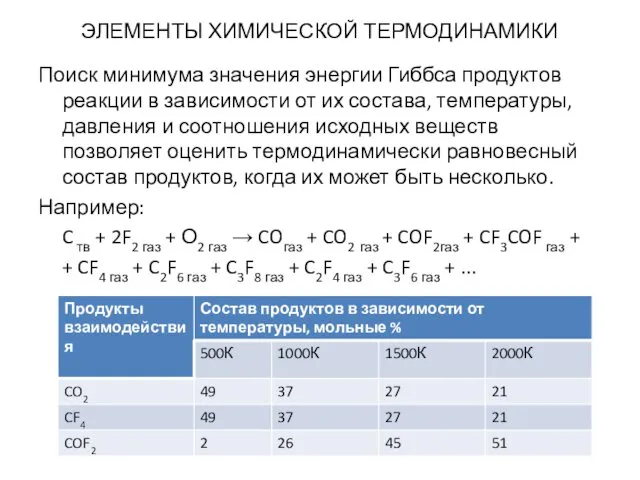
- 11. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Поиск минимума значения энергии Гиббса продуктов реакции в зависимости от их состава, температуры,
- 12. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Система уравнений для расчёта термодинамически равновесного состава газообразных веществ: - уравнения химического равновесия;
- 13. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Стандартная энтальпия образования и тепловой эффект реакции Энтальпия (теплосодержание) это энергия системы, которая
- 14. ЭЛЕМЕНТЫ ТЕРМОХИМИИ Тепловым эффектом химической реакции Q называют изменение энтальпии системы при протекании в ней химической
- 15. ЭЛЕМЕНТЫ ТЕРМОХИМИИ Закон Гесса — основной закон термохимии: тепловой эффект реакции, протекающей в изобарно-изотермических или изохорно-изотермических
- 16. ЭЛЕМЕНТЫ ТЕРМОХИМИИ Расчёт теплового эффекта реакции Q и адиабатической температуры Tad продуктов реакции по закону Кирхгофа
- 17. ЭЛЕМЕНТЫ ТЕРМОХИМИИ Адиабатическая температура продуктов экзотермической реакции ΔTad = Q ∙ cpΣ-1 Например: 1. UF6 газ
- 18. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ Скорость химической реакции: изменение концентрации вещества во времени в связи с протеканием химического
- 19. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ Зависимость скорости химической реакции от температуры, экспонента Аррениуса: к = к0∙exp(-E/(RT)), где Е
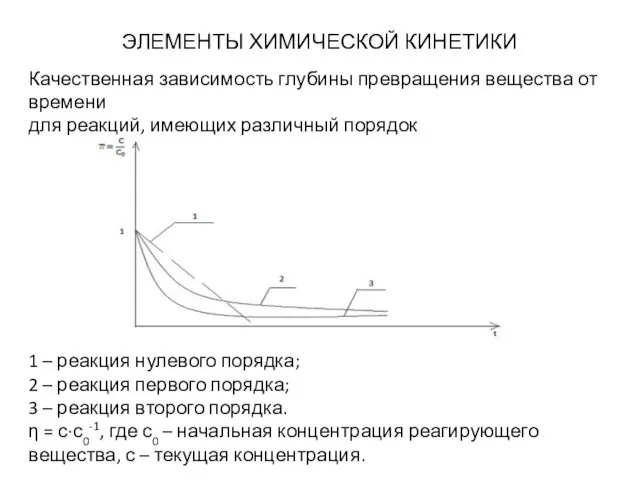
- 20. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ Порядок химической реакции Реакция нулевого порядка - расходование компонентов реакции не влияет на
- 21. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ 1 – реакция нулевого порядка; 2 – реакция первого порядка; 3 – реакция
- 23. Скачать презентацию
















 Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Вакуумное фильтрование
Вакуумное фильтрование Битумы природного происхождения
Битумы природного происхождения Растворение. Растворы
Растворение. Растворы Вещества
Вещества Пропан, C3H8
Пропан, C3H8 Презентация по Химии "Соединения" - скачать смотреть бесплатно
Презентация по Химии "Соединения" - скачать смотреть бесплатно Минералы и Близнецы
Минералы и Близнецы Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Химические реакции (11 класс)
Химические реакции (11 класс) Диазо- и азосоединения
Диазо- и азосоединения Структура кристаллических полимеров
Структура кристаллических полимеров Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Железо. Физические и химические свойства
Железо. Физические и химические свойства Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно
Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К
Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К Методы светорассеяния для исследования растворов (био) полимеров и наночастиц
Методы светорассеяния для исследования растворов (био) полимеров и наночастиц Презентация по Химии "Семь доисторических металлов" - скачать смотреть
Презентация по Химии "Семь доисторических металлов" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Shapes of molecules
Shapes of molecules Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Оксиды азота
Оксиды азота Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Химическая очистка воды
Химическая очистка воды