Содержание
- 2. История открытия Нарисуйте схему получения фосфора по рассказу Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669
- 3. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и мерцало
- 4. Поразмышляем: Что изначально искал Бранд? Почему со времен античности до 1669 года не открывались элементы? Какие
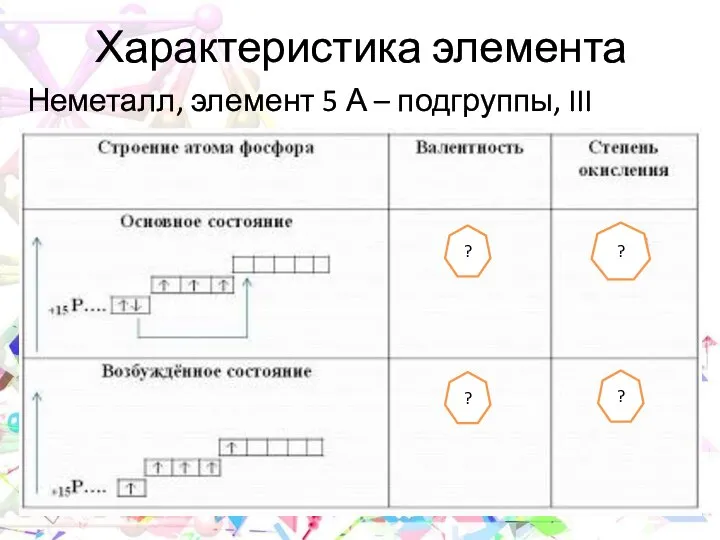
- 5. Характеристика элемента Неметалл, элемент 5 А – подгруппы, III периода ? ? ? ?
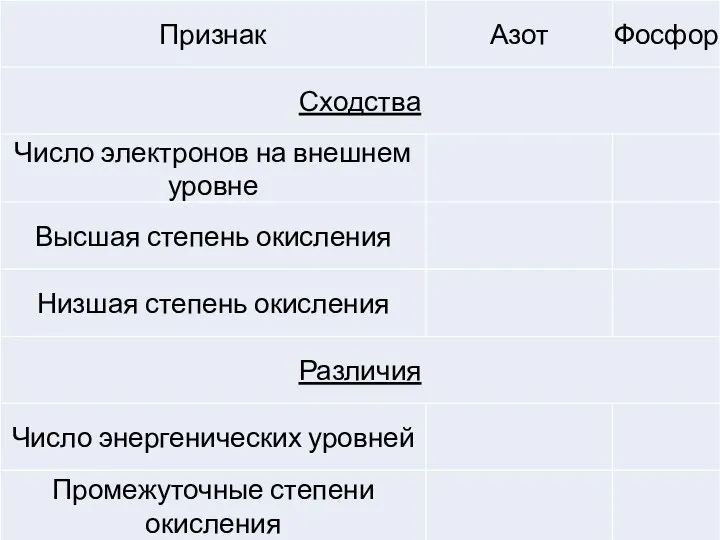
- 8. Вопросы для обсуждения: Сравните свойства простого вещества фосфора с серой и азотом Сравните кислотно-основные свойства летучего
- 9. Характеристика простого вещества: Фосфор обладает аллотропией: Белый Красный Черный Металлический
- 10. Разомнем мозги: По данным таблицы определите: Какая модификация фосфора больше напоминает по физическим свойствам метал? А
- 12. Нахождение в природе: В природе существует практически только в виде фосфатов, например фосфоритов и апатитов:
- 13. Получение фосфора: Фосфор (белый) получают в промышленности, например, при прокаливании апатита с коксом и песком: Фосфат
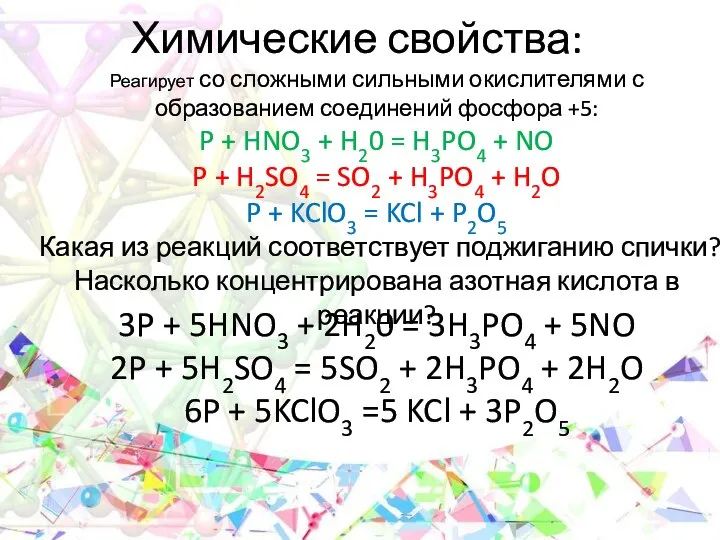
- 14. Химические свойства:
- 15. Химические свойства: 3P + 5HNO3 + 2H20 = 3H3PO4 + 5NO 2P + 5H2SO4 = 5SO2
- 17. Фосфин Газ с резким запахом, похожим на рыбу Очень ядовит, вызывает ожоги дыхательных путей и поражение
- 18. Фосфорная кислота. Бесцветные гигроскопичные кристаллы, хорошо растворима в воде и других полярных растворителях. Концентрированный раствор –
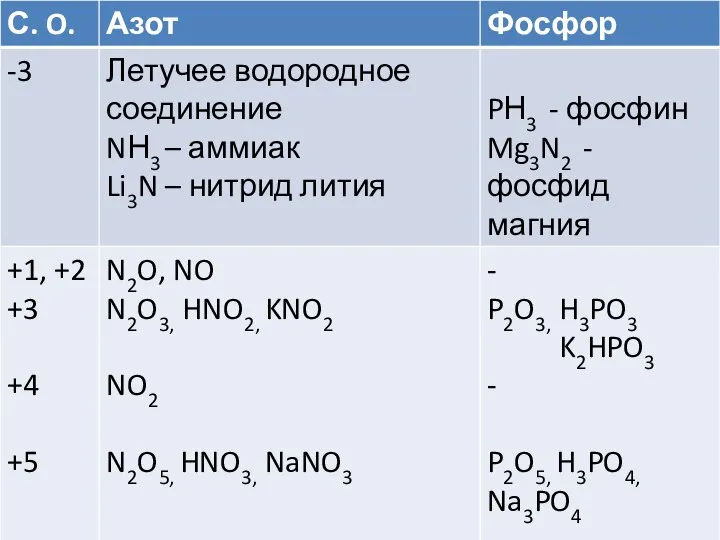
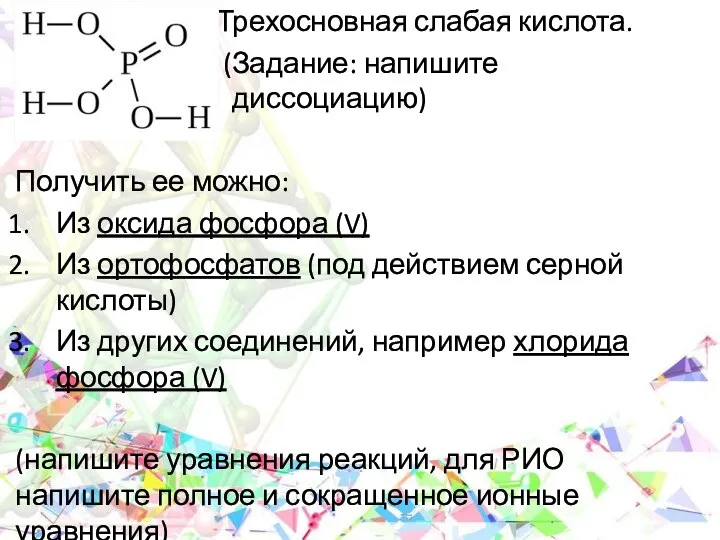
- 19. Трехосновная слабая кислота. (Задание: напишите ____________ диссоциацию) Получить ее можно: Из оксида фосфора (V) Из ортофосфатов
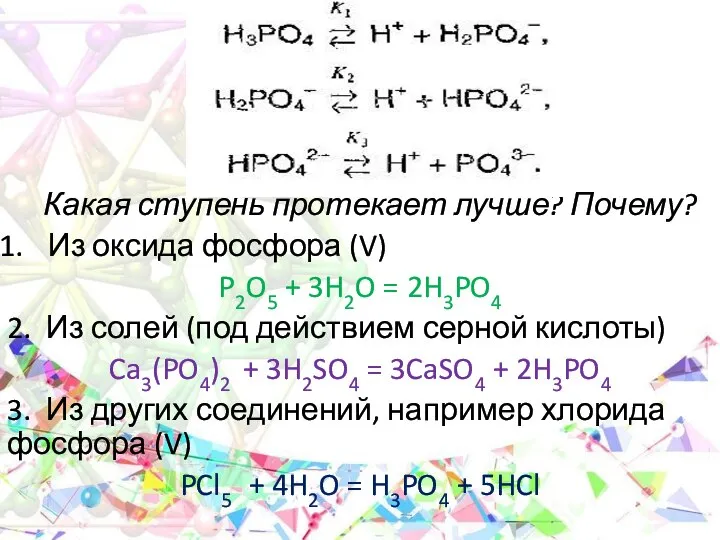
- 20. Какая ступень протекает лучше? Почему? Из оксида фосфора (V) P2O5 + 3H2O = 2H3PO4 2. Из
- 21. Как и все слабые кислоты реагирует с (чем?) Основаниями (NaOH + H3PO4 = ) Основными оксидами
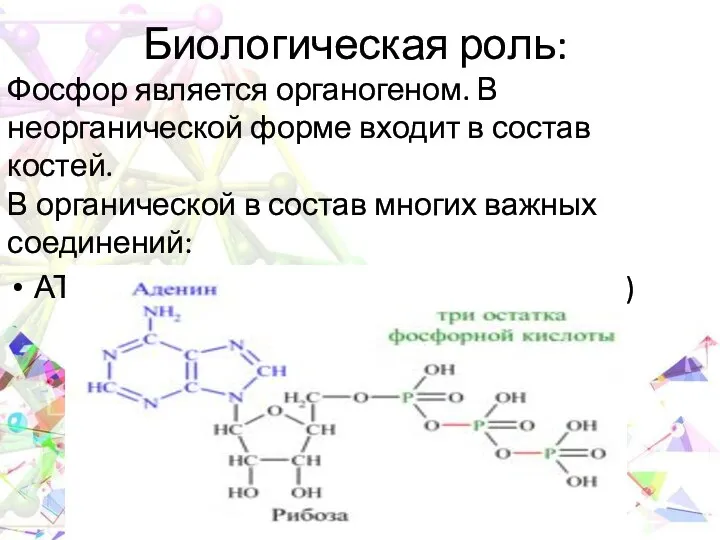
- 22. Биологическая роль: Фосфор является органогеном. В неорганической форме входит в состав костей. В органической в состав
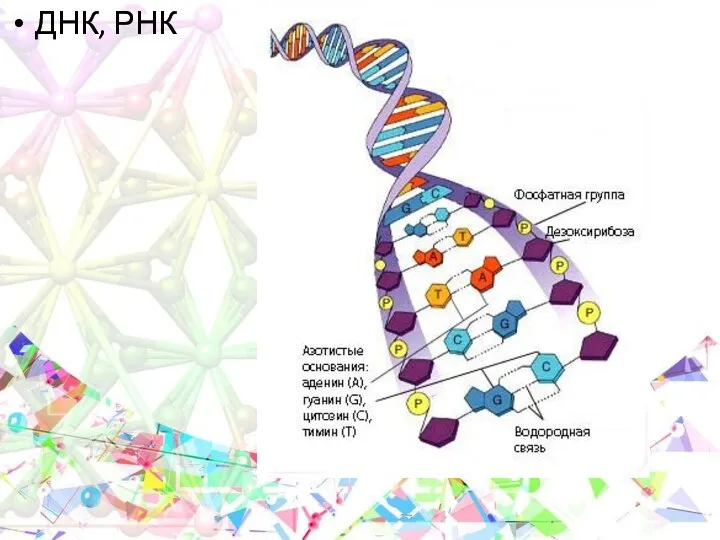
- 23. ДНК, РНК
- 24. Применение в сельском хозяйстве Фосфор способствует накоплению полезных веществ растением и повышает его выносливость. Фосфорное голодание
- 25. Фосфорсодержащие удобрения Аммофос — сложное фосфорно-азотное удобрение содержит азот и фосфор. Нитроаммофос — азотно-фосфорное удобрение, которое
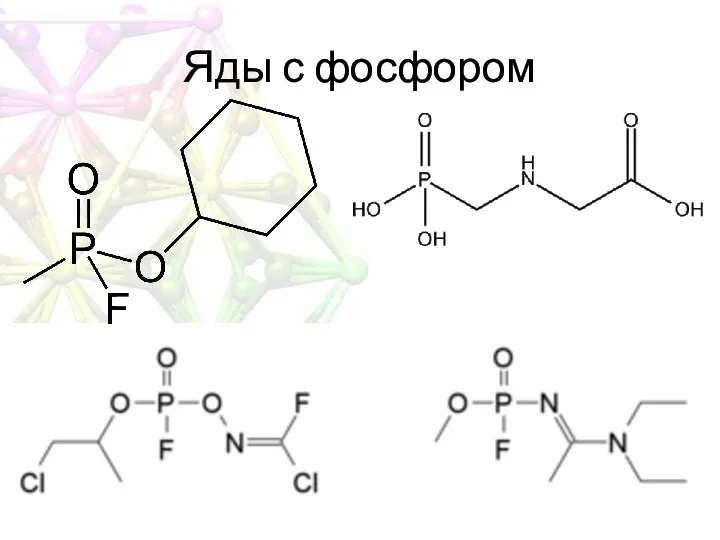
- 26. Яды с фосфором
- 27. Химия в литературе: А. Конан Дойл описал собаку, морда которой была в белом фосфоре, выглядела она
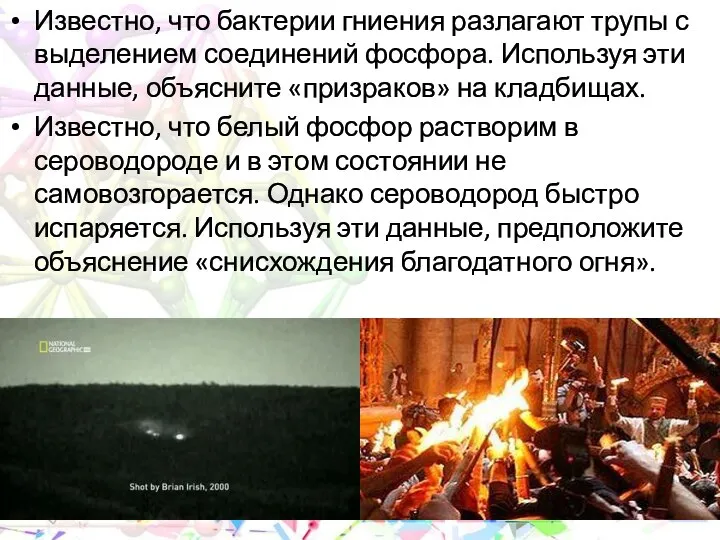
- 28. Известно, что бактерии гниения разлагают трупы с выделением соединений фосфора. Используя эти данные, объясните «призраков» на
- 30. Скачать презентацию

















 Коллигативные свойства растворов
Коллигативные свойства растворов Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории
Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно
Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно Галогени. Хімічні властивості
Галогени. Хімічні властивості Производство стекла
Производство стекла Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Ионная химическая связь
Ионная химическая связь Металлическая химическая связь. Тема 2.5
Металлическая химическая связь. Тема 2.5 Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Обмен веществ. Метаболизм и его функции
Обмен веществ. Метаболизм и его функции Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Heterogeneous catalysis
Heterogeneous catalysis Скорость химических реакций
Скорость химических реакций Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Водородная связь
Водородная связь Оксиды и кислородсодержащие кислоты неметаллов
Оксиды и кислородсодержащие кислоты неметаллов Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Видалення забруднень із поверхні тканини Виконали: Сидорова Анастасія Труба Альона
Видалення забруднень із поверхні тканини Виконали: Сидорова Анастасія Труба Альона  Презентация по Химии "Волокна" - скачать смотреть бесплатно
Презентация по Химии "Волокна" - скачать смотреть бесплатно Чипсы: Вред или польза?. 9 класс
Чипсы: Вред или польза?. 9 класс Углеводы. Структура
Углеводы. Структура Гели (Студни)
Гели (Студни) Презентация по химии Такой разный песок
Презентация по химии Такой разный песок  Базальтовое волокна
Базальтовое волокна Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Основные законы и понятия химии. Тема №10
Основные законы и понятия химии. Тема №10 Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства