Содержание
- 2. ПЛАН: Закон Рауля (1-ый закон) Следствия из закона Рауля (2-ой закон) Осмос и осмотическое давление. Уравнение
- 3. ИДЕАЛЬНЫЙ РАСТВОР - раствор, образование которого не сопровождается химическим взаимодействием компонентов, изменением объема и тепловым эффектом.
- 4. КОЛЛИГАТИВНЫЕ СВОЙСТВА – свойства растворов, которые определяются только количеством растворенного вещества (зависят только от количества частиц
- 5. Закон Рауля (I закон) 1882 год. Относительное понижение давления пара растворителя над раствором равно мольной доле
- 6. ΔР = Ро – Р абсолютное понижение давления насыщенного пара относительное понижение давления насыщенного пара Чем
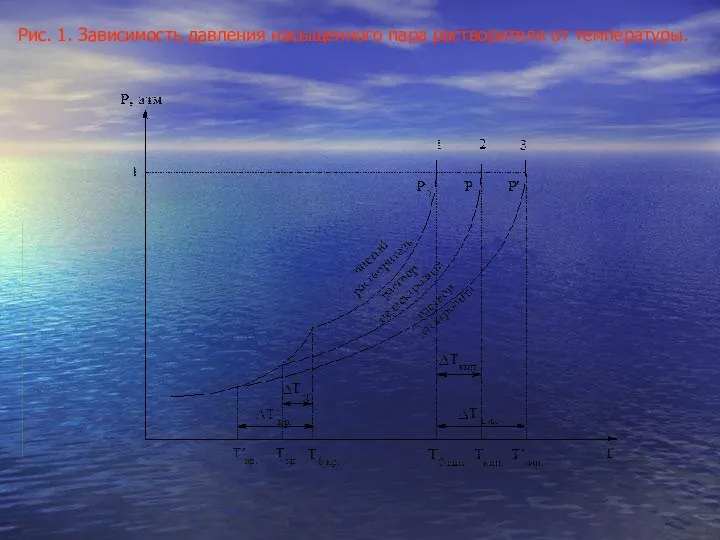
- 7. Следствием понижения давления насыщенного пара растворителя над раствором являются повышение температуры кипения и понижение температуры замерзания
- 8. ΔТкип = Ткип. р-ра – Ткип. р-рителя Кэ = Еэ – эбуллиоскопическая константа растворителя (зависит лишь
- 9. Рис. 1. Зависимость давления насыщенного пара растворителя от температуры.
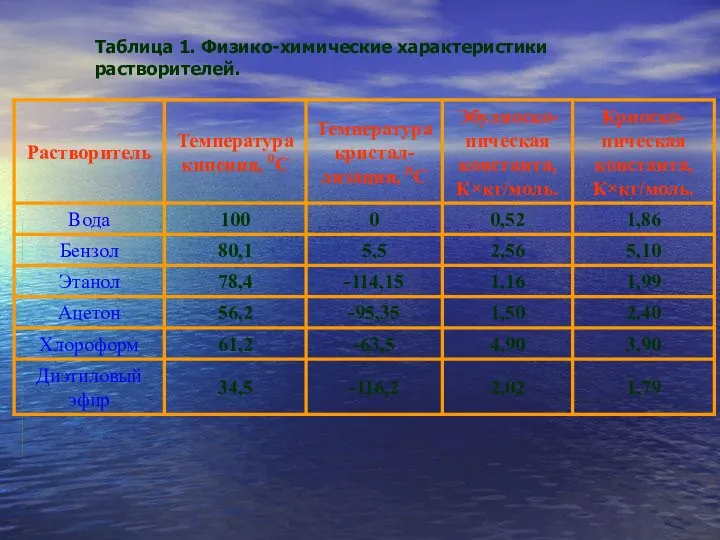
- 10. Таблица 1. Физико-химические характеристики растворителей.
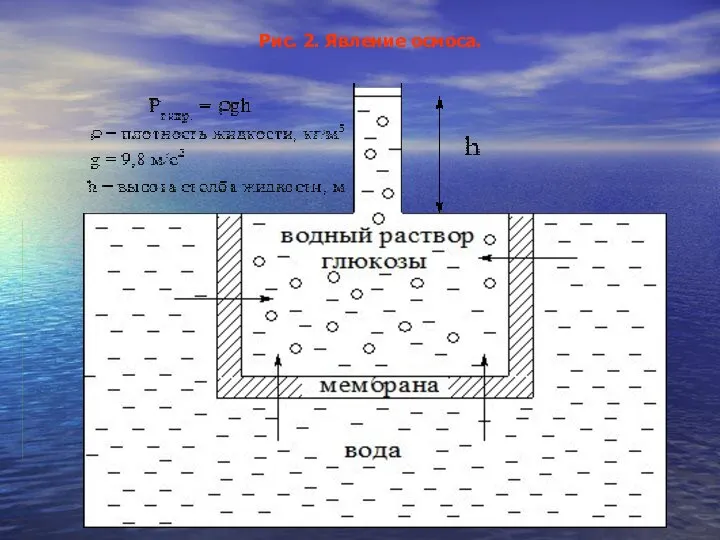
- 11. Процесс самопроизвольного выравнивания концентрации веществ в термодинамической системе называется диффузией. Диффузия – двусторонний процесс. Осмос –
- 12. Рис. 2. Явление осмоса.
- 13. Для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и концентрации выражается уравнением Вант-Гоффа (закон Вант-Гоффа)
- 14. Для применения законов Рауля и Вант-Гоффа к электролитам было предложено использовать изотонический коэффициент (i). (Вант-Гофф) Изотонические
- 15. С. Аррениус показал (1887 г), что для электролитов имеется степень диссоциации (α). 0 n – число
- 16. Для разбавленных растворов электролитов используются уравнения:
- 17. Эбуллиометрия – метод определения молекулярных масс растворенных веществ и концентрации растворов, основанный на измерении повышения температуры
- 18. Биологическое значение осмоса и осмотического давления Животные и растительные клетки в составе оболочки имеют полупроницаемые мембраны.
- 19. Рис. 3. Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации: а – изотонический раствор
- 20. Осмолярность (осмоляльность) – суммарная концентрация всех кинетически активных частиц, определяющих его осмотическое давление. Осмотическое давление кровяных
- 21. Осмотический гомеостаз – постоянство осмотического давления крови и других биологических жидкостей характерно для высокоорганизованных животных. Гипертонические
- 23. Скачать презентацию

















 Презентация по Химии "Показатели воды: её жесткость и кислотность" - скачать смотреть
Презентация по Химии "Показатели воды: её жесткость и кислотность" - скачать смотреть  Презентация по Химии "Охорона навколишнього середовища" - скачать смотреть
Презентация по Химии "Охорона навколишнього середовища" - скачать смотреть  Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук IV А группа. Углерод
IV А группа. Углерод Природные соединения кремния
Природные соединения кремния Серебро. Нахождение в природе
Серебро. Нахождение в природе Положение о движущей силе, ее распределении, секционировании процессов как следствие необратимости химических процессов
Положение о движущей силе, ее распределении, секционировании процессов как следствие необратимости химических процессов Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Металлы: общая характеристика
Металлы: общая характеристика Химия в кастрюле
Химия в кастрюле Углерод. Описание элемента
Углерод. Описание элемента Химические свойства органических соединений
Химические свойства органических соединений Введение в химию биологически активных веществ. (Тема 1)
Введение в химию биологически активных веществ. (Тема 1) Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Научные основы процессов разделения
Научные основы процессов разделения Правило смещения. Радиоактивность. Изотопы
Правило смещения. Радиоактивность. Изотопы Токсические химические элементы. Химизм действия
Токсические химические элементы. Химизм действия Фенол. Состав молекулы фенола
Фенол. Состав молекулы фенола Термодинамика химических процессов. Лекция 01-1
Термодинамика химических процессов. Лекция 01-1 Знання хімії в різні епохи
Знання хімії в різні епохи Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами
Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами Простые и сложные вещества Моцепуро Иван Класс 10 «а» Учитель: Макарова Е. И.
Простые и сложные вещества Моцепуро Иван Класс 10 «а» Учитель: Макарова Е. И. Выделение низших олефинов. Разделение непредельных газов
Выделение низших олефинов. Разделение непредельных газов Виды состояния вещества
Виды состояния вещества Эндогенная серия. Скарновая группа
Эндогенная серия. Скарновая группа Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей