Содержание
- 3. ПОЛУЧЕНИЕ В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой: В промышленности ортофосфорную кислоту получают
- 4. Физические свойства. Бесцветные гигроскопичные кристаллы моноклинной сингонии, плотность 1,88 г/см3, температура плавления 42,5 °С. Расплывается на
- 5. Химические свойства. При комнатной температуре довольно инертна, при нагревании проявляет свойства кислот, относится к кислотам средней
- 6. Применение Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали),
- 8. Скачать презентацию





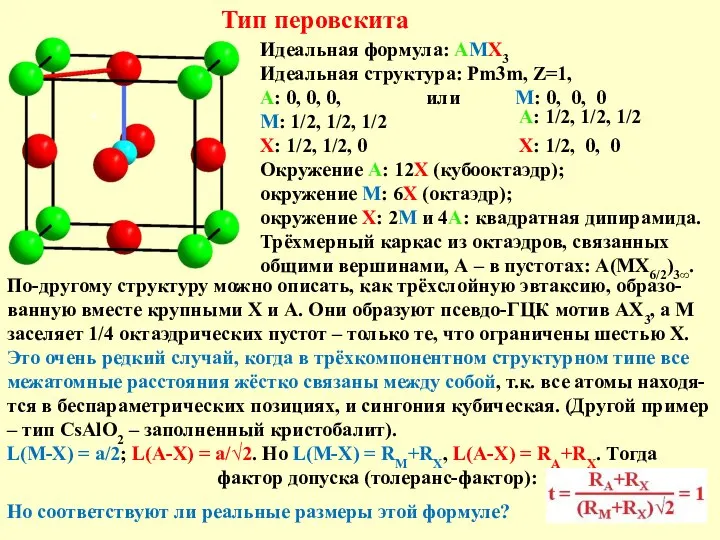 Тип перовскита
Тип перовскита Закон сохранения массы веществ
Закон сохранения массы веществ Строение, свойства, биологическая роль липидов. (Лекция 12)
Строение, свойства, биологическая роль липидов. (Лекция 12) Классы неорганических веществ. Оксиды. Кислоты
Классы неорганических веществ. Оксиды. Кислоты Теория резонанса в неорганической химии
Теория резонанса в неорганической химии «Круговорот кислорода в природе»
«Круговорот кислорода в природе» Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу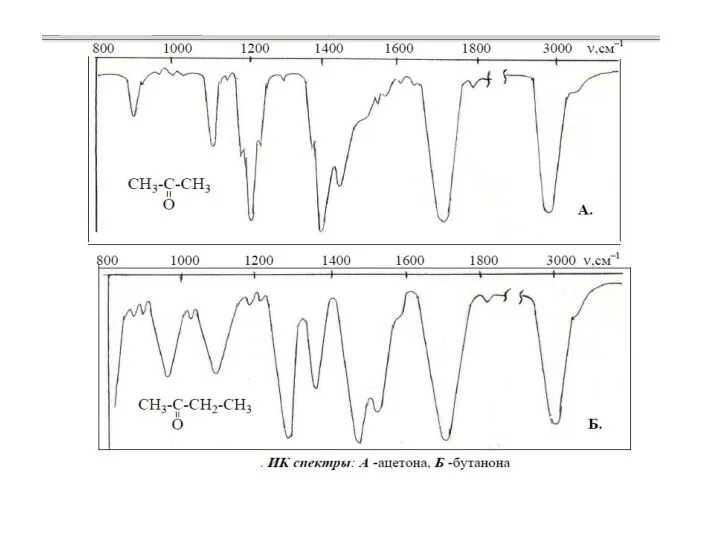 ИК-спектры органических соединений
ИК-спектры органических соединений Физические и химические явления. Химические реакции
Физические и химические явления. Химические реакции Предмет органической химии. Теория строения органических веществ А.М. Бутлерова
Предмет органической химии. Теория строения органических веществ А.М. Бутлерова Спирты. Химические свойства
Спирты. Химические свойства Карбоновые кислоты
Карбоновые кислоты The molecular basis of inheritance. (Chapter 16)
The molecular basis of inheritance. (Chapter 16) Презентация по Химии "Полимеры" - скачать смотреть
Презентация по Химии "Полимеры" - скачать смотреть  Статическая биохимия. Ферменты. Механизм действия. Регуляция. Классификация. (Лекция 2)
Статическая биохимия. Ферменты. Механизм действия. Регуляция. Классификация. (Лекция 2) Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Мир кристаллов. Изучение теоретического материала по теме «Кристалл»
Мир кристаллов. Изучение теоретического материала по теме «Кристалл» Презентация по Химии "Хімія в нашому житті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в нашому житті" - скачать смотреть бесплатно Су мен электролиттер алмасуы
Су мен электролиттер алмасуы Вторичная переработка нефти. Лекция 9
Вторичная переработка нефти. Лекция 9 The Shapes of Molecules
The Shapes of Molecules Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов
Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов Средства и методы стерилизации
Средства и методы стерилизации Презентация по Химии "Самородки." - скачать смотреть бесплатно_
Презентация по Химии "Самородки." - скачать смотреть бесплатно_ Плавление и кристаллизация
Плавление и кристаллизация Вопросы по пройденному материалу: (ответить письменно)
Вопросы по пройденному материалу: (ответить письменно) Электроды. Потенциометрия, ионометрия
Электроды. Потенциометрия, ионометрия Факторы, влияющие на скорость ферментативных реакций
Факторы, влияющие на скорость ферментативных реакций