Содержание
- 2. Теория резонанса: определения Теория (метод) резонанса – способ описания сопряженных π-систем, демонстрирующий подвижность π-электронов под действием
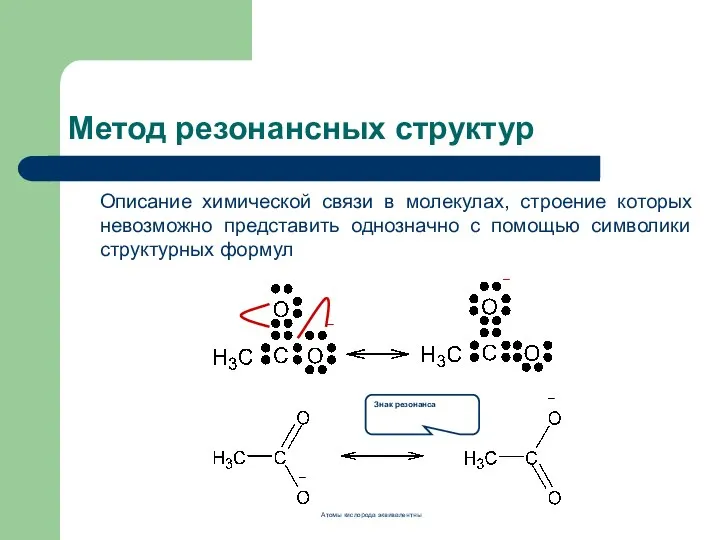
- 3. Метод резонансных структур Описание химической связи в молекулах, строение которых невозможно представить однозначно с помощью символики
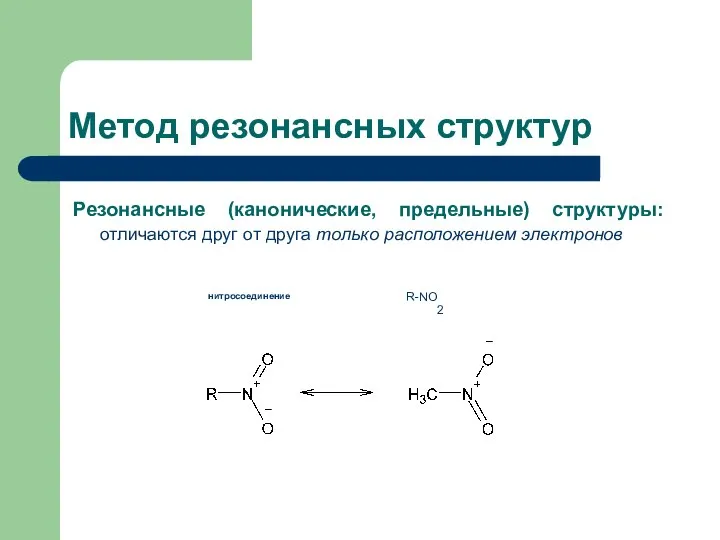
- 4. Резонансные (канонические, предельные) структуры: отличаются друг от друга только расположением электронов Метод резонансных структур
- 5. Положения метода резонанса Резонансные структуры не должны отличаться расположением атомов. 2) Каждая резонансная структура не должна
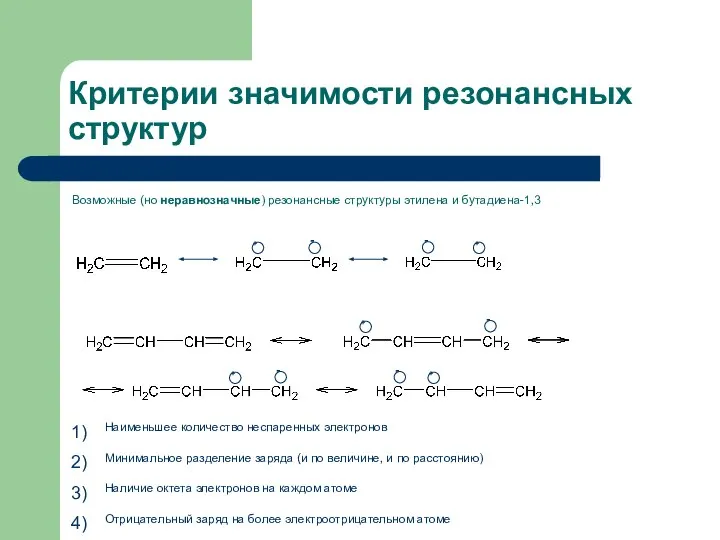
- 6. Критерии значимости резонансных структур Возможные (но неравнозначные) резонансные структуры этилена и бутадиена-1,3 Наименьшее количество неспаренных электронов
- 7. Теория резонанса развита в рамка метода ВС Распределение электронов в молекулах (сложных ионах или радикалах), является
- 9. Теория резонанса В своем простейшем виде она гласит, что если для соединения мы можем нарисовать две
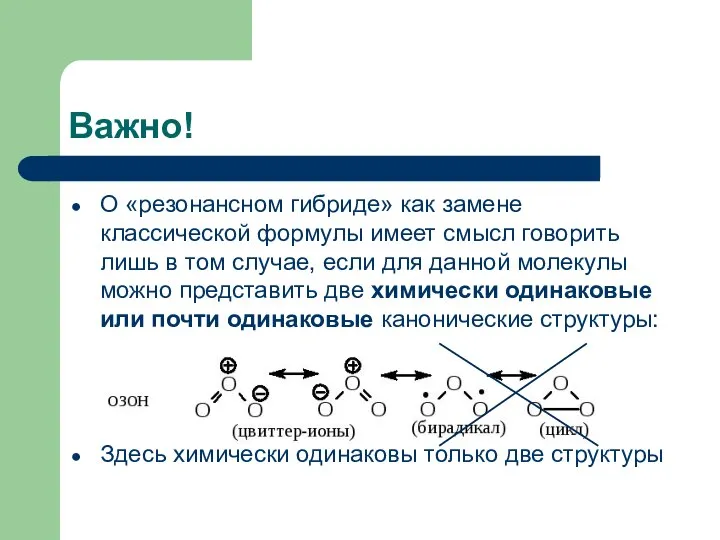
- 10. Важно! О «резонансном гибриде» как замене классической формулы имеет смысл говорить лишь в том случае, если
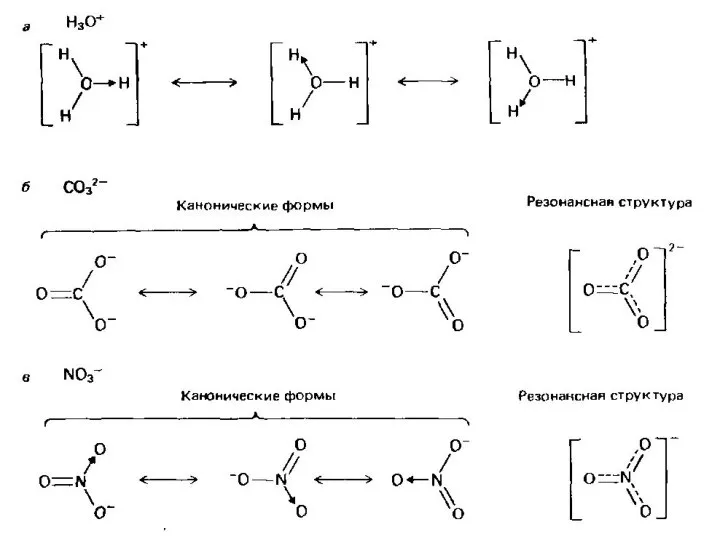
- 11. Базовые правила 1. Положение ядер во всех канонических формах должно быть одинаковым. Изомеры, в том числе
- 12. Для молекулы оксонитрида азота N2O можно записать шесть канонических форм: Реальный вклад в гибридно-резонансную структуру будут
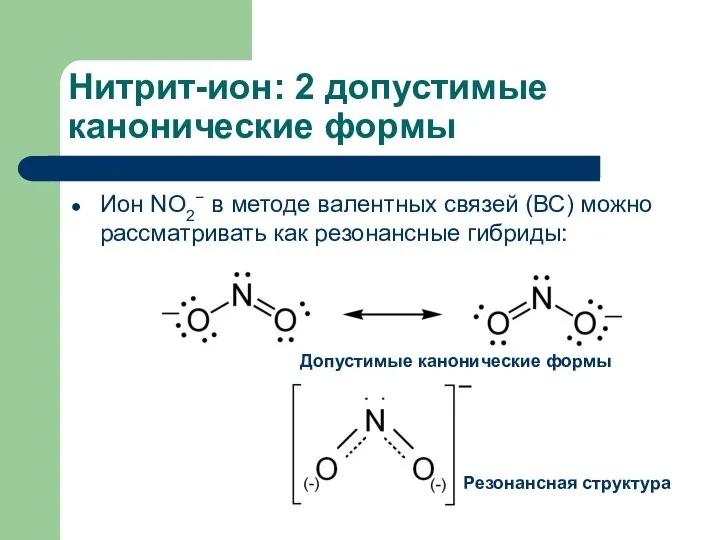
- 13. Нитрит-ион: 2 допустимые канонические формы Ион NO2− в методе валентных связей (ВС) можно рассматривать как резонансные
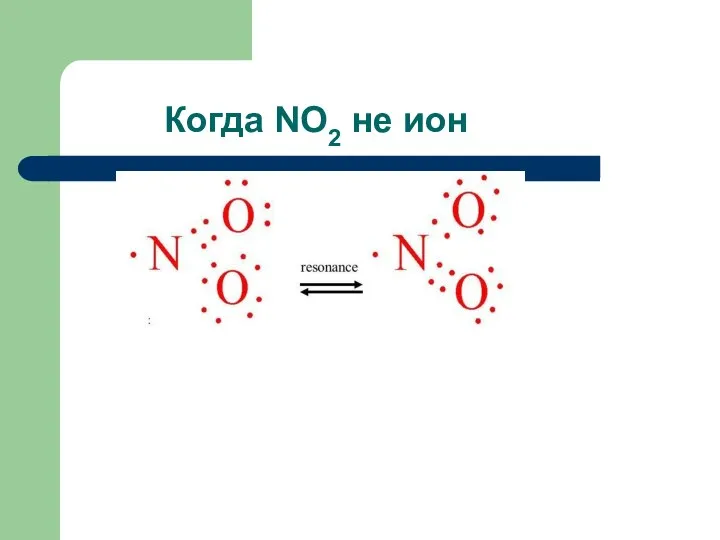
- 14. Когда NO2 не ион
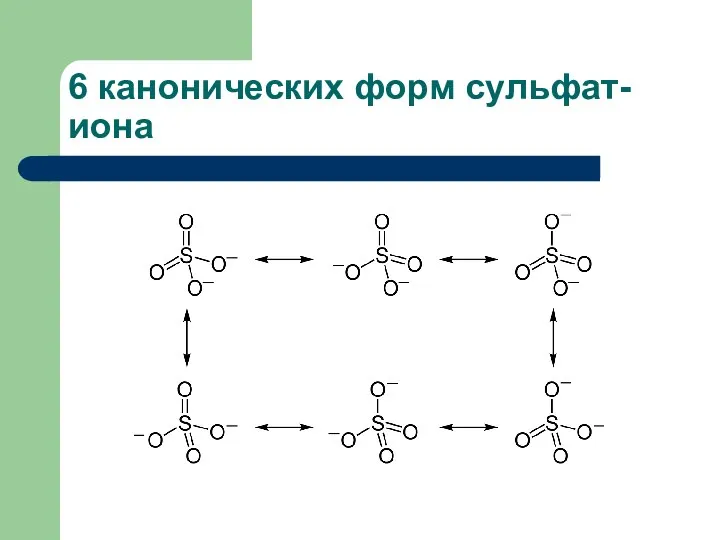
- 15. 6 канонических форм сульфат-иона
- 16. Значение электроотрицательности Почему не существует таких соединений, как H4S и H6S, где сера тоже проявляет валентность
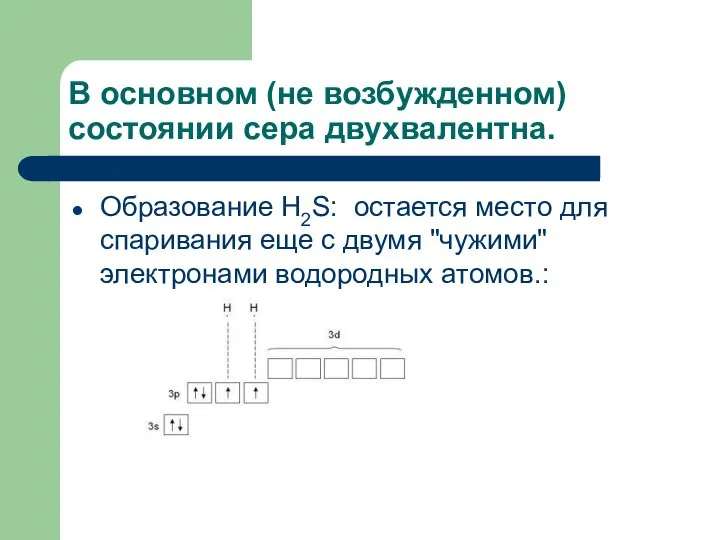
- 17. В основном (не возбужденном) состоянии сера двухвалентна. Образование H2S: остается место для спаривания еще с двумя
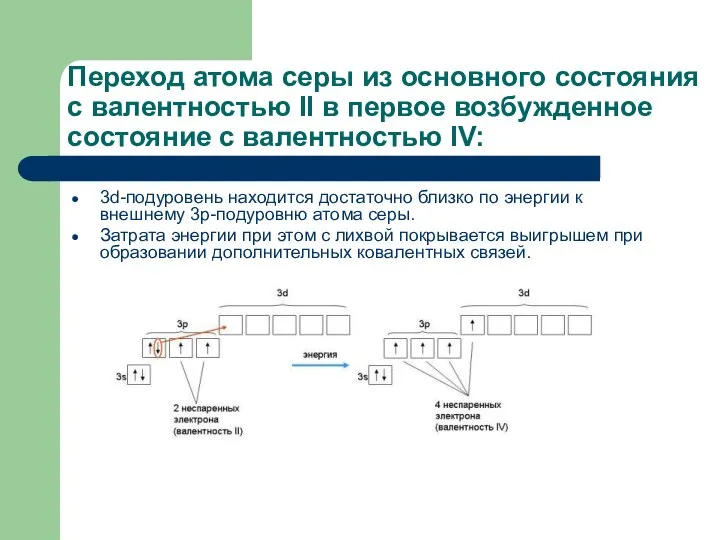
- 18. Переход атома серы из основного состояния с валентностью II в первое возбужденное состояние с валентностью IV:
- 19. Соблюдается ли правило октета? На первый взгляд, у атома серы оказывается избыток (10 электронов) и такая
- 20. Объяснение заключается в большой разнице электроотрицательностей серы (X = 2,58) и кислорода (X = 3,44) Можно
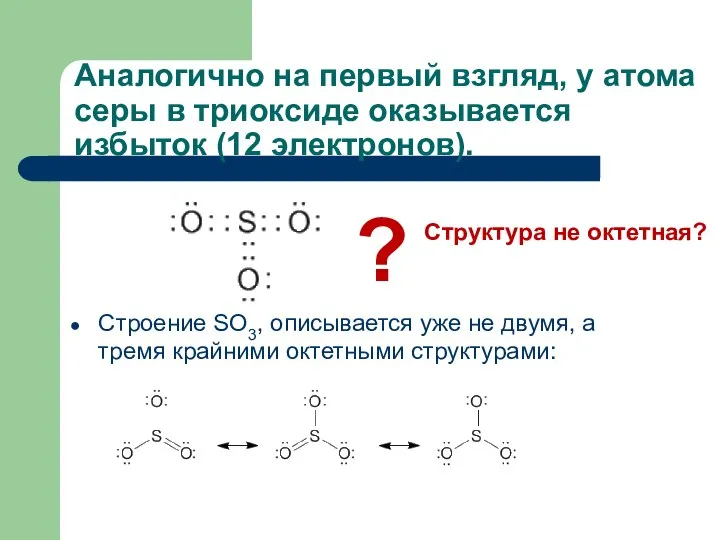
- 21. Аналогично на первый взгляд, у атома серы в триоксиде оказывается избыток (12 электронов). Строение SO3, описывается
- 22. Почему не существует H4S и H6S, где сера тоже проявляет валентность (IV) и (VI)? В этом
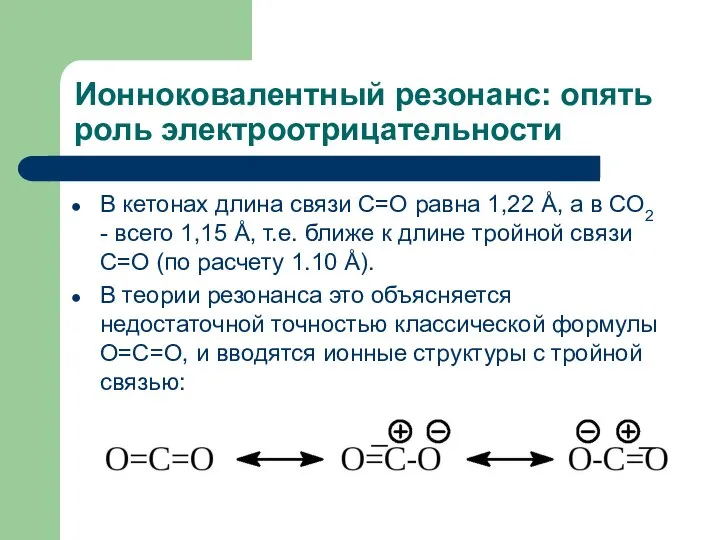
- 23. Ионноковалентный резонанс: опять роль электроотрицательности В кетонах длина связи С=О равна 1,22 Å, а в СО2
- 24. Трудности предсказания канонических форм с близкими энергиями Резонансные структуры не вытекают из квантовой механики, а в
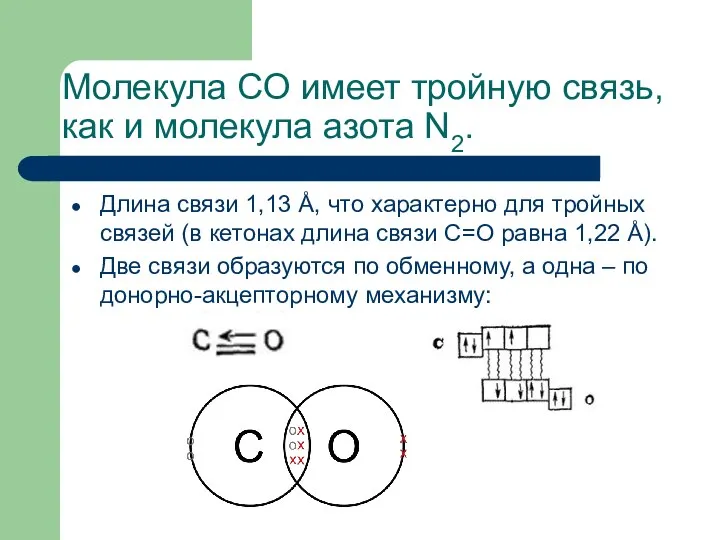
- 25. Молекула CO имеет тройную связь, как и молекула азота N2. Длина связи 1,13 Å, что характерно
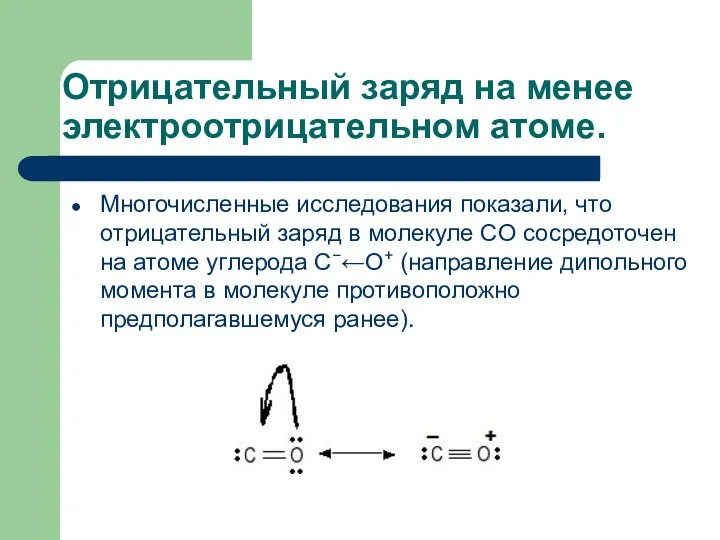
- 26. Отрицательный заряд на менее электроотрицательном атоме. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен
- 28. Скачать презентацию











 Минеральный состав пород
Минеральный состав пород Масс-спектрометрия. (Лекция 6)
Масс-спектрометрия. (Лекция 6) Методы выделения и анализа биологически активных веществ
Методы выделения и анализа биологически активных веществ Геохимические показатели техногенеза
Геохимические показатели техногенеза Принципы создания полимерных конструкционных нанокомпозитов
Принципы создания полимерных конструкционных нанокомпозитов Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения
Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения Глюкоза. Будова глюкози. Хімічні властивості глюкози
Глюкоза. Будова глюкози. Хімічні властивості глюкози Пифарнин (ribavirin)
Пифарнин (ribavirin) ПРОЕКТ ПО ХИМИИ НА ТЕМУ “СИНТЕТИЧЕСКИЕ МОЮЩИЕ СРЕДСТВА”
ПРОЕКТ ПО ХИМИИ НА ТЕМУ “СИНТЕТИЧЕСКИЕ МОЮЩИЕ СРЕДСТВА” НЕМЕТАЛИ АЗОТ
НЕМЕТАЛИ АЗОТ  Ферум. Залізо. Будова атома, фізичні і хімічні властивості
Ферум. Залізо. Будова атома, фізичні і хімічні властивості Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно
Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно Технология вакуумной перегонки мазута
Технология вакуумной перегонки мазута Дифференцированный подход в обучении химии
Дифференцированный подход в обучении химии Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом
Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом Презентация по Химии "Карбоновые кислоты" - скачать смотреть
Презентация по Химии "Карбоновые кислоты" - скачать смотреть  Каустобиолиты, горючие полезные ископаемые органического происхождения
Каустобиолиты, горючие полезные ископаемые органического происхождения Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Основания. Гидроксид алюминия
Основания. Гидроксид алюминия Коррозия металлов
Коррозия металлов Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Все о лаках для волос
Все о лаках для волос Законы Авогадро и Дальтона
Законы Авогадро и Дальтона Применение 3D-принтеров для решения химических задач
Применение 3D-принтеров для решения химических задач Тесты для самопроверки
Тесты для самопроверки Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Биосинтез холестерина, жирных кислот. Липопротеины. Регуляция и патология липидного обмена
Биосинтез холестерина, жирных кислот. Липопротеины. Регуляция и патология липидного обмена Химическая термодинамика и биоэнергетика. Первый закон термодинамики
Химическая термодинамика и биоэнергетика. Первый закон термодинамики