Содержание
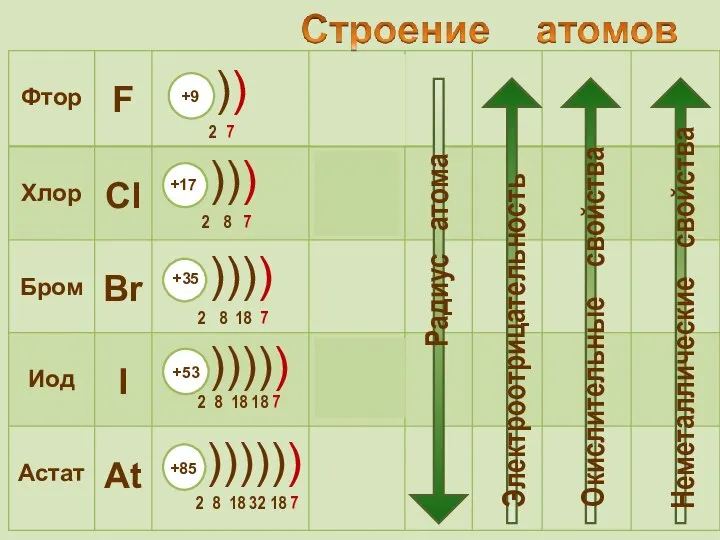
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. В свободном виде не встречаются
- 4. Галит NaCl
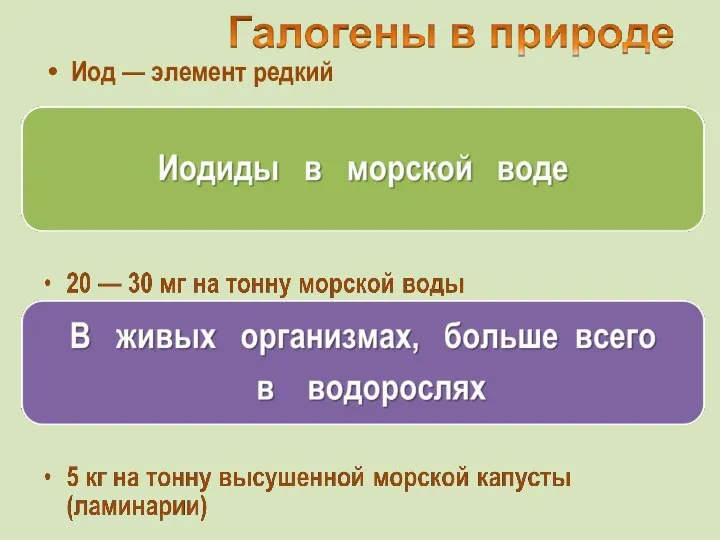
- 6. Иод — элемент редкий
- 9. Название "фтор" (от греческого phthoros - разрушение, гибель) Ни один из химических элементов не принес химикам
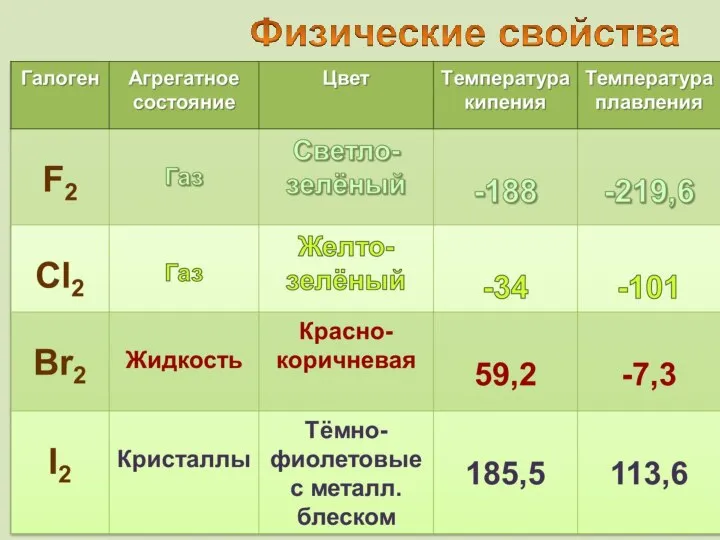
- 10. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
- 11. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79Вr (50,56%) 81Вr (49,44%) пары
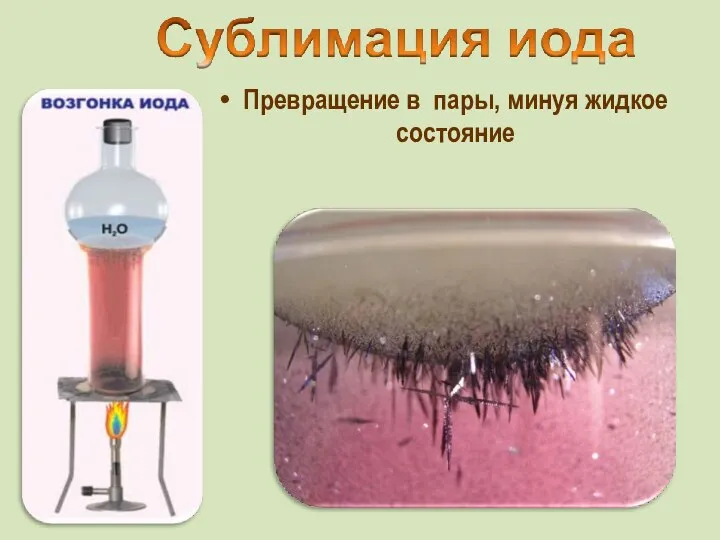
- 12. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 13. Превращение в пары, минуя жидкое состояние
- 14. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
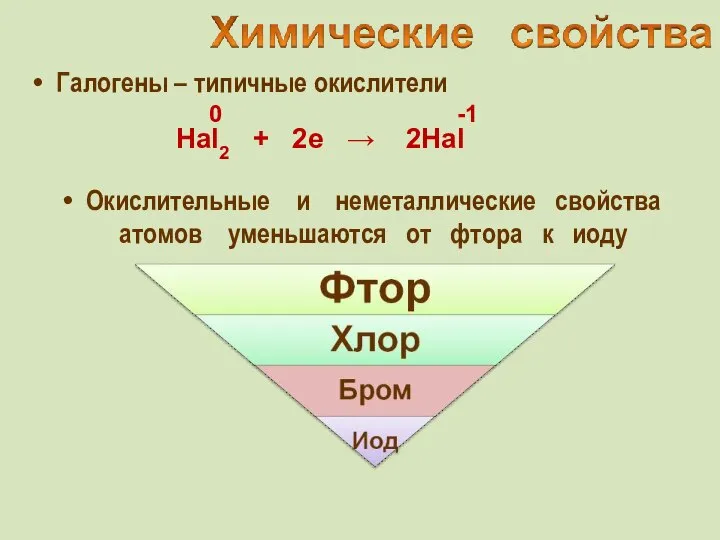
- 15. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
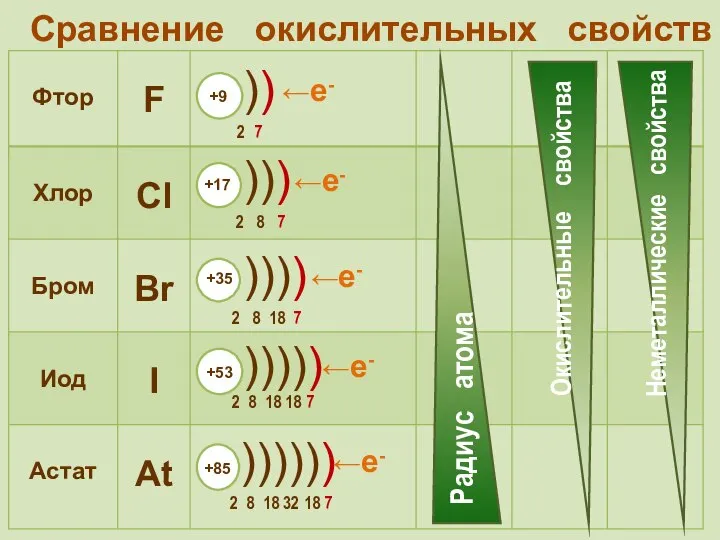
- 16. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
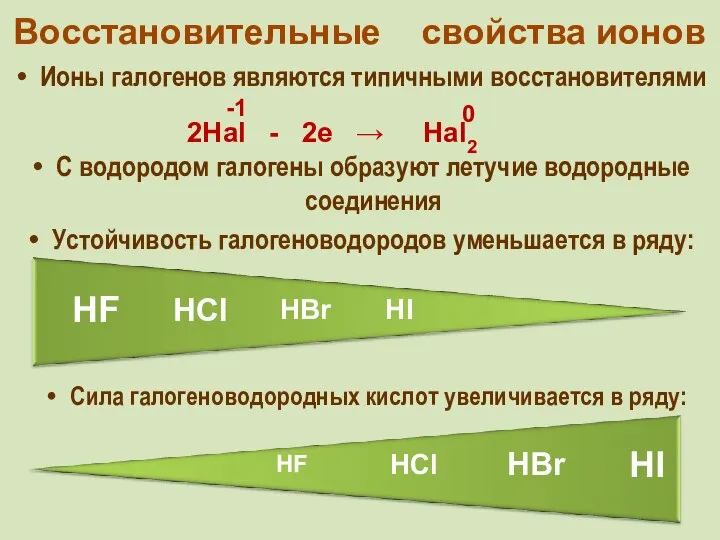
- 17. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
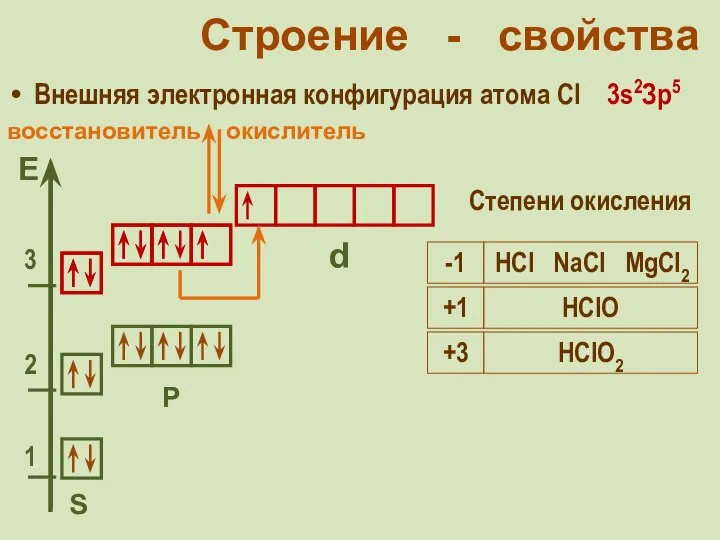
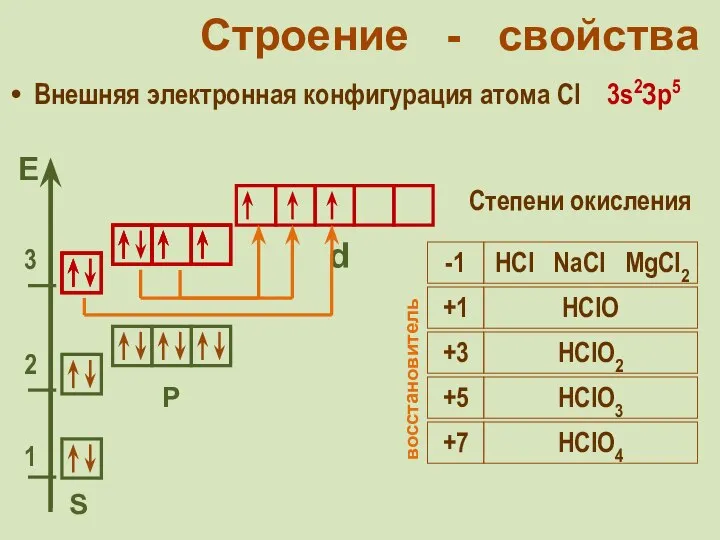
- 18. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления окислитель -1
- 19. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления -1 HCl
- 20. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
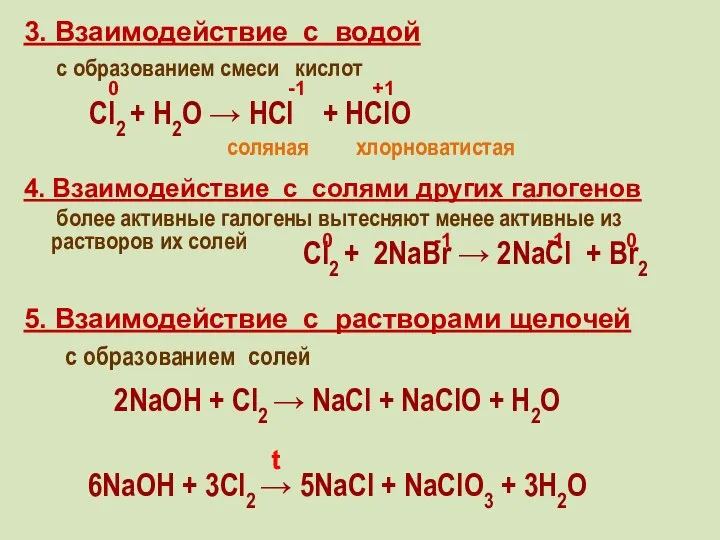
- 21. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 22. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
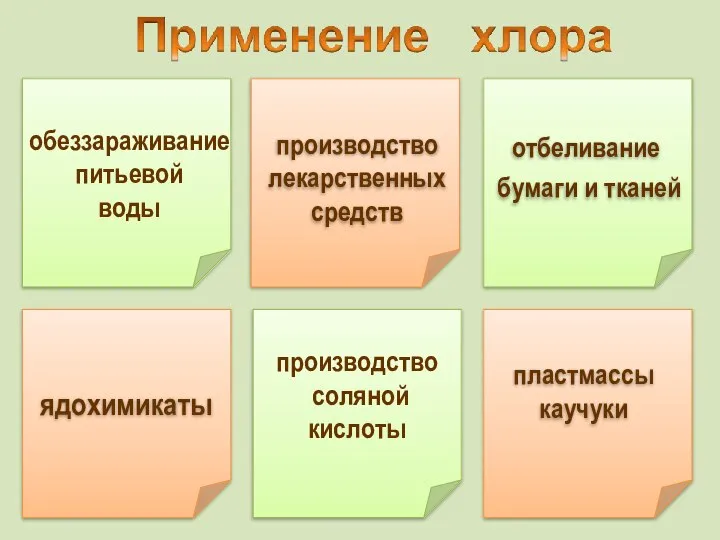
- 23. производство соляной кислоты
- 24. - 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и
- 25. Что значит название «Галогены»? В чём сходство электронного строения этих элементов? Какие свойства в окислительно-восстановительном плане
- 28. Скачать презентацию














 Флюорит
Флюорит VI A-ХАЛЬКОГЕНЫ О-кислород S-сера Se-селен Te-теллур Ро-полоний VI B Cr-хром Мо-молибден W-вольфрам Rf-резерфордий
VI A-ХАЛЬКОГЕНЫ О-кислород S-сера Se-селен Te-теллур Ро-полоний VI B Cr-хром Мо-молибден W-вольфрам Rf-резерфордий Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Дисперсные системы и растворы
Дисперсные системы и растворы Электронное строение атома. Лекция № 2
Электронное строение атома. Лекция № 2 Газ ацетилен
Газ ацетилен Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Cкорость химической реакции
Cкорость химической реакции Минералы и горные породы Крыма
Минералы и горные породы Крыма Вітаміни. Їх роль у життєдіяльності людини
Вітаміни. Їх роль у життєдіяльності людини Углеводы. Глюкоза. ЗНАНИЯ, НЕПРОВЕРЕННЫЕ ОПЫТОМ, МАТЕРЬЮ ВСЯКОЙ ДОСТОВЕРНОСТИ, БЕСПЛОДНЫ И ПОЛНЫ ОШИБОК ЛЕОНАРДО ДА ВИНЧИ
Углеводы. Глюкоза. ЗНАНИЯ, НЕПРОВЕРЕННЫЕ ОПЫТОМ, МАТЕРЬЮ ВСЯКОЙ ДОСТОВЕРНОСТИ, БЕСПЛОДНЫ И ПОЛНЫ ОШИБОК ЛЕОНАРДО ДА ВИНЧИ  Химиялык кару
Химиялык кару Электронное строение атомов элементов
Электронное строение атомов элементов Экскурсия по химическому факультету
Экскурсия по химическому факультету Оборудование, инструмент и приспособления, белье для химической завивки
Оборудование, инструмент и приспособления, белье для химической завивки Презентация по Химии "Уран" - скачать смотреть
Презентация по Химии "Уран" - скачать смотреть  Основные законы химии
Основные законы химии Что такое нефть и как она появилась?
Что такое нефть и как она появилась? Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов
Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов Химический состав фракций нефти
Химический состав фракций нефти Презентация Щелочные металлы
Презентация Щелочные металлы  Воздух, его состав и значение
Воздух, его состав и значение Алифатические углеводороды. Алканы, их свойства
Алифатические углеводороды. Алканы, их свойства Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Біофармація – теоретичні основи оптимального виробництва лікарських засобів
Біофармація – теоретичні основи оптимального виробництва лікарських засобів Классификация химических реакций
Классификация химических реакций