Содержание
- 2. Повторение Число электронов в атоме элемента = числу протонов = заряду ядра атома = порядковому номеру
- 3. Повторение Число электронов в наружном слое атомов элементов = номеру группы, в котором находится элемент. (Для
- 4. Распределение электронов по уровням N=2n2 формула для вычисления количества электронов на энергетических уровнях. 1Й уровень -
- 5. Распределение электронов по уровням 1 уровень: 2ē
- 6. Распределение электронов по уровням 1 уровень: 2ē 2 уровень:8ē
- 7. Распределение электронов по уровням 1 уровень-2 2 уровень-8 3 уровень-18
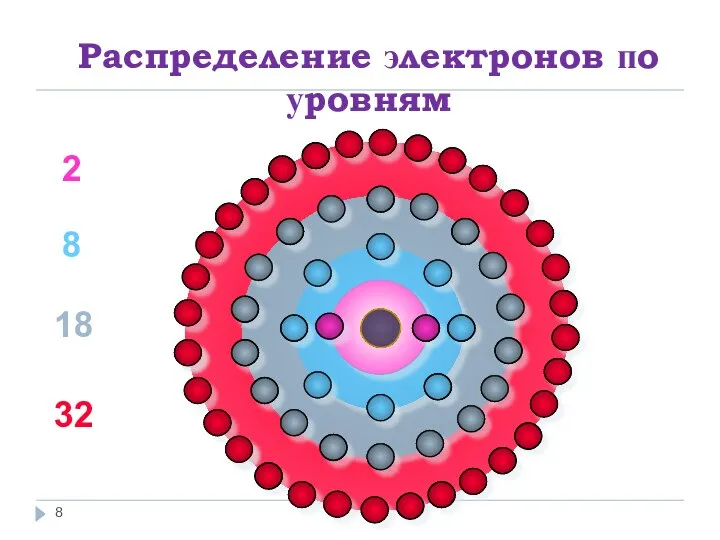
- 8. Распределение электронов по уровням 2 8 18 32
- 9. s- электронное облако Форма s-электронного облака - шар. На нем 1-2 электрона.
- 10. p- электронное облако Форма p-электронного облака - объёмная восьмёрка. На нем от 1 до 6 электронов.
- 11. d- электронное облако Форма d-электронных облаков - две объемные восьмёрки. На нем от 1 до 10
- 12. f- электронное облако Форма f-электронных облаков сложная и в школьных учебниках не приводится. На них от
- 13. Атом водорода Электрон этого атома при вращении образует сферическое облако. +1 Н )1 это схема строения
- 14. Атом гелия +2 Не )2 это схема строения атома. 1s2 это электронная формула атома. Здесь два
- 15. Атом лития +3 Li )2)1 это схема строения атома. 1s2 2s1 это электронная формула. Элемент располагается
- 16. Атом бериллия +4 Be )2 )2 это схема строения атома. 1s2 2s2 это электронная формула. В
- 17. Атом углерода +6 С ) 2 ) 4 схема строения атома. 1s2 2s 2 2p2 электронная
- 18. Атом хлора +17 Cl )2 )8 )7 схема строения атома. 1s2 2s2 2p6 3s2 3p5 это
- 19. Заключение Существуют s, p, d, f электроны. Электроны располагаются вокруг ядра слоями (уровнями). Электроны распределяются по
- 21. Скачать презентацию

















 Презентация Соединения химических элементов 8 класс.
Презентация Соединения химических элементов 8 класс.  Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть
Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть  Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Электроды 1 рода
Электроды 1 рода Анилин. История создания
Анилин. История создания Применение кремния
Применение кремния Состав, свойства и перегонка нефти. Нефтепродукты
Состав, свойства и перегонка нефти. Нефтепродукты Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Предельные углеводороды
Предельные углеводороды Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Курс хімії за 11 клас
Курс хімії за 11 клас Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Химия ғажайыптар әлемі
Химия ғажайыптар әлемі КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n
КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія
Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія  Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Качественные и количественные методы обработки хроматограмм
Качественные и количественные методы обработки хроматограмм Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment
Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment Оксид цинка
Оксид цинка Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть
Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть  Презентация по Химии "«Основания»" - скачать смотреть
Презентация по Химии "«Основания»" - скачать смотреть  Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск
Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск Сверхпроводимость как явление микромира
Сверхпроводимость как явление микромира Электролиз. Урок химии 11 класс
Электролиз. Урок химии 11 класс Неорганические соединения галогенов
Неорганические соединения галогенов