Галогены. Хлороводород, соляная кислота и хлориды. Биологическая роль йода в жизнедеятельности человека
Содержание
- 2. «Строение и свойства галогенов». *
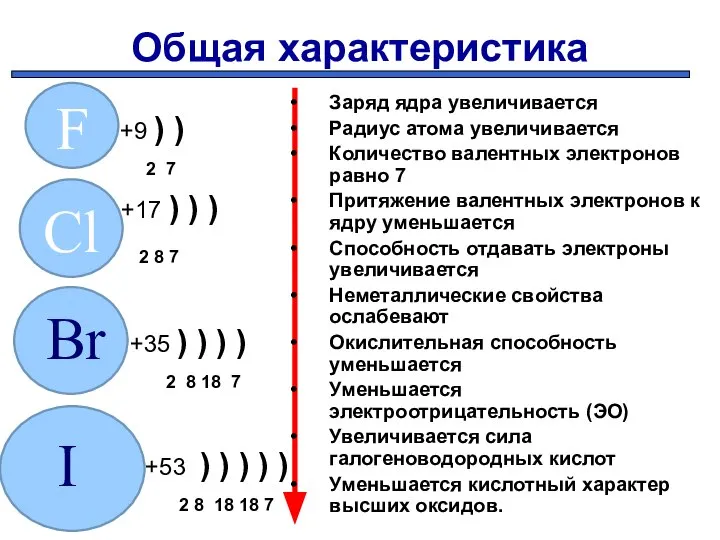
- 3. Общая характеристика +9 ) ) 2 7 +17 ) ) ) 2 8 7 +35 )
- 4. Галогены Положение галогенов в ПСХЭ
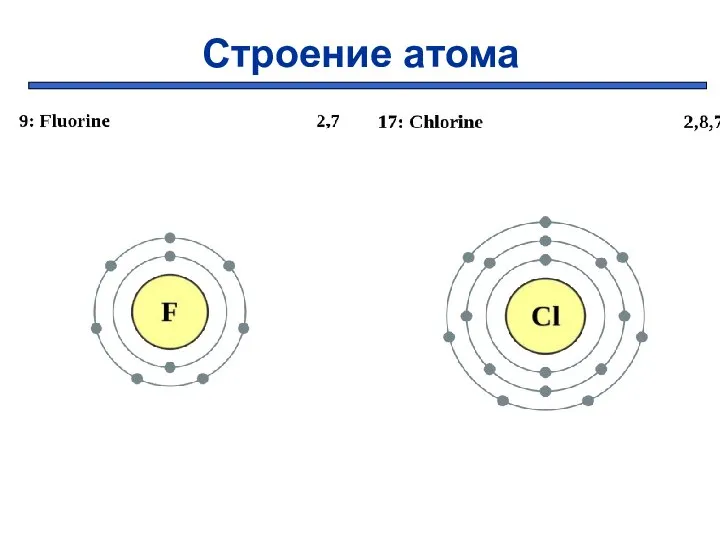
- 5. Строение атома
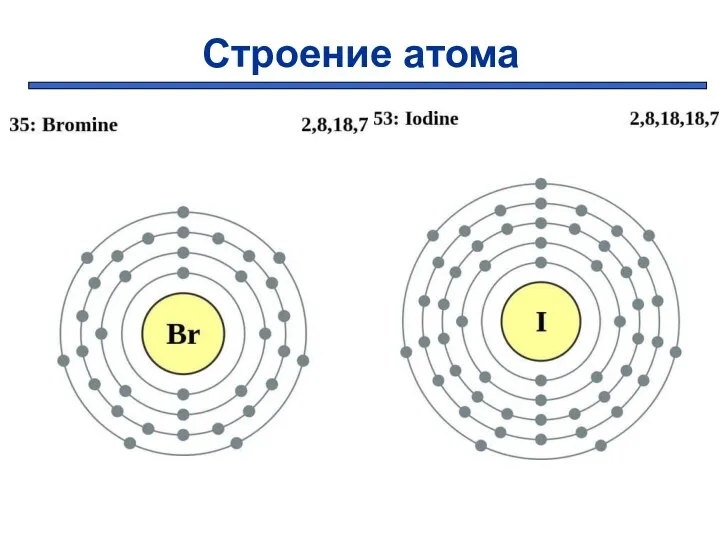
- 6. Строение атома
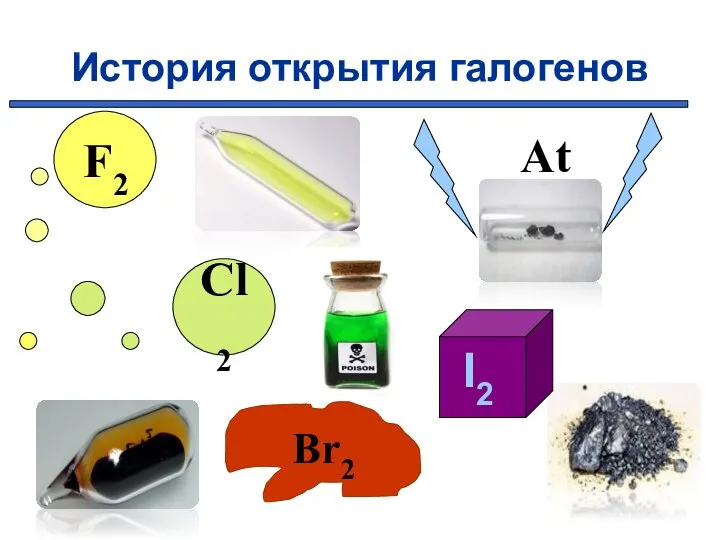
- 7. История открытия галогенов Cl2 At
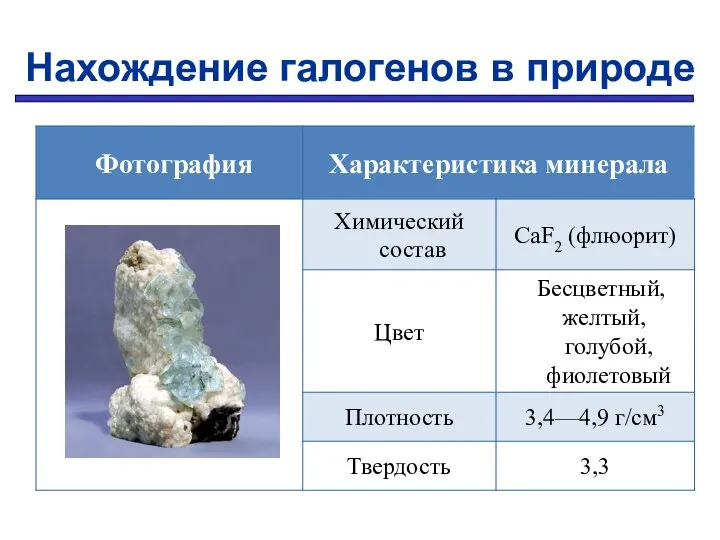
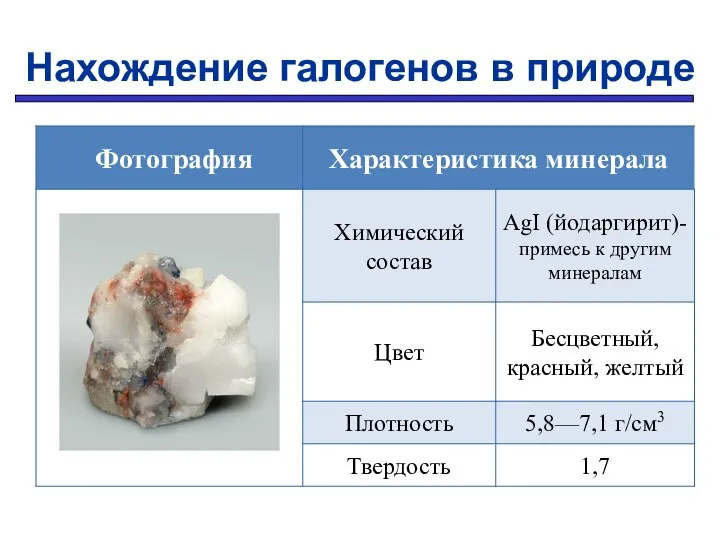
- 8. Нахождение галогенов в природе
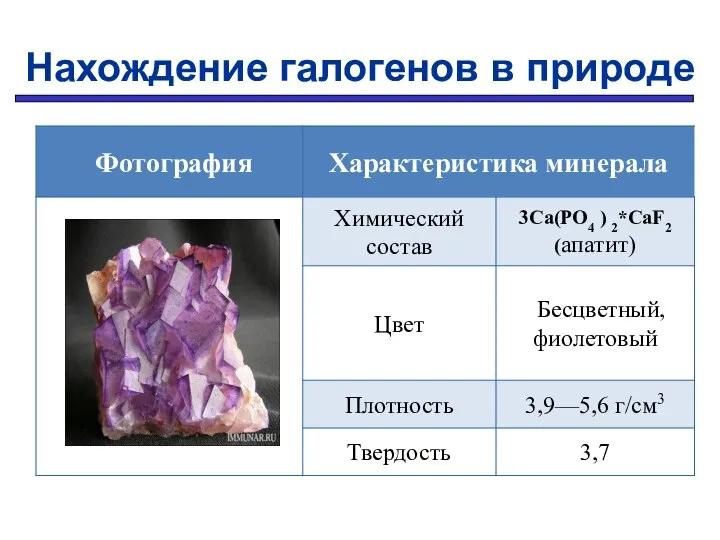
- 9. Нахождение галогенов в природе
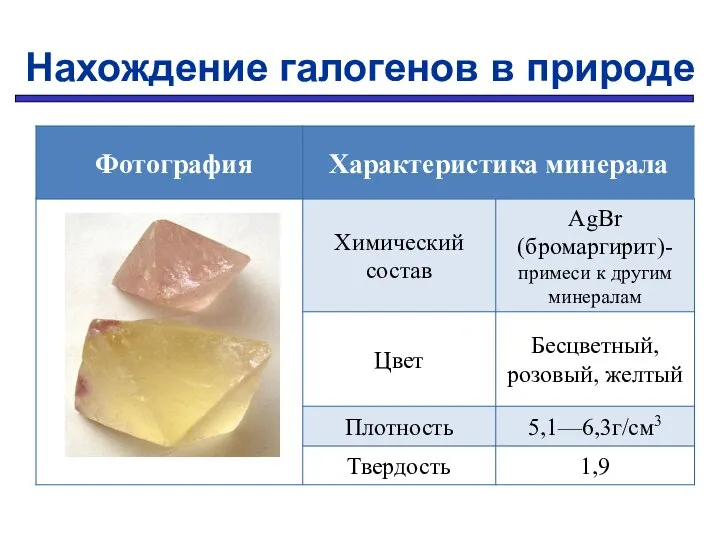
- 10. Нахождение галогенов в природе
- 11. Нахождение галогенов в природе
- 12. Нахождение галогенов в природе
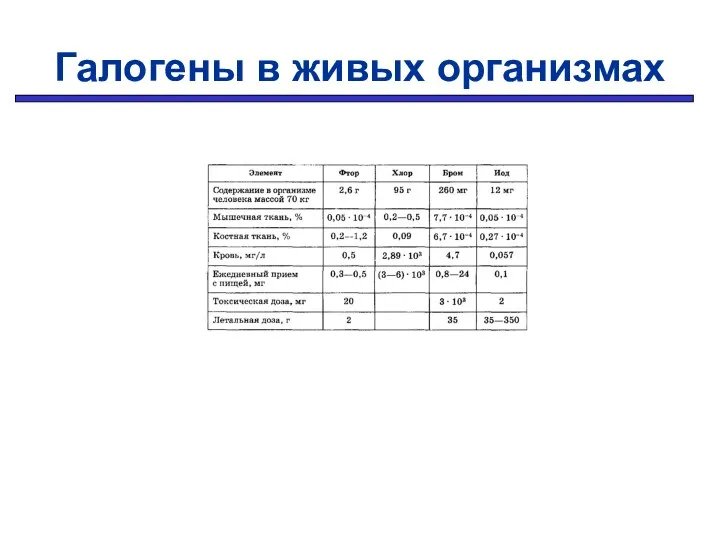
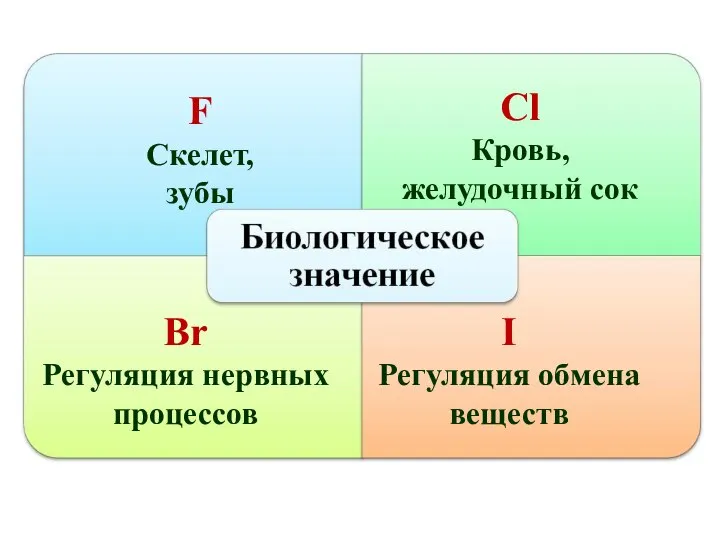
- 13. Галогены в живых организмах
- 14. ФТОР Группы элементов I III II VIII IV V VI VII II I III VII VI
- 15. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 16. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 17. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 18. Группы элементов I III II VIII IV V VI VII II I III VII VI V
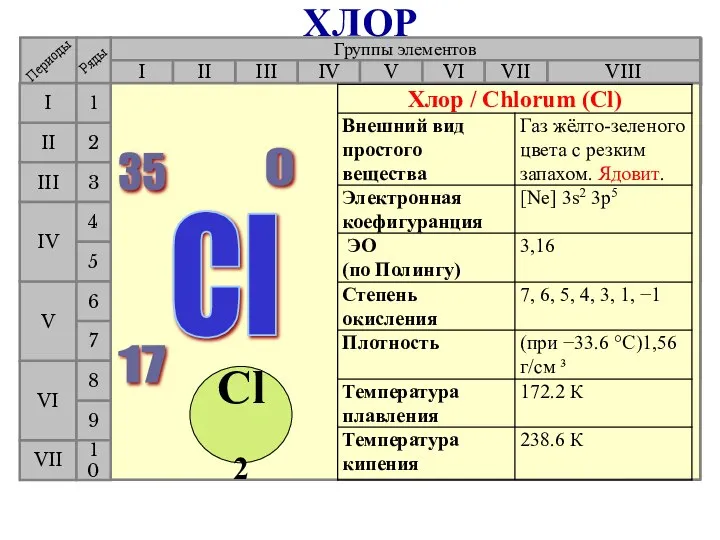
- 19. Галогены
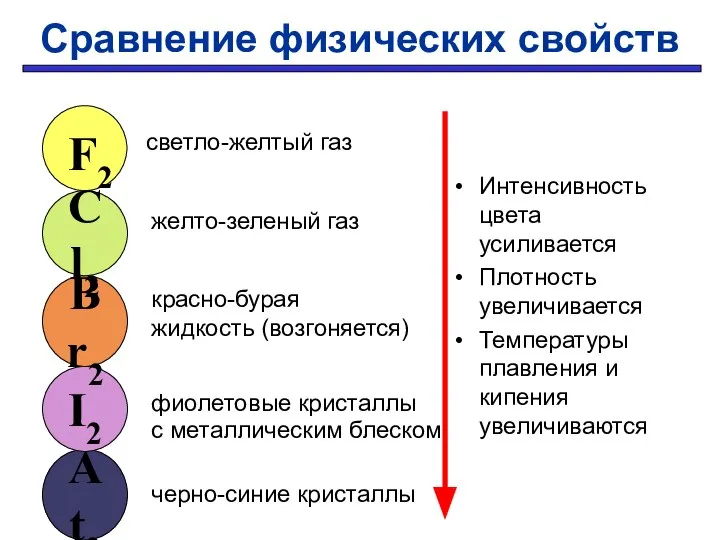
- 20. Сравнение физических свойств Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются At2 I2 Br2
- 21. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
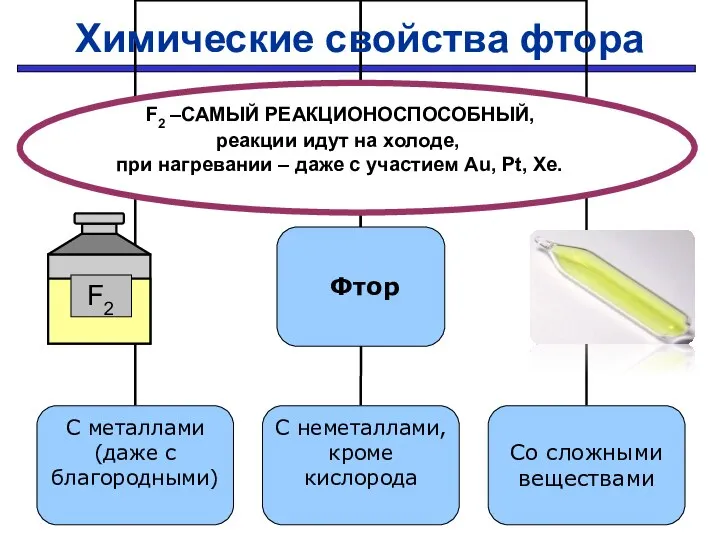
- 22. Проверить F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ, реакции идут на холоде, при нагревании – даже с участием Au, Pt,
- 23. С простыми веществами: С МЕталлами С Неметаллами 2Na + F2 → 2NaF H2 + F2 →
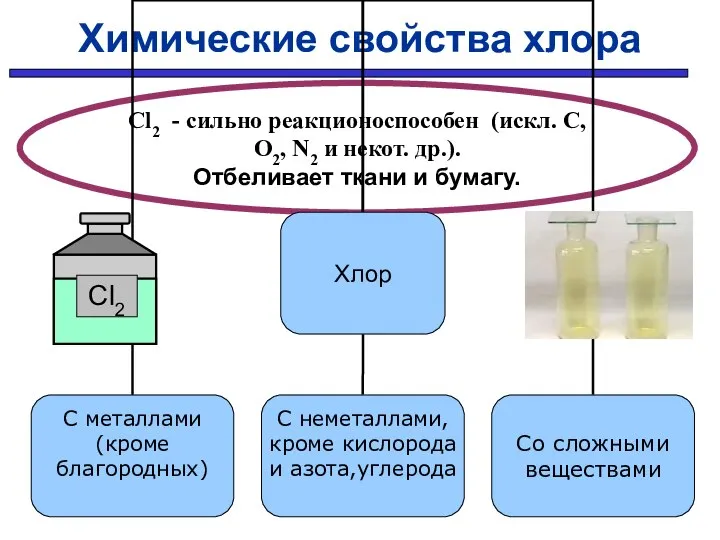
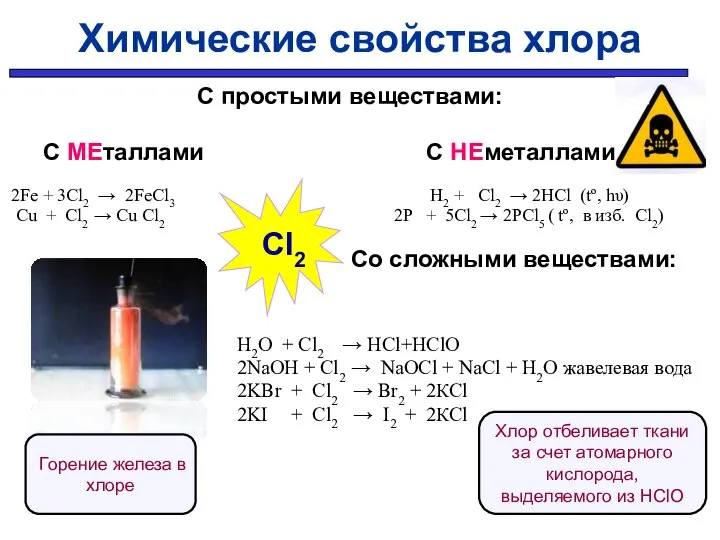
- 24. Химические свойства хлора Cl2 - сильно реакционоспособен (искл. C, O2, N2 и некот. др.). Отбеливает ткани
- 25. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 →
- 26. Химические свойства брома Br2 - умеренно реакционоспособен. Вытесняется из солей фтором и хлором.
- 27. С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Br2 → 2FeBr3 H2 + Br2 →
- 28. Химические свойства йода I2 - мало реакционоспособен. Вытесняется из солей фтором, хлором и бромом.
- 29. С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 →
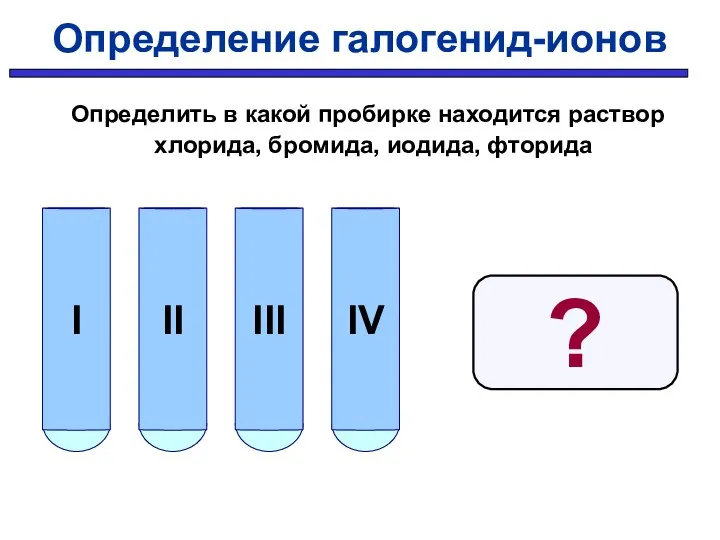
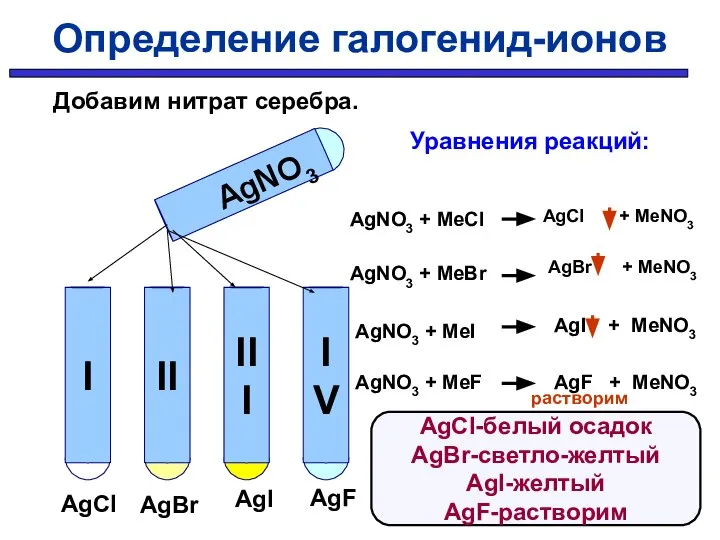
- 30. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
- 31. AgNO3 AgCl AgBr AgI AgF Уравнения реакций: AgNO3 + MeCl AgNO3 + MeBr AgNO3 + MeI
- 32. F Скелет, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
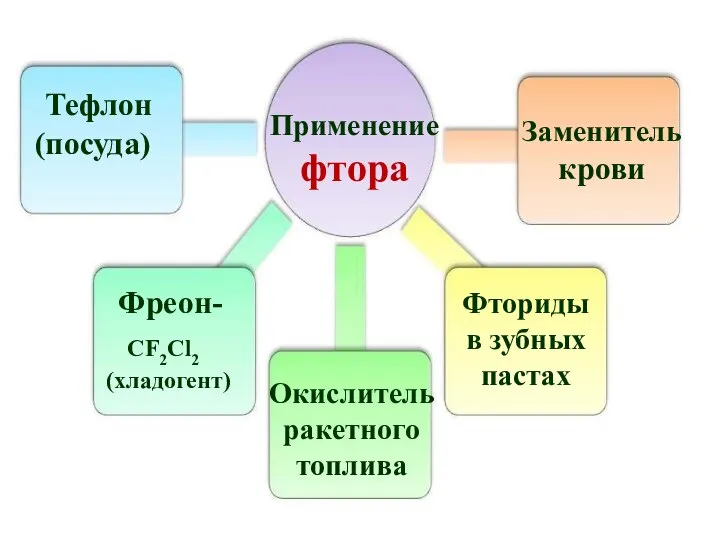
- 33. Применение фтора Тефлон (посуда) Фреон- CF2Cl2 (хладогент) Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
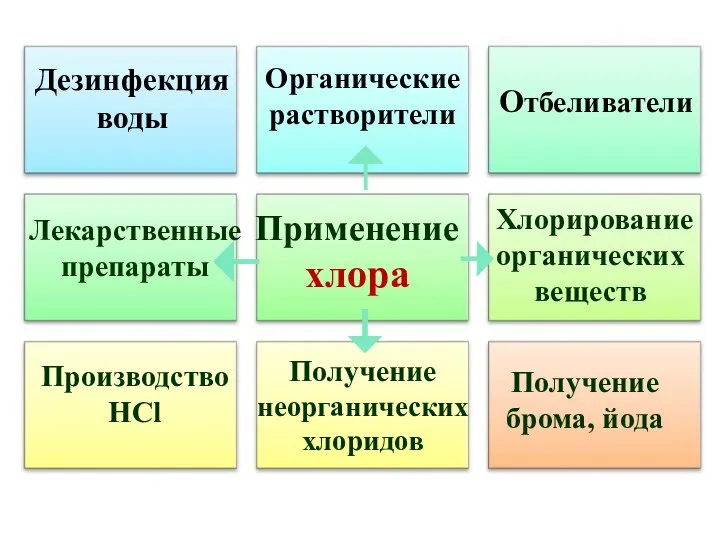
- 34. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
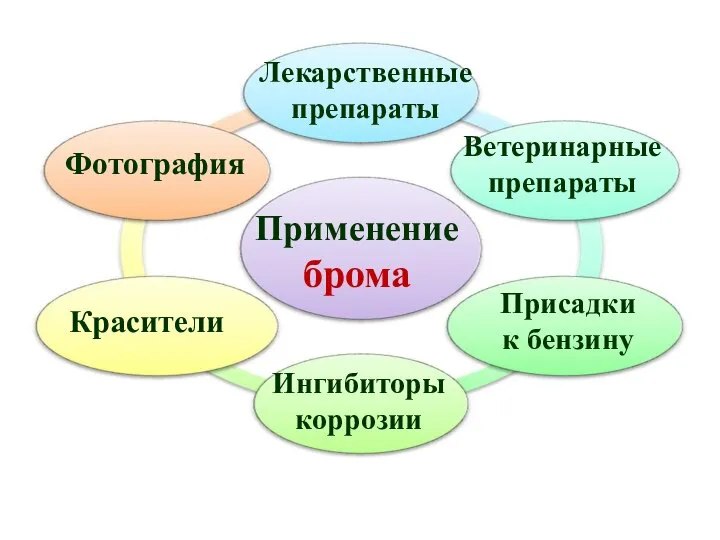
- 35. Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы коррозии Присадки к бензину
- 37. Скачать презентацию













 Камни и Водолей
Камни и Водолей Хімія і екологія Підготувала учениця 11 класу Плоска Ярина
Хімія і екологія Підготувала учениця 11 класу Плоска Ярина  Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно
Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти
Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти Радиоуглеродный метод
Радиоуглеродный метод Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Белки - 4. Обмен сложных белков. Нуклеопротеиды
Белки - 4. Обмен сложных белков. Нуклеопротеиды Углерод и его соединения
Углерод и его соединения Горные породы и минералы. Камни-самоцветы
Горные породы и минералы. Камни-самоцветы Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика
Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева
Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Окисно-відновні процеси
Окисно-відновні процеси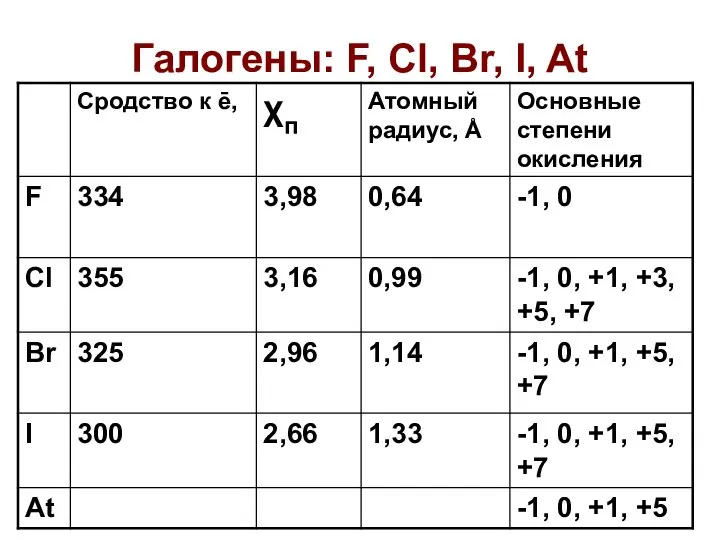 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Вопросительное местоимение КТО
Вопросительное местоимение КТО Химическая кинетика
Химическая кинетика Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе Выращивание кристалла
Аттестационная работа. Методическая разработка защиты проекта по исследовательской работе Выращивание кристалла Азотные удобрения
Азотные удобрения Основания Химия 8 класс
Основания Химия 8 класс Электронная формула химических элементов
Электронная формула химических элементов Химическое производство и химический процесс. (Тема 1)
Химическое производство и химический процесс. (Тема 1) Практическая работа №1. Приготовление растворов с заданной молярной концентрацией
Практическая работа №1. Приготовление растворов с заданной молярной концентрацией Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Структуры в сталях
Структуры в сталях Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В
Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Презентация по Химии "Технологиии деятельностно-компетентностного подхода" - скачать смотреть
Презентация по Химии "Технологиии деятельностно-компетентностного подхода" - скачать смотреть  Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест
Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест