Содержание
- 2. План лекции Строение атома Возможные степени окисления Способы получения галогенов Водородные соединения галогенов Хлорная вода Хлорная
- 3. Строение атома ns2np5- внешний эл. слой F 1s22s22p5 Cl 1s22s22p63s23p5 Br 1s22s22p63s23p63d104s24p5 I 1s22s22p63s23p63d104s24p64d105s25p5 Радиус атома
- 4. Степень окисления F : -1, 0 F2 - окислитель ( ядовит, не имеет цвета и запаха)
- 5. Cl ; Br ; I
- 6. Получение галогенов Получение F2 - электролиз р-ра HF 2HF эл-з (KF) H2 + F2
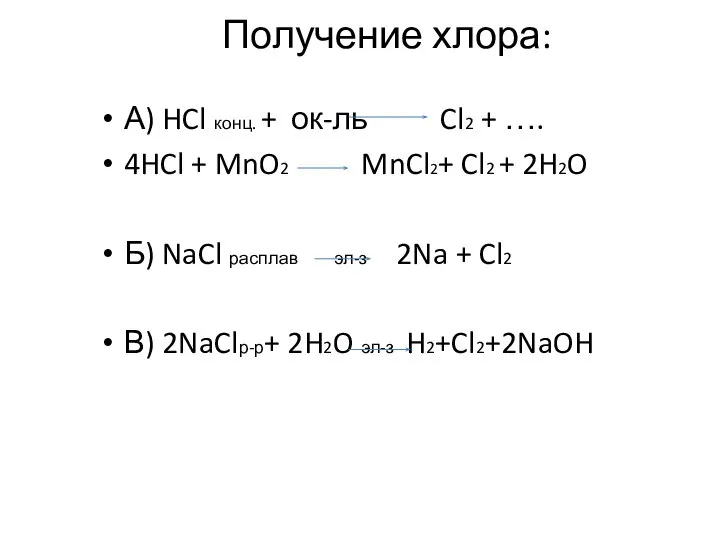
- 7. Получение хлора: А) HCl конц. + ок-ль Cl2 + …. 4HCl + MnO2 MnCl2+ Cl2 +
- 8. Получение брома и йода: Br2 и I2 (из растворов солей) 2NaBr + Cl2 2NaCl + Br2
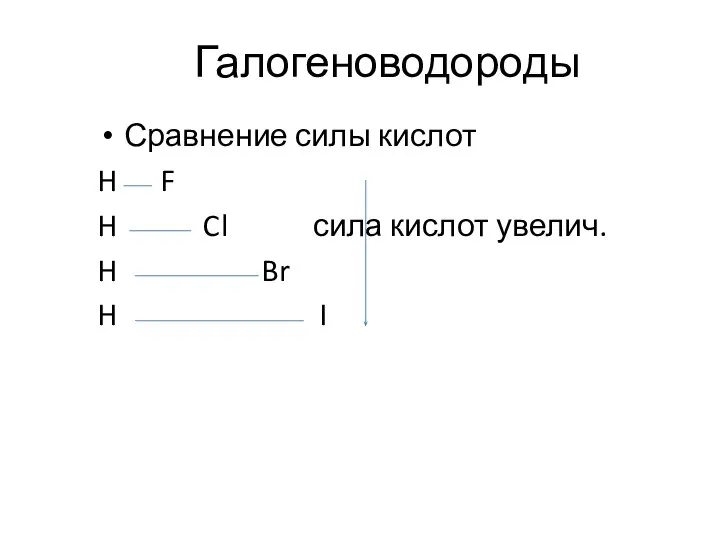
- 9. Галогеноводороды Сравнение силы кислот H F H Cl сила кислот увелич. H Br H I
- 10. Сравнение восстановительной силы галогенид -ионов F +9))8e Cl +17)))8e восст. способность увеличивается Br +35 ))))8e I
- 11. Сравнение окислительной способности атомов галогенов F +9))7e Cl +17)))7e окислительная способность увеличивается Br +35 ))))7e I
- 12. Хлорная вода Получение: Cl2 + H2O холод НCl + HСlO Свойства : HСlO свет НCl +
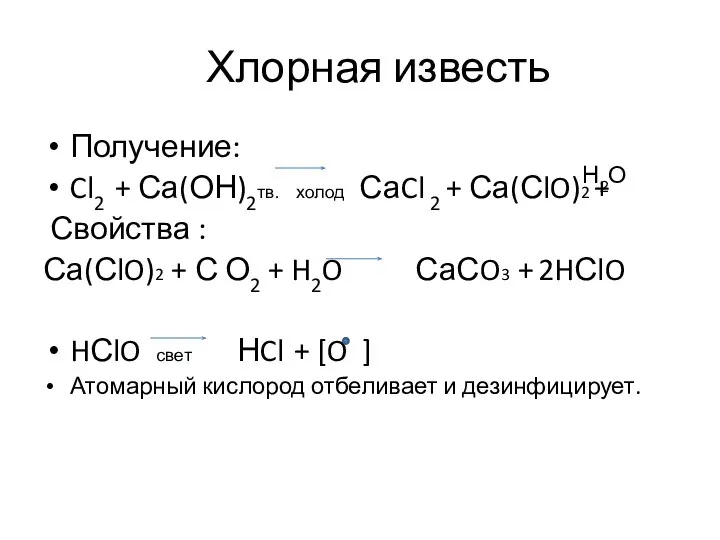
- 13. Хлорная известь Получение: Cl2 + Са(ОН)2тв. холод СаCl 2 + Са(СlO)2 + Свойства : Са(СlO)2 +
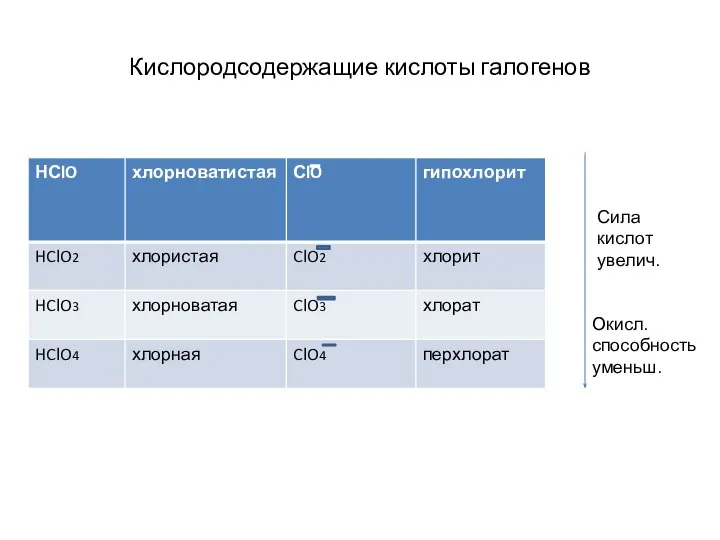
- 14. Кислородсодержащие кислоты галогенов Сила кислот увелич. Окисл. способность уменьш.
- 16. Скачать презентацию









 Биотехнология аминокислот и витаминов
Биотехнология аминокислот и витаминов Умный йод
Умный йод Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Синтетичні мийні засоби. Мило.Склад. Підготувала:Кузнецова Поліна 42 група
Синтетичні мийні засоби. Мило.Склад. Підготувала:Кузнецова Поліна 42 група  Химия – это просто! Живые модели
Химия – это просто! Живые модели Йод в организме человека
Йод в организме человека Химиялық қоспалар
Химиялық қоспалар Художественное и технологическое
Художественное и технологическое Уран. Получение урана
Уран. Получение урана Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти
Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти Изучение взаимодействия 2-(2-оксоциклогексил)-циклогексанона с пероксидом водорода в кислой среде
Изучение взаимодействия 2-(2-оксоциклогексил)-циклогексанона с пероксидом водорода в кислой среде Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Основания, их классификация и свойства (8 класс)
Основания, их классификация и свойства (8 класс) Сложные эфиры
Сложные эфиры СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г.
СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г. Гетероатомные соединения нефти
Гетероатомные соединения нефти Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть
Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть  Сложные эфиры
Сложные эфиры Ориентационная вытяжка полимеров
Ориентационная вытяжка полимеров Технология производства простых полиэфиров
Технология производства простых полиэфиров Химические свойства спиртов
Химические свойства спиртов Презентация по Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими
Презентация по Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими The development of nanoporous hydrogen storages
The development of nanoporous hydrogen storages Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Характеристика шкідливих хімічних речовин, забруднювачів атмосфери
Характеристика шкідливих хімічних речовин, забруднювачів атмосфери Метанол. Способы получения
Метанол. Способы получения Дәнді-дақылдар тыңайтқыштары
Дәнді-дақылдар тыңайтқыштары