Содержание
- 2. 4 период VIII группа побочная подгруппа +26Fe 2ē , 8ē , 14ē , 2ē Характерные степени
- 3. Природные соединения железа - магнетит - гематит - лимонит - пирит В водах многих минеральных источников
- 4. Магнетит (магнитный железняк) Fe3O4 (Fe2O3 · FeO) - содержит до 72% железа; - важнейшие месторождения в
- 5. Гематит (красный железняк, железный блеск) Fe2O3 - содержит до 65% железа; - важнейшие месторождения в России
- 6. Лимонит (бурый железняк) - содержит до 60% железа; - важнейшие месторождения в России – Урал, Забайкалье,
- 7. Пирит (железный или серный колчедан) - содержит до 47% железа; - важнейшие месторождения в России –
- 8. Физические свойства - серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород;
- 9. Получение железа 1. Алюминотермия. Fe2O3 + 2 AI = AI2O3 + 2 Fe 2. Прямое восстановление
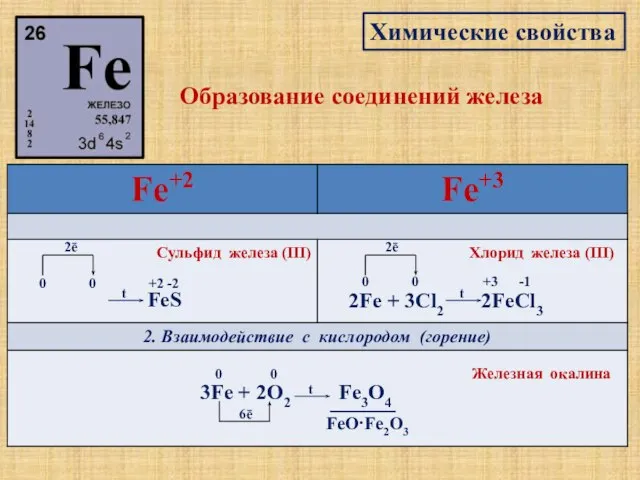
- 10. Химические свойства Образование соединений железа 1. Взаимодействие с неметаллами Fe + S 0 0 2ē t
- 11. Химические свойства Образование соединений железа 3Fe + 4H2O Fe3O4 + 4H2↑ +1 0 -2 +2 +3
- 12. Химические свойства Образование соединений железа Fe + 2HCl → FeCl2 + H2↑ 0 +1 0 -1
- 13. Химические свойства Образование соединений железа 2Fe+6H2SO4→Fe2(SO4)3+3SO2↑+6H2O +3 +4 +6 0 Fe+4HNO3→Fe(NO3)3+NO↑+2H2O 0 +5 +3 +2 t
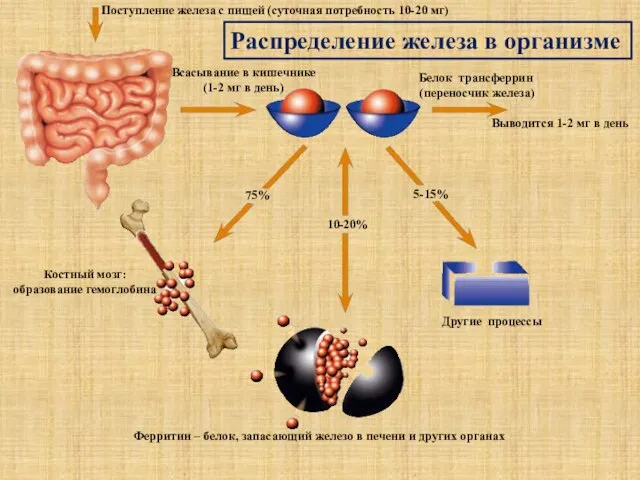
- 14. Поступление железа с пищей (суточная потребность 10-20 мг) Всасывание в кишечнике (1-2 мг в день) Белок
- 16. Скачать презентацию











 Оксиды. Классификация
Оксиды. Классификация Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи
Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи  Характеристика шкідливих хімічних речовин, забруднювачів атмосфери
Характеристика шкідливих хімічних речовин, забруднювачів атмосфери Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Инструктаж Правила поведения на каникулах
Инструктаж Правила поведения на каникулах  Цікаві факти про хімію
Цікаві факти про хімію Структура периодической системы элементов
Структура периодической системы элементов Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Предмет химии. Вещества
Предмет химии. Вещества Методы исследования наноструктурных композиционных электродов
Методы исследования наноструктурных композиционных электродов Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Презентация по Химии "Мило" - скачать смотреть бесплатно
Презентация по Химии "Мило" - скачать смотреть бесплатно Бытовая химия в нашей жизни
Бытовая химия в нашей жизни Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Основы молекулярно-кинетической теории и термодинамики. (Лекция 9)
Основы молекулярно-кинетической теории и термодинамики. (Лекция 9) Горение. Подводный факел
Горение. Подводный факел Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Kлассификация органических соединений. Углеводороды (алканы, алкены, алкины) лекция 1.2
Kлассификация органических соединений. Углеводороды (алканы, алкены, алкины) лекция 1.2 КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Водород в космосе
Водород в космосе В мире кристаллов
В мире кристаллов Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Правила поведения в кабинете химии
Правила поведения в кабинете химии Теория химического строения органических соединений А.М. Бутлерова
Теория химического строения органических соединений А.М. Бутлерова Получение препаратов алкалоидов
Получение препаратов алкалоидов Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Презентация по Химии "«Подгруппа углерода»" - скачать смотреть
Презентация по Химии "«Подгруппа углерода»" - скачать смотреть