Содержание
- 2. Гетероциклические соединения – это такие соединения, молекулы которых содержат циклы (кольца) состоящие не только из атомов
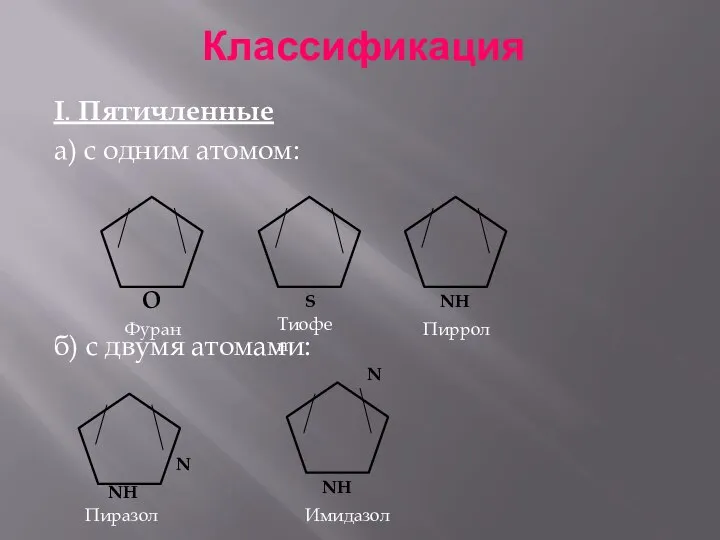
- 3. Классификация I. Пятичленные а) с одним атомом: б) с двумя атомами: Фуран Тиофен Пиррол Пиразол N
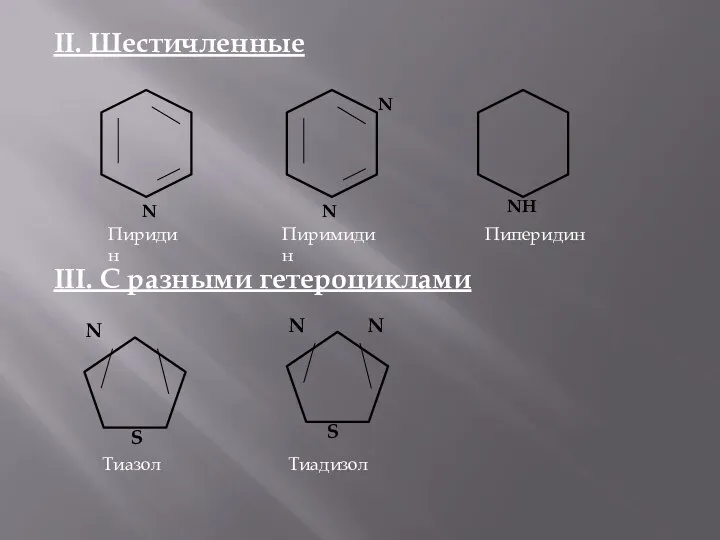
- 4. II. Шестичленные III. С разными гетероциклами N Пиридин N N Пиримидин NH Пиперидин S N Тиазол
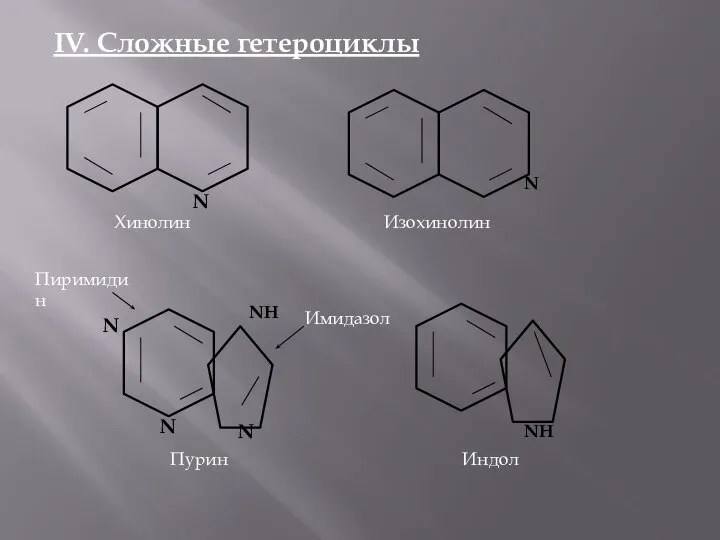
- 5. IV. Сложные гетероциклы N Хинолин N Изохинолин NH N N N Пурин Пиримидин Имидазол NH Индол
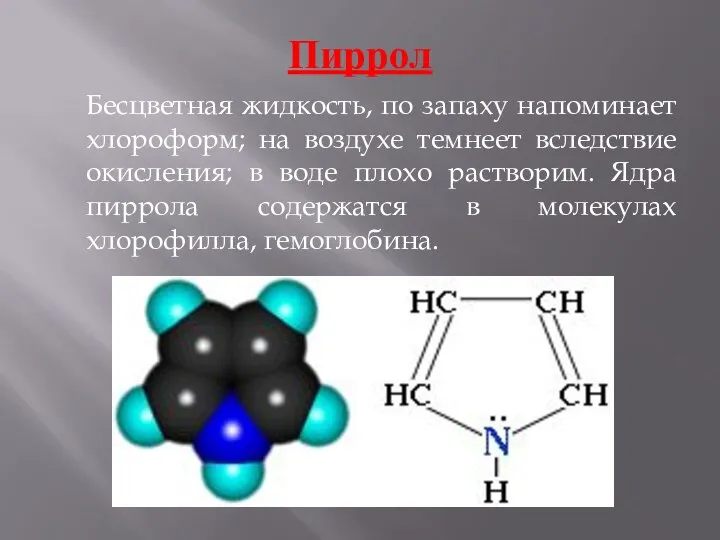
- 6. Пиррол Бесцветная жидкость, по запаху напоминает хлороформ; на воздухе темнеет вследствие окисления; в воде плохо растворим.
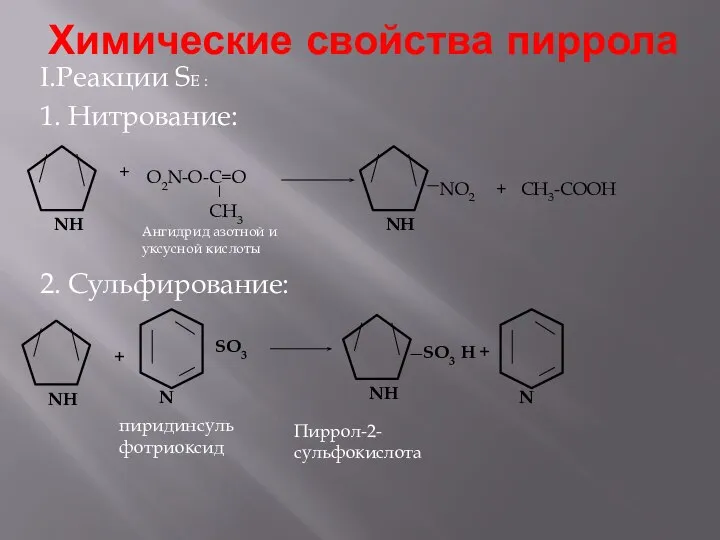
- 7. Химические свойства пиррола I.Реакции SE : 1. Нитрование: 2. Сульфирование: + пиридинсульфотриоксид + Пиррол-2-сульфокислота O2N-O-C=O CH3
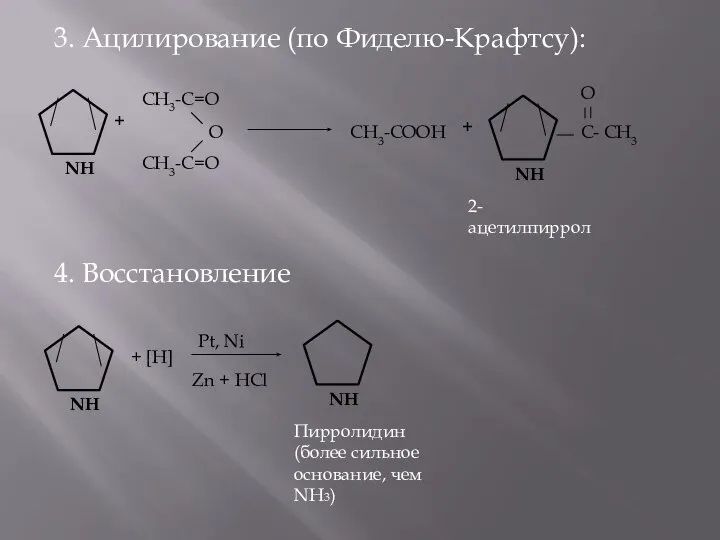
- 8. 3. Ацилирование (по Фиделю-Крафтсу): 4. Восстановление + CH3-C=O CH3-C=O О CH3-COOH + C- CH3 О +
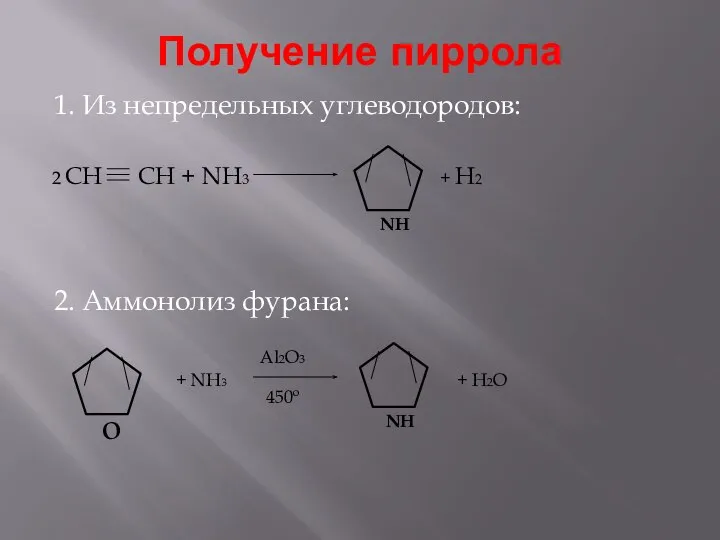
- 9. Получение пиррола 1. Из непредельных углеводородов: 2. Аммонолиз фурана: 2 CH CH + NH3 + H2
- 10. Фуран Бесцветная легкокипящая жидкость. По химическим свойствам напоминает пиррол; также кислотоустойчив. Ароматичность выражена слабее, чем у
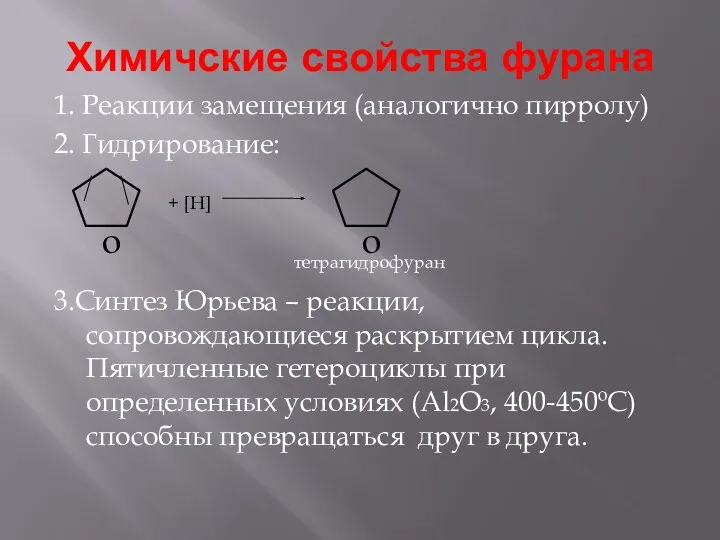
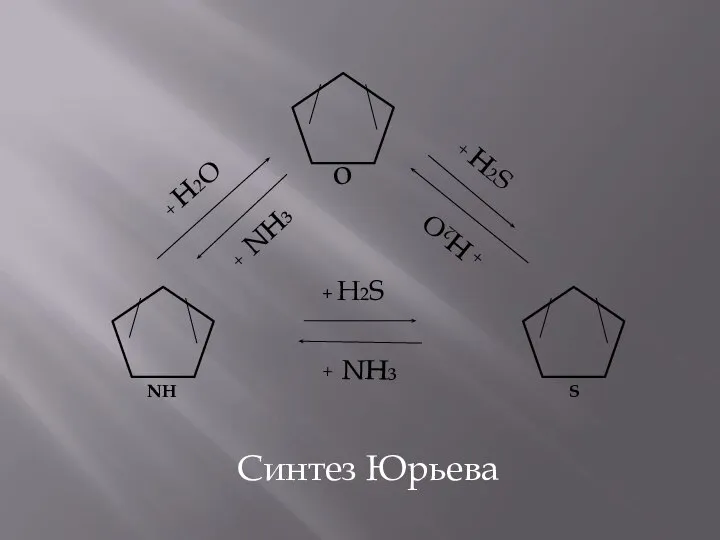
- 11. Химичские свойства фурана 1. Реакции замещения (аналогично пирролу) 2. Гидрирование: 3.Синтез Юрьева – реакции, сопровождающиеся раскрытием
- 12. Синтез Юрьева
- 13. Фурфурол Маслянистая жидкость с запахом ржаного хлеба. Получают из непищевых полисахаридов (отходы древесины, салола и т.д.)
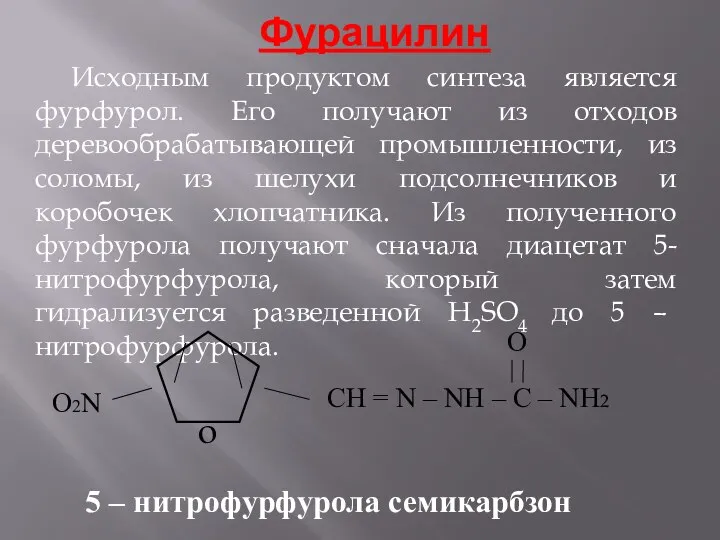
- 14. Фурацилин Исходным продуктом синтеза является фурфурол. Его получают из отходов деревообрабатывающей промышленности, из соломы, из шелухи
- 15. Свойства: Желтый или зеленовато-желтый мелко кристаллический порошок, горького вкуса, очень мало растворим в воде, мало в
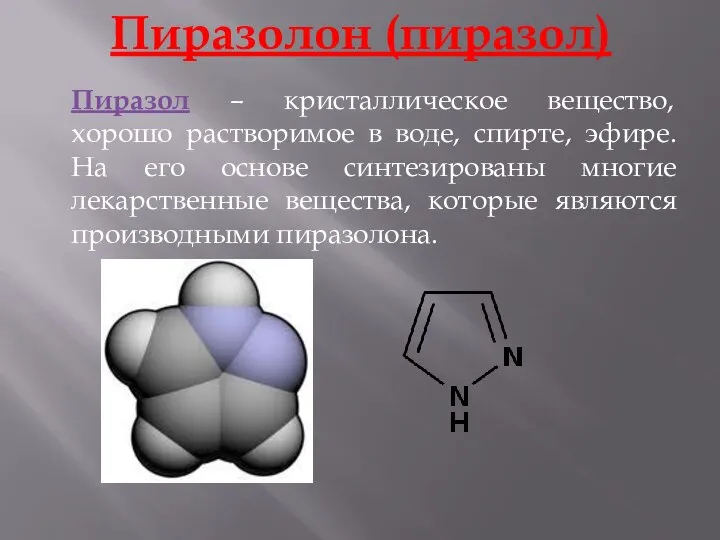
- 16. Пиразолон (пиразол) Пиразол – кристаллическое вещество, хорошо растворимое в воде, спирте, эфире. На его основе синтезированы
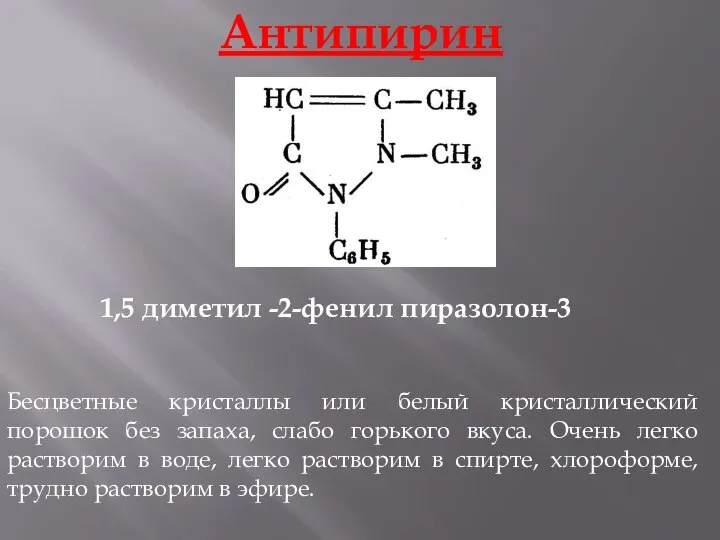
- 17. Антипирин Бесцветные кристаллы или белый кристаллический порошок без запаха, слабо горького вкуса. Очень легко растворим в
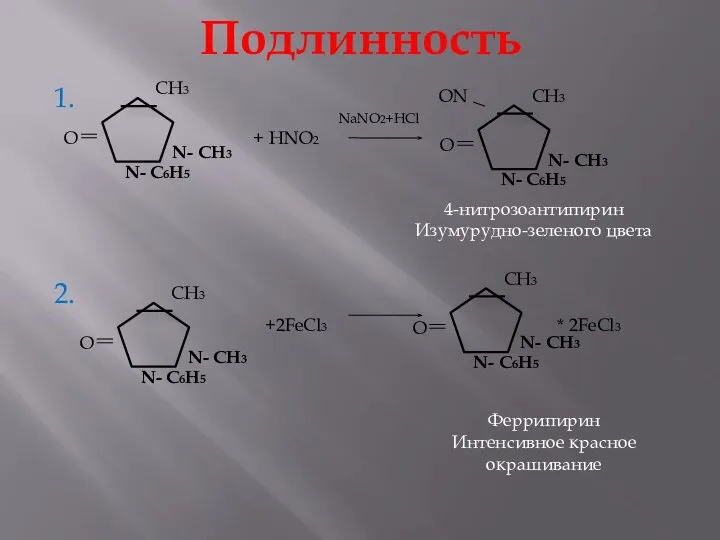
- 18. Подлинность 1. 2. + HNO2 4-нитрозоантипирин Изумурудно-зеленого цвета +2FeCl3 * 2FeCl3 Феррипирин Интенсивное красное окрашивание NaNO2+HCl
- 19. Применение антипирина Как болеутоляющее, жаропонижающее, противовоспалительное. Применяется при головной боли, невралгии, ревматизме, при простудных заболеваниях.
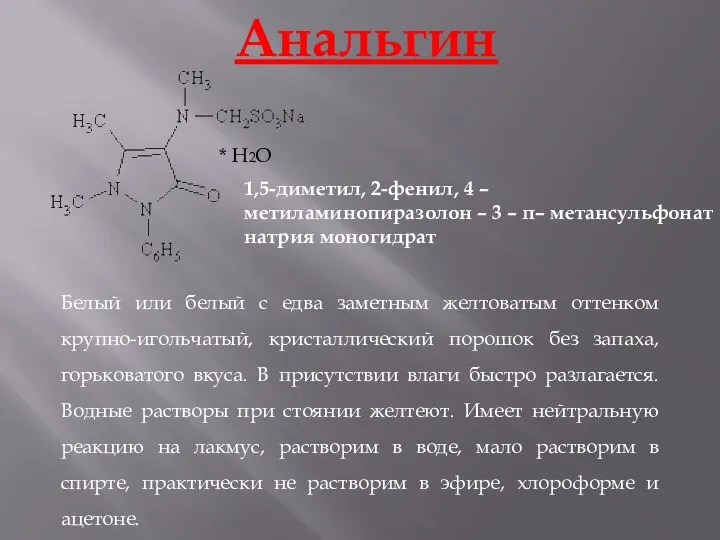
- 20. Анальгин * H2O 1,5-диметил, 2-фенил, 4 – метиламинопиразолон – 3 – п– метансульфонат натрия моногидрат Белый
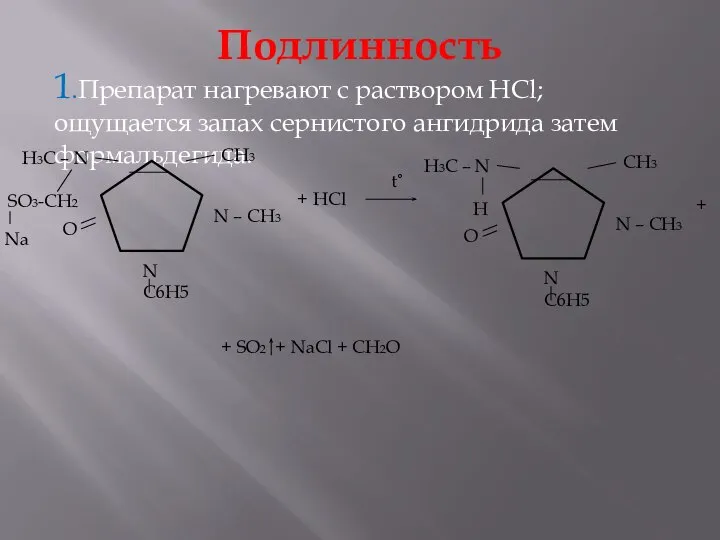
- 21. Подлинность 1.Препарат нагревают с раствором HCl; ощущается запах сернистого ангидрида затем формальдегида. + HCl + +
- 22. 2. Реакция окисления анальгина KJO3 (c KJO3 реагирует образующийся при гидролизе с соляной кислотой диоксид серы):
- 24. Скачать презентацию





 Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно
Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно Физические свойства металлов
Физические свойства металлов Нафта та її переробка
Нафта та її переробка  Презентация по Химии "Искусственные полимеры" - скачать смотреть
Презентация по Химии "Искусственные полимеры" - скачать смотреть  Сильные и слабые электролиты. Степень диссоциации
Сильные и слабые электролиты. Степень диссоциации Гидролиз. Лекция 03-2
Гидролиз. Лекция 03-2 Презентация по Химии "Водорастворимый упаковочный материал" - скачать смотреть
Презентация по Химии "Водорастворимый упаковочный материал" - скачать смотреть  Виды композитных материалов, исследование их свойств и областей применения
Виды композитных материалов, исследование их свойств и областей применения Непредельные углеводороды - алкены
Непредельные углеводороды - алкены Лизиметр
Лизиметр Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот: свойства и применение
Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот: свойства и применение Адсорбция на твердых телах
Адсорбция на твердых телах Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Энтропия. Изменение энтропии в изопроцессах
Энтропия. Изменение энтропии в изопроцессах Система приготовления и подачи реагентов KPJ
Система приготовления и подачи реагентов KPJ Физические и химические явления
Физические и химические явления Галогены
Галогены Обмен нуклеотидов. Матричные биосинтезы
Обмен нуклеотидов. Матричные биосинтезы Транспорт веществ через биологические мембраны. (Лекция 12)
Транспорт веществ через биологические мембраны. (Лекция 12) Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Практика по химии
Практика по химии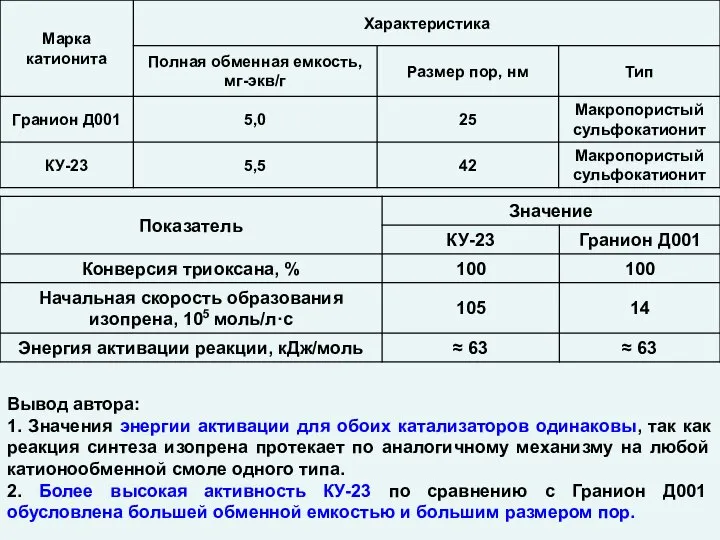 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Химическая кинетика, химическое равновесие и катализ
Химическая кинетика, химическое равновесие и катализ Качественные реакции
Качественные реакции Курс химии (Литвиновой Татьяны Николаевны)
Курс химии (Литвиновой Татьяны Николаевны) Тема урока ОСНОВАНИЯ
Тема урока ОСНОВАНИЯ Аттестационная работа. Образовательная программа (элективный курс) Решение задач по химии
Аттестационная работа. Образовательная программа (элективный курс) Решение задач по химии Презентация по Химии "Методы разделения и концентрирования" - скачать смотреть бесплатно
Презентация по Химии "Методы разделения и концентрирования" - скачать смотреть бесплатно