Содержание
- 2. ОН- Изменение цвета индикатора: универсальный индикатор - синий лакмус - синий метиловый оранжевый—желтый фенолфталеин - малиновый
- 3. Cl- Cl-+Ag+ = AgCl↓ белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету.
- 4. Cl- (тверд.соль) + H2SO4 (конц) = HCl↑ + HSO4- Cl- Бесцветный газ с резким запахом, окрашивающий
- 5. Br- Br-+Ag+ = AgBr↓ светло-желтый осадок, который растворяется в азотной кислоте и темнеет на свету.
- 6. Br- 2HBr+ H2SO4 (конц) = SO2↑ + Br2 + 2H2O Бесцветный газ с резким запахом SO2↑
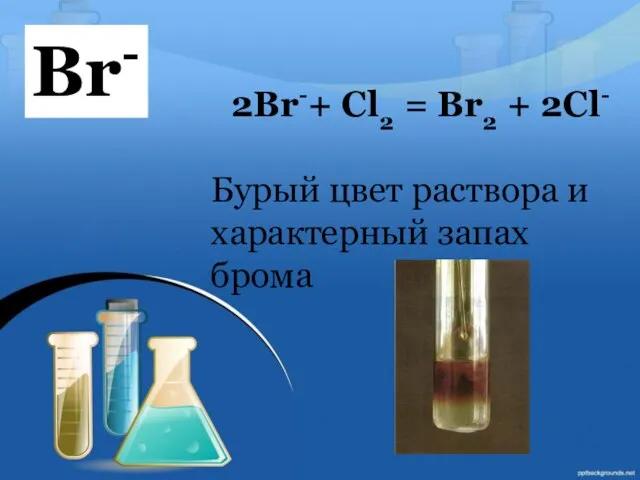
- 7. 2Br-+ Cl2 = Br2 + 2Cl- Бурый цвет раствора и характерный запах брома Br-
- 8. I- I-+Ag+ = AgI↓ желтый осадок, который растворяется в азотной кислоте и темнеет на свету
- 9. 8HI+ H2SO4 (конц) = 4I2↓+ H2S↑+4H2O I- Газ с запахом тухлых яиц H2S и I2 ,
- 10. 2I-+ Cl2 = I2 ↓+ 2Cl- Темная окраска раствора и характерный запах йода I-
- 11. F- Белый осадок (с растворимыми солями кальция) Ca2+ + F- = CaF2 ↓
- 12. S2- S2-+Pb2+ = PbS↓ Черный осадок, нерастворимый в кислотах. Растворим только в HNO3(конц) при нагревании
- 13. S2- S2-+Н+ = Н2S↑ Выделение сероводорода при взаимодействии с более сильными кислотами
- 14. SO42- SO42-+Ba2+ = BaSO4↓ белый мелкодисперсный осадок, не растворимый в кислотах
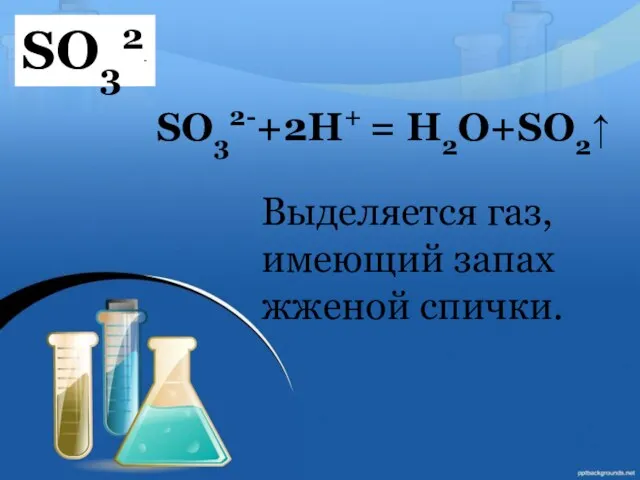
- 15. SO32- SO32-+2H+ = H2O+SO2↑ Выделяется газ, имеющий запах жженой спички.
- 16. CO32- CO32-+Ca2+ = CaCO3↓ Выпадает белый осадок, который в кислотах растворяется с выделением газа без цвета
- 17. CO32- Выделение углекислого газа при взаимодействии с более сильными кислотами. CO22-+2Н+ = Н2O+ CO2 ↑
- 18. PO43- PO43-+3Ag+ = Ag3PO4↓ Выпадение желтого осадка, который растворяется в азотной кислоте.
- 19. CrO42- CrO42-+Ba2+ = BaCrO4↓ Желтый осадок, нерастворимый в уксусной, но растворимый в соляной кислоте.
- 20. SiO32- SiO32-+2Н+ = Н2SiO3 ↓ Выделение бесцветного осадка (геля) при взаимодействии с растворимыми кислотами.
- 21. NO3- Cu + 2NO3-+4H+ = Cu2++2H2O+2NO2↑ При добавлении к нитрату H2SO4 (конц) , металлической меди и
- 23. Скачать презентацию


















 Алюміній оксид Al2O3
Алюміній оксид Al2O3  Неметаллы 11 класс - Презентация_
Неметаллы 11 класс - Презентация_ Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк
Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк Миючі засоби Виконала учениця 9-А класу, Велітченко Юлія
Миючі засоби Виконала учениця 9-А класу, Велітченко Юлія  Составление химических формул по валентности
Составление химических формул по валентности Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов Урок на тему: « Химическое равновесие »
Урок на тему: « Химическое равновесие » Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу Жиры. История открытия жиров
Жиры. История открытия жиров Кремний в природе
Кремний в природе Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов Химическая кинетика
Химическая кинетика Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Химиялық тепе-теңдік
Химиялық тепе-теңдік Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Вода. Уникальная и неповторимая
Вода. Уникальная и неповторимая Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Презентация по Химии "Вещества, входящие в состав живых организмов" - скачать смотреть
Презентация по Химии "Вещества, входящие в состав живых организмов" - скачать смотреть  Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Щелочные металлы
Щелочные металлы Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Хімічні властивості основ
Хімічні властивості основ Открытия в области химии во время Великой Отечественной войны
Открытия в области химии во время Великой Отечественной войны Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Каталитический крекинг
Каталитический крекинг