Содержание
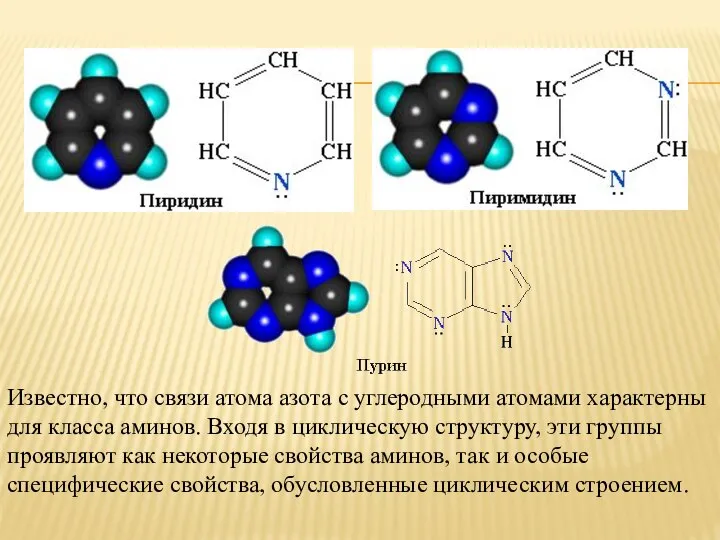
- 2. Известно, что связи атома азота с углеродными атомами характерны для класса аминов. Входя в циклическую структуру,
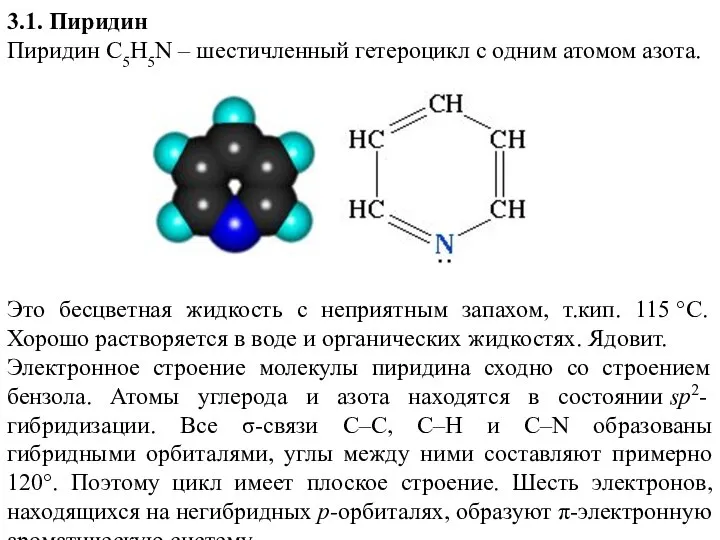
- 3. 3.1. Пиридин Пиридин С5H5N – шестичленный гетероцикл с одним атомом азота. Это бесцветная жидкость с неприятным
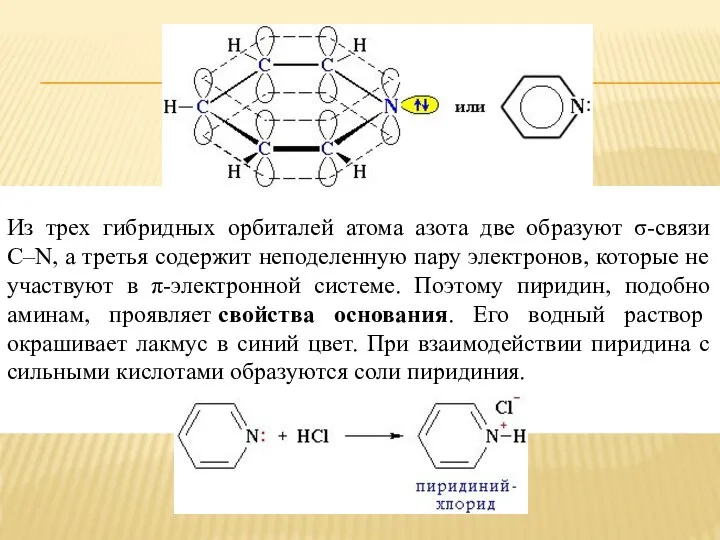
- 4. Из трех гибридных орбиталей атома азота две образуют σ-связи С–N, а третья содержит неподеленную пару электронов,
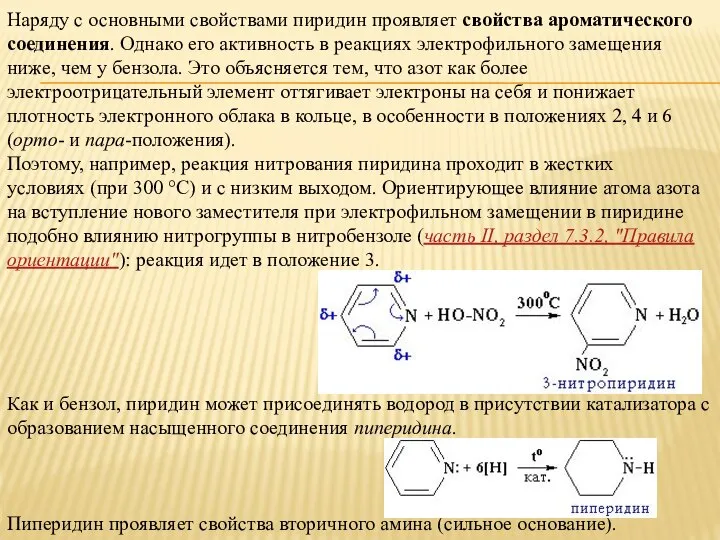
- 5. Наряду с основными свойствами пиридин проявляет свойства ароматического соединения. Однако его активность в реакциях электрофильного замещения
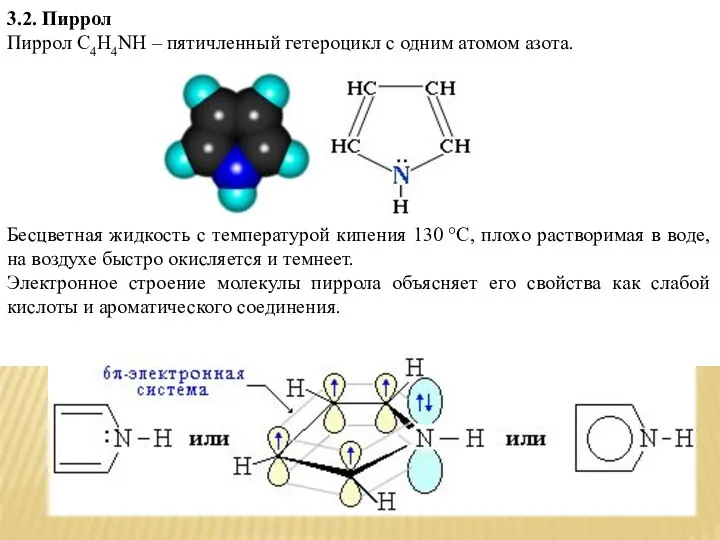
- 6. 3.2. Пиррол Пиррол С4H4NН – пятичленный гетероцикл с одним атомом азота. Бесцветная жидкость с температурой кипения
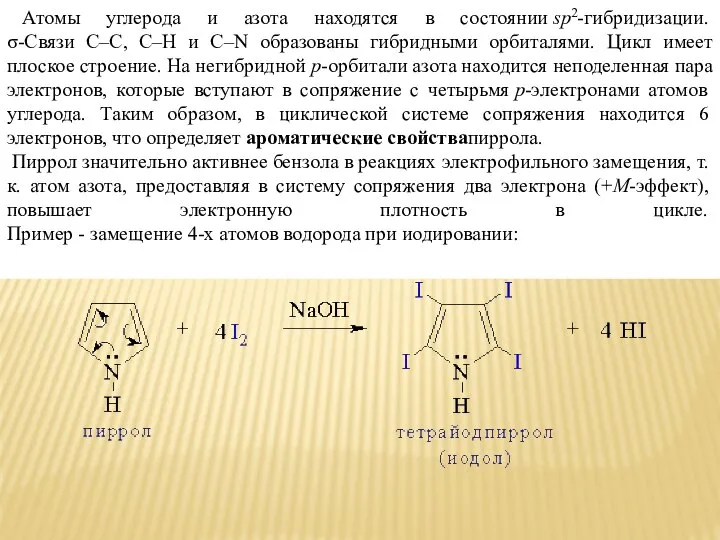
- 7. Атомы углерода и азота находятся в состоянии sp2-гибридизации. σ-Связи C–C, C–H и C–N образованы гибридными орбиталями.
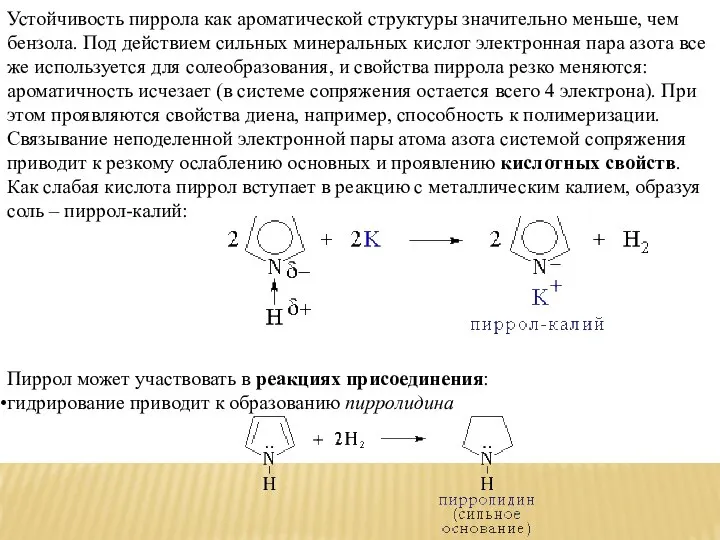
- 8. Устойчивость пиррола как ароматической структуры значительно меньше, чем бензола. Под действием сильных минеральных кислот электронная пара
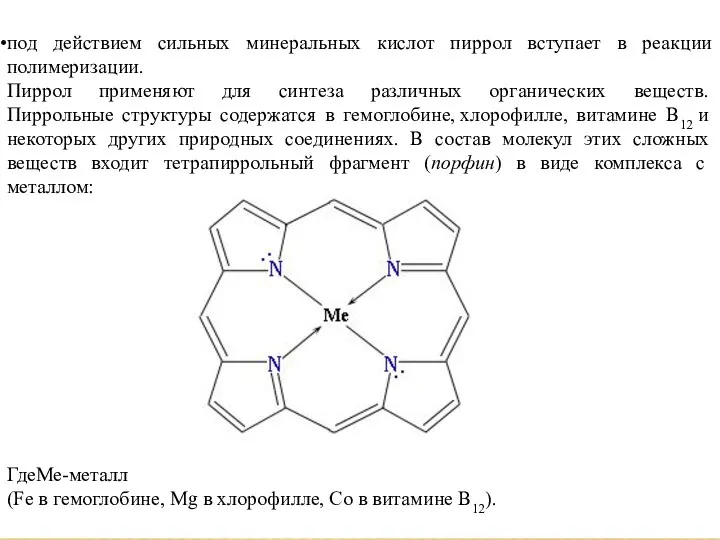
- 9. под действием сильных минеральных кислот пиррол вступает в реакции полимеризации. Пиррол применяют для синтеза различных органических
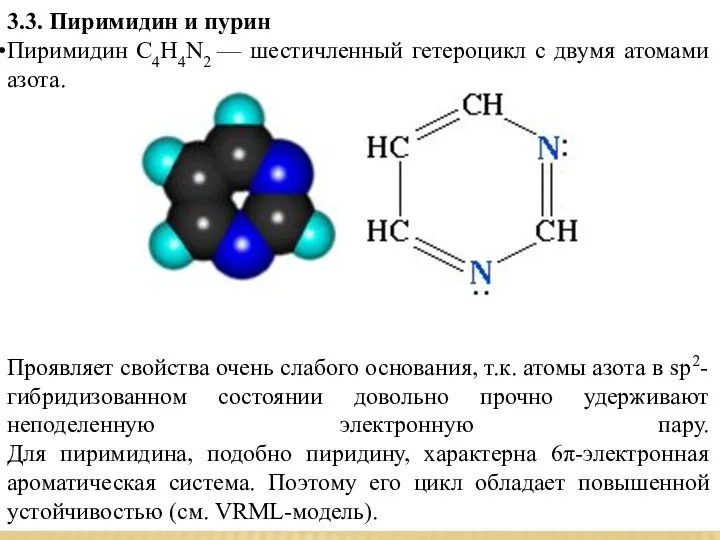
- 10. 3.3. Пиримидин и пурин Пиримидин С4Н4N2 — шестичленный гетероцикл с двумя атомами азота. Проявляет свойства очень
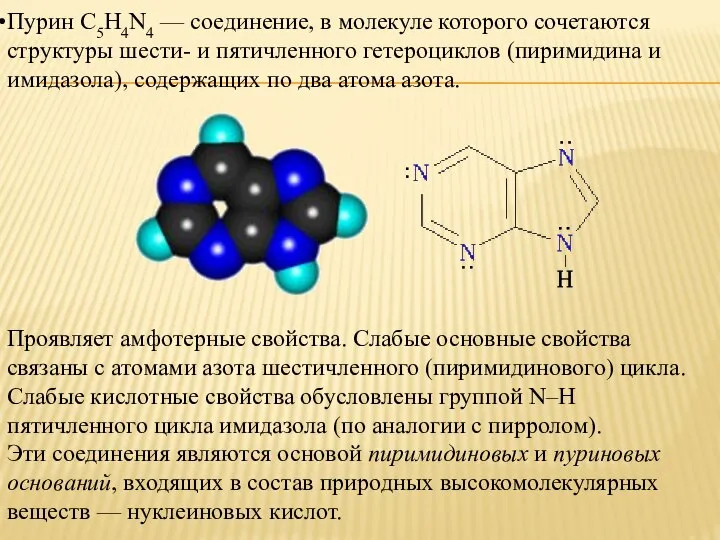
- 11. Пурин С5H4N4 — соединение, в молекуле которого сочетаются структуры шести- и пятичленного гетероциклов (пиримидина и имидазола),
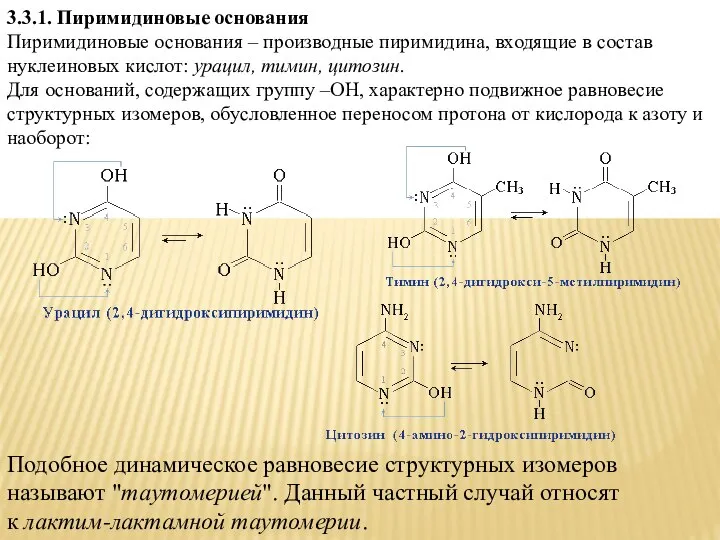
- 12. 3.3.1. Пиримидиновые основания Пиримидиновые основания – производные пиримидина, входящие в состав нуклеиновых кислот: урацил, тимин, цитозин.
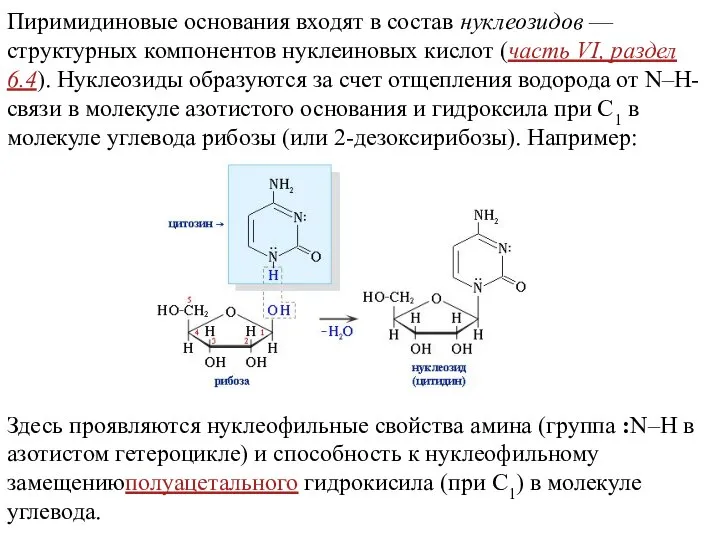
- 13. Пиримидиновые основания входят в состав нуклеозидов — структурных компонентов нуклеиновых кислот (часть VI, раздел 6.4). Нуклеозиды
- 15. Скачать презентацию
 Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс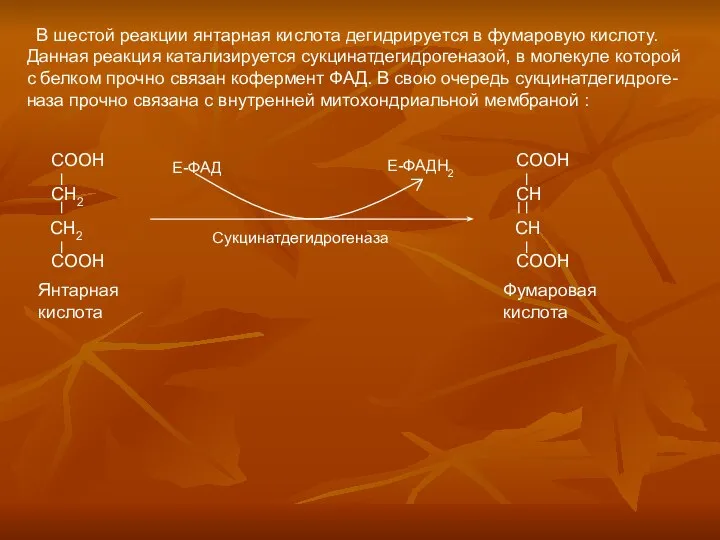 Аэробное окисление углеводов. (Часть 2)
Аэробное окисление углеводов. (Часть 2) Оксиды азота
Оксиды азота Классификация кислот
Классификация кислот Қатты күйдегі препараттар
Қатты күйдегі препараттар Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Химический элемент платина
Химический элемент платина Щелочные металлы
Щелочные металлы Растворы (дисперсные системы)
Растворы (дисперсные системы) Тақырыпқа байланысты білімді жүйелеу
Тақырыпқа байланысты білімді жүйелеу II главная подгруппа ПС: Be, Mg, Ca, Sr, Ba, Ra
II главная подгруппа ПС: Be, Mg, Ca, Sr, Ba, Ra Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Генетичний зв'язок
Генетичний зв'язок Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно
Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Получение этилена и опыты с ним. (Практическая работа 2)
Получение этилена и опыты с ним. (Практическая работа 2) Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно Основы химической термодинамики
Основы химической термодинамики Определение свободной поверхностной энергии тонких пленок оксидов
Определение свободной поверхностной энергии тонких пленок оксидов Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Азотная кислота
Азотная кислота Жоғары температурағы асқын өткізгіштер
Жоғары температурағы асқын өткізгіштер Введение в биоорганическую химию. Пространственное и электронное строение органических соединений
Введение в биоорганическую химию. Пространственное и электронное строение органических соединений Исследовательская работа на тему: Удивительные свойства воды
Исследовательская работа на тему: Удивительные свойства воды “Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.
“Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.  Степень окисления
Степень окисления Презентация по Химии "Щавелевая кислота" - скачать смотреть
Презентация по Химии "Щавелевая кислота" - скачать смотреть  Количества вещества
Количества вещества