Содержание
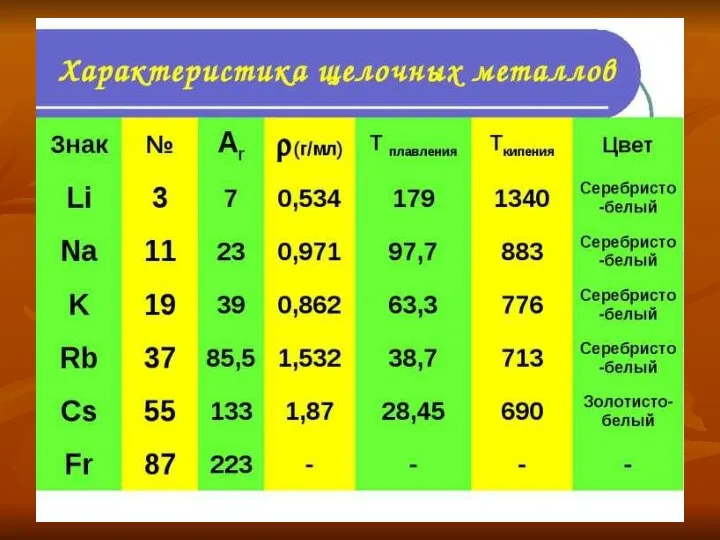
- 2. Щелочные металлы Литий(Li) Натрий(Na) Рубидий(Rb) Калий(K) Цезий(Cs) Франций(Fr)
- 3. Щелочны́е мета́ллы — это элементы главной подгруппы первой группы Периодической системы Д.И.Менделеева.
- 4. При взаимодействии щелочных металлов с водой образуется едкая щёлочь, отсюда и название.
- 5. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону. Они легко отдают этот электрон,
- 7. Химические свойства Активно взаимодействуют почти со всеми неметаллами: 2M+H2=2MH (гидрид), 2M+Cl2=2MCl (хлорид), 2M+S=M2S (сульфид).
- 8. При взаимодействии с кислородом натрий образует пероксид: 2Na+O2=Na2O2.
- 9. Только литий образует оксид при взаимодействии с кислородом: 4Li+O2=2Li2O.
- 10. Все щелочные металлы активно взаимодействуют с водой, образуя щелочи и восстанавливая воду до водорода(Н): 2M+2HOH=2MOH+H2
- 11. Физические свойства
- 12. Литий Был открыт в 1817 шведским химиком А. Арфведсоном; От греч. lithos — камень.
- 13. Натрий Название «натрий», происходящее от араб. натрун, греч. nitron, первоначально относилось к природной соде.
- 14. Рубидий Открыли в 1861 Р. Бунзен и Г. Кирхгоф. Название дано по цвету наиболее характерных красных
- 15. Калий Некоторые соединения Калия были известны уже в древности; однако их не отличали от соединений натрия.
- 16. Цезий Цезий открыт в 1860 Р. В. Бунзеном и Г. Р. Кирхгофом. Назван Цезий (от лат.
- 17. Франций Существование и главные свойства самого тяжёлого аналога щелочных металлов были предсказаны Д. И. Менделеевым в
- 18. Оксиды Оксиды M2O- твердые вещества, взаимодействующие с водой, кислотами и кислотными оксидами: 2Na+Na2O2=2Na2O
- 19. Гидроксиды Гидроксиды (МОН- твердые белые вещества) взаимодействуют с: Кислотами Кислотными оксидами Солями (если образуется нерастворимое основание).
- 20. Образование гидроксидов Оксид+Вода=Гидроксид K2O + H2O= 2KOH Горение калия(фиолетовым цветом)
- 21. Реакции с кислотами 2KOH + H2SO4 = K2SO4 + 2H2O соль +вода Хлорид калия
- 22. Реакции с солями 2NaOH + CuSO4 Cu(OH)2 + Na2SO4 нерастворимое основание + соль
- 23. Реакции с кислотными оксидами 2KOH + SiO2 = K2SiO3 + H2O соль + вода
- 25. Скачать презентацию





















 α-карбин и β-карбин
α-карбин и β-карбин Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова ГИА-9 Химия. А1
ГИА-9 Химия. А1 Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Гидрогели на основе карбоксиметил целлюлозы
Гидрогели на основе карбоксиметил целлюлозы Чистые вещества и смеси _
Чистые вещества и смеси _ оксиды - св-ва — уч-ся
оксиды - св-ва — уч-ся Химическая связь
Химическая связь Процессы коксования
Процессы коксования Моделирование (7 класс)
Моделирование (7 класс) Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть  Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Лекарственные вещества из группы терпенов. Общая характеристика, классификация, источники получения. (Тема 8)
Лекарственные вещества из группы терпенов. Общая характеристика, классификация, источники получения. (Тема 8) Назначение установки "Пенекс"
Назначение установки "Пенекс" Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразова
Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразова Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Свинец. Полезный металл, яд и глобальный загрязнитель
Свинец. Полезный металл, яд и глобальный загрязнитель Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Презентация по Химии "Белки." - скачать смотреть бесплатно
Презентация по Химии "Белки." - скачать смотреть бесплатно Free Radical Polymerization
Free Radical Polymerization Камни и Телец
Камни и Телец Углеводы. Карбоновые кислоты и их производные
Углеводы. Карбоновые кислоты и их производные Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization Методы выделения и анализа биологически активных веществ
Методы выделения и анализа биологически активных веществ Кремний – бог неорганической природы
Кремний – бог неорганической природы Использование химии в медицине
Использование химии в медицине Степень окисления веществ. Задачи
Степень окисления веществ. Задачи Природні сполуки Карбону
Природні сполуки Карбону