“Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.
Содержание
- 2. Цілі: 1.Розібрати поняття: Кількість речовини. Моль. Число Авогадро. Молярна маса. Молярний об'єм. Закон Авогадро. Відносна густина
- 3. Мета : 1. Сформувати в ході уроку поняття «кількість речовини», «число Авогадро»,Молярна маса,молярний об’єм,відносна густина газів.
- 4. Існує фізична величина, прямо пропорційна числу частинок, складових даної речовини, які входять у взяту порцію цієї
- 5. Кількість речовини - фізична величина, що характеризує кількість однотипних структурних одиниць, які містяться в речовині. Під
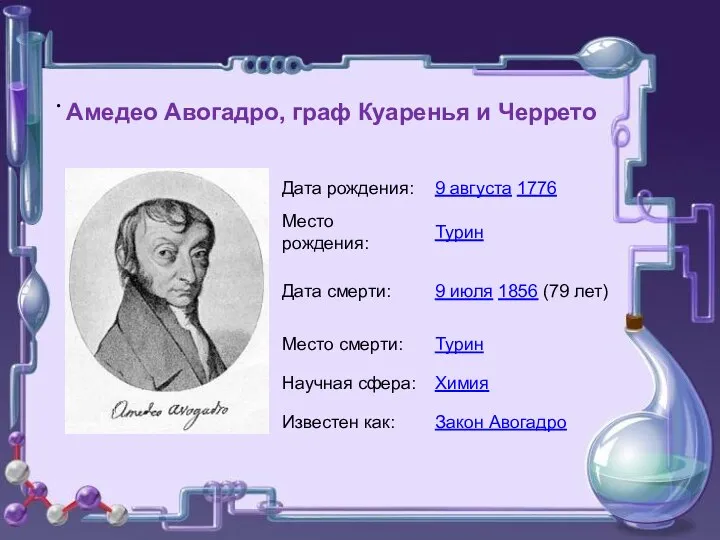
- 6. . Амедео Авогадро, граф Куаренья и Черрето
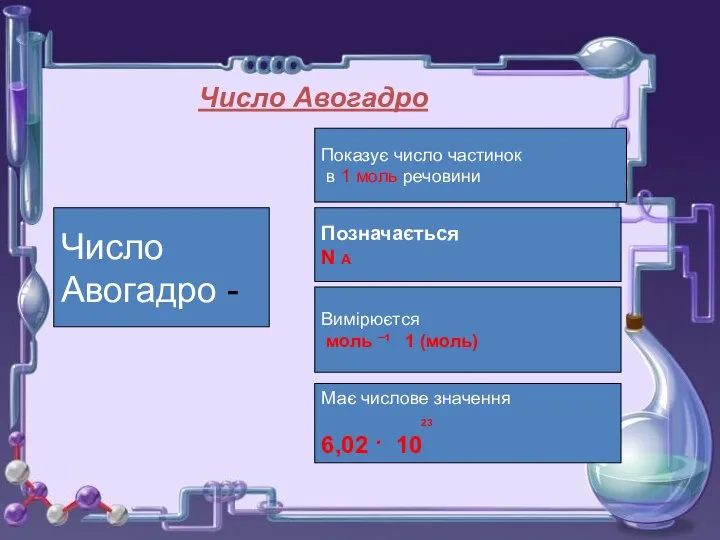
- 7. Число Авогадро Число Авогадро - Показує число частинок в 1 моль речовини Позначається N A Вимірюєтся
- 8. Молярна маса -це маса одного моль речовини. М = [г / моль] (Молярна маса чисельно дорівнює
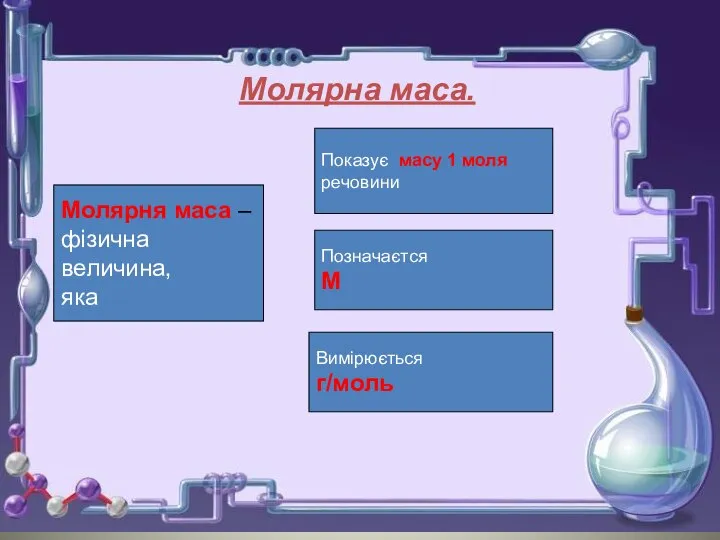
- 9. Молярна маса. Молярня маса – фізична величина, яка Показує масу 1 моля речовини Позначаєтся М Вимірюється
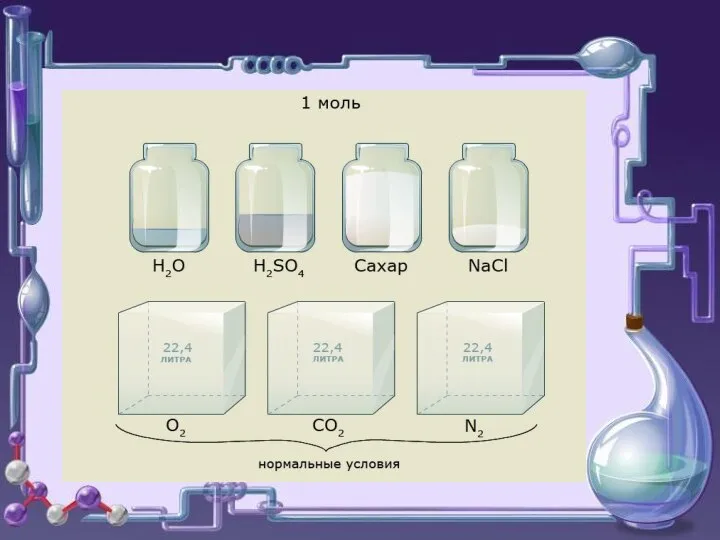
- 10. Молярний об’єм. Закон Авогадро (1811 г.) Молярний об'єм - фізична величина, яка Показує об’єм, який займає
- 12. Відносна густина газів - фізична величина, яка Показує, у скільки разів 1 моль одного газу важче
- 13. Відношення маси певного об’єму одного газу до маси такого ж об'єму іншого газу, взятого при тих
- 14. о Закон об’ємних співвідношень Вимірюючи об'єми газів, в результаті реакцій Ж.Л. Гей-Люссак відкрив закон газових (об'ємних)
- 15. Напрклад
- 16. Закон об'ємних співвідношень дозволив італійському вченому А. Авогадро припустити, що молекули простих газів складаються з двох
- 17. Де n- кількість речовини(моль) Рівняння зв'язку
- 19. Скачать презентацию












 Биогенді элементтер
Биогенді элементтер Теория химического строения А. М. Бутлерова. Часть II. Раздел 2
Теория химического строения А. М. Бутлерова. Часть II. Раздел 2 Формирование химического состава подземных вод
Формирование химического состава подземных вод Углерод. Химические свойства
Углерод. Химические свойства Періодична система Менделєєва. Елементи 6 групи
Періодична система Менделєєва. Елементи 6 групи 9 класс (обязательный минимум по химии) ПОЛИМЕРЫ Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс (обязательный минимум по химии) ПОЛИМЕРЫ Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Полимеры органические, неорганические
Полимеры органические, неорганические Моторные масла
Моторные масла Облучение. Радиационная окраска
Облучение. Радиационная окраска Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Сера и ее свойства
Сера и ее свойства Сера и её соединения
Сера и её соединения Серная кислота и её соли, применение
Серная кислота и её соли, применение Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Карбоновые кислоты. Лекция 7
Карбоновые кислоты. Лекция 7 Хімія в побуті Павлова Олена Дмитрівна, учитель хімії Мошнівської загальноосвітньої школи І-ІІІ ступенів Черкаської районної
Хімія в побуті Павлова Олена Дмитрівна, учитель хімії Мошнівської загальноосвітньої школи І-ІІІ ступенів Черкаської районної  Природные Источники
Природные Источники  Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК) Многообразие органических веществ
Многообразие органических веществ Горные породы
Горные породы Почему протекают химические реакции
Почему протекают химические реакции Химические реакции Выполнила Болгова ЕД преподаватель химии ГБОУ ГАК с Московское
Химические реакции Выполнила Болгова ЕД преподаватель химии ГБОУ ГАК с Московское Простейшие операции с веществом (химический практикум)
Простейшие операции с веществом (химический практикум) Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Строение атома
Строение атома Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами
Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами