Содержание
- 2. ПО ФАЗОВОМУ СОСТОЯНИЮ Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в
- 5. ОРГАНИЧЕСКИЕ РЕАКЦИИ ПРИНЯТО КЛАССИФИЦИРОВАТЬ по механизмам протекания Под механизмом реакции понимают последовательность отдельных стадий протекания реакций
- 6. По механизму реакции: Гомолитические (радикальные) реакции R – это реакции, идущие с образованием радикалов (частиц с
- 7. Радикальные реакции имеют цепной механизм, включающий стадии: зарождения, развития и обрыв цепи (свободнорадикальные цепные реакции): Зарождение
- 8. ПО МЕХАНИЗМУ РЕАКЦИИ: 2. Гетеролитические (ионные или электрофильно-нуклеофильные) реакции – это реакции, происходящие без разрыва электронных
- 9. ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: Реакции замещения S - реакции, в результате которых происходит замена
- 10. Замещение
- 11. ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: 2. Реакции присоединения А – реакции, в результате которых происходит
- 12. б) гидрирование (присоединение водорода): CH2 = CH2 + H2 → CH3 – CH3 в) гидрогалогенирование (присоединение
- 13. 3. Реакции отщепления (элиминирования) - реакции, в результате которых происходит отщепление атомов или группы атомов от
- 14. Замещение сравнить см. слайд выше
- 15. г) дегидратация CH2OH – CH3 t→ CH2 = CH2 + H2O д) деполимеризация - разрушение молекул
- 16. 4. Реакции перегруппировки (изомеризации) - реакции, в результате которых происходит перегруппировка атома или группы атомов в
- 18. Скачать презентацию















 Гиалурон қышқылы
Гиалурон қышқылы Растворы ВМС и их свойства
Растворы ВМС и их свойства Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско Растворы и их классификация
Растворы и их классификация Уксусная кислота
Уксусная кислота Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Производные пурина
Производные пурина Роль химии в жизни человека
Роль химии в жизни человека Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15
Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15 Основные понятия и законы химии
Основные понятия и законы химии Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Закон сохранения массы веществ
Закон сохранения массы веществ Производные ненасыщенных полиокси-γ-лактонов
Производные ненасыщенных полиокси-γ-лактонов Строение атома
Строение атома Классификация витаминов. Витаминоподобные соединения
Классификация витаминов. Витаминоподобные соединения Великие русские химики
Великие русские химики Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче
Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче Физические и химические явления
Физические и химические явления Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты
Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты Хлориди.
Хлориди. Хром. Использование хрома
Хром. Использование хрома Углеводы
Углеводы МЕТАЛЛЫ диктант 9 класс
МЕТАЛЛЫ диктант 9 класс 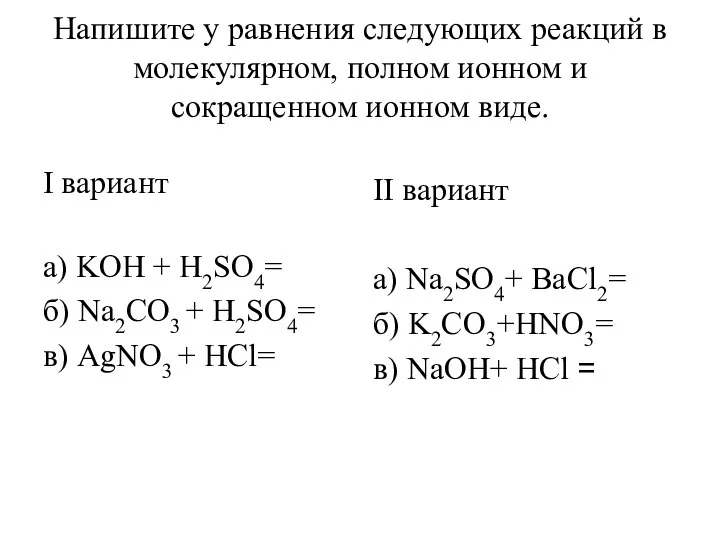 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Окислительновосстановительные реакции
Окислительновосстановительные реакции Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Алкены
Алкены