Содержание
- 2. Гидроксилпроизводные – это такие производные углеводородов, в состав молекулы которых входит одна или несколько гидроксильных групп.
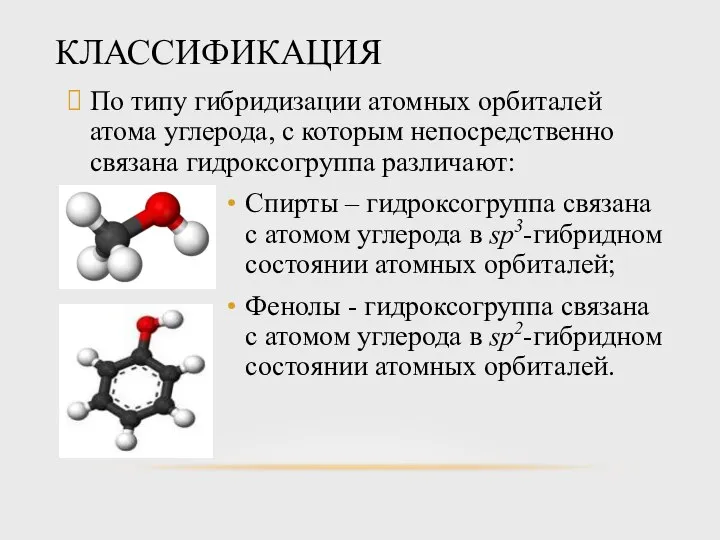
- 3. КЛАССИФИКАЦИЯ По типу гибридизации атомных орбиталей атома углерода, с которым непосредственно связана гидроксогруппа различают: Спирты –
- 4. СПИРТЫ
- 5. КЛАССИФИКАЦИЯ В зависимости от количества гидроксильных групп различают: Одноатомные; Двухатомные; Трех- и многоатомные. В зависимости от
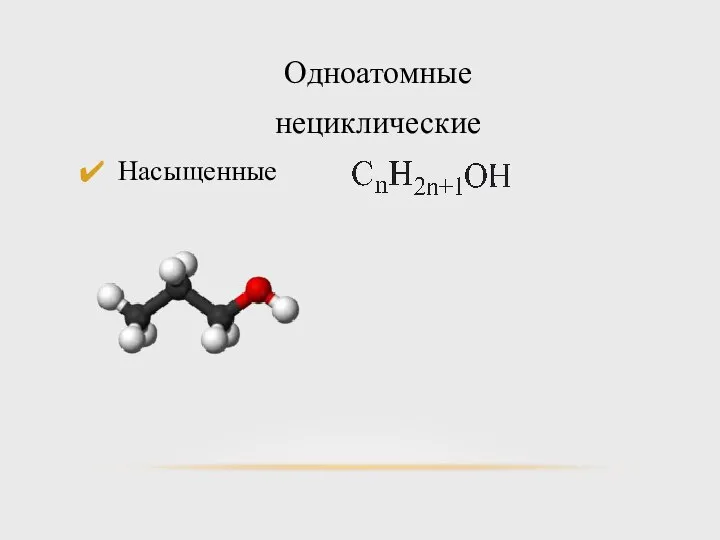
- 6. Одноатомные нециклические Насыщенные
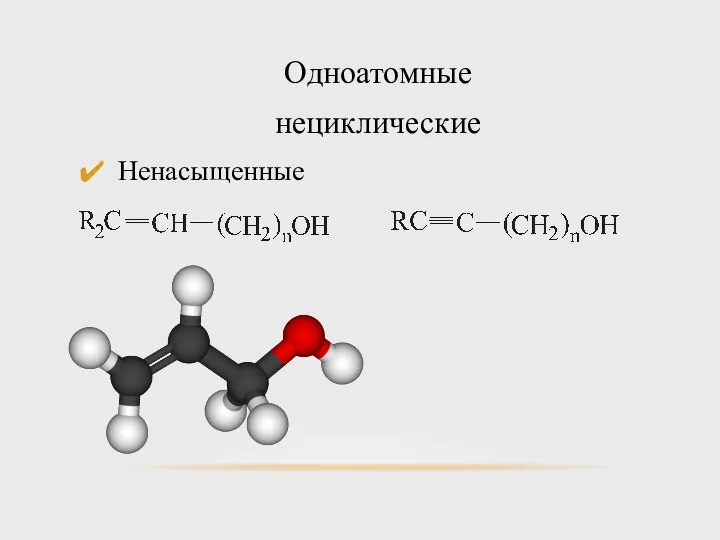
- 7. Одноатомные нециклические Ненасыщенные
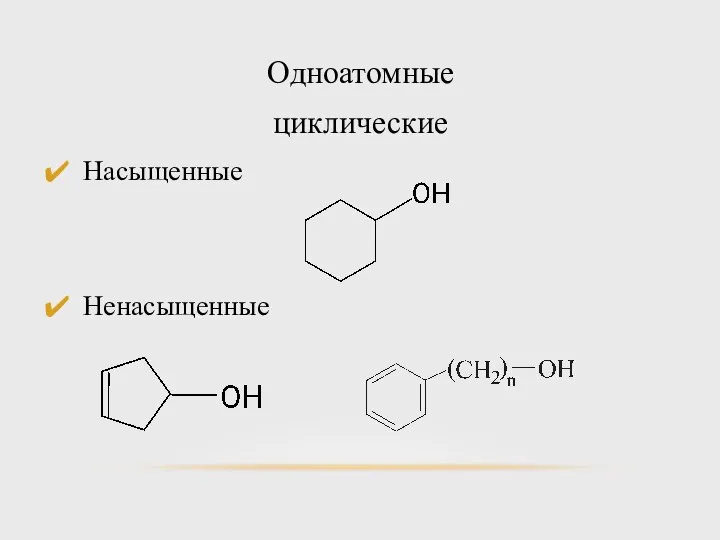
- 8. Одноатомные циклические Насыщенные Ненасыщенные
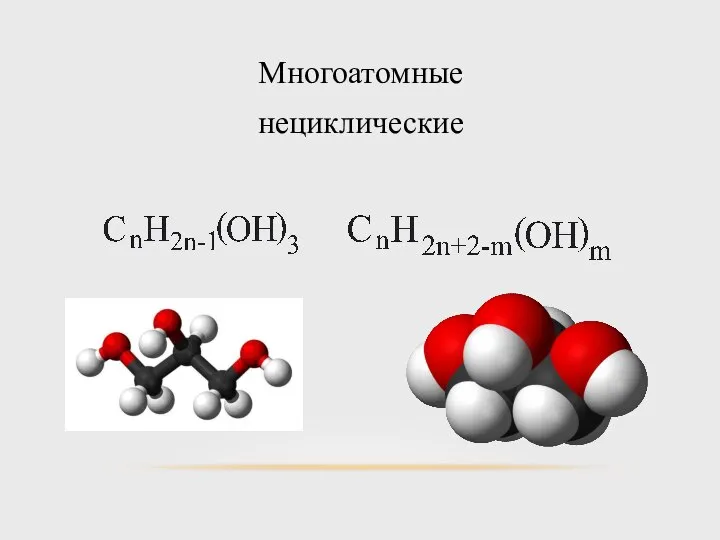
- 9. Многоатомные нециклические Насыщенные Ненасыщенные
- 10. Многоатомные нециклические
- 11. СПИРТЫ НЕЦИКЛИЧЕСКИЕ ОДНОАТОМНЫЕ
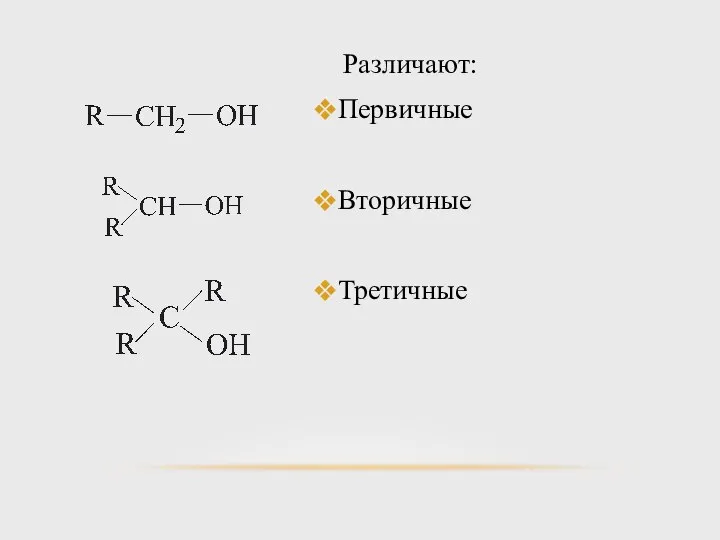
- 13. Различают: Первичные Вторичные Третичные
- 15. НОМЕНКЛАТУРА При наименовании одноатомных спиртов самую длинную цепь углеродных атомов выбирают так чтобы атом углерода, связанный
- 16. этанол пропанол 5-метилгексанол-3 2-метилпропанол-2 третбутанол 4-хлор-2-этилбутен-2-ол-1 2-метилпентен-4-ол-1
- 17. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Метанол (метиловый спирт, древесный спирт, карбинол) Метанол — это первый представитель гомологического ряда предельных
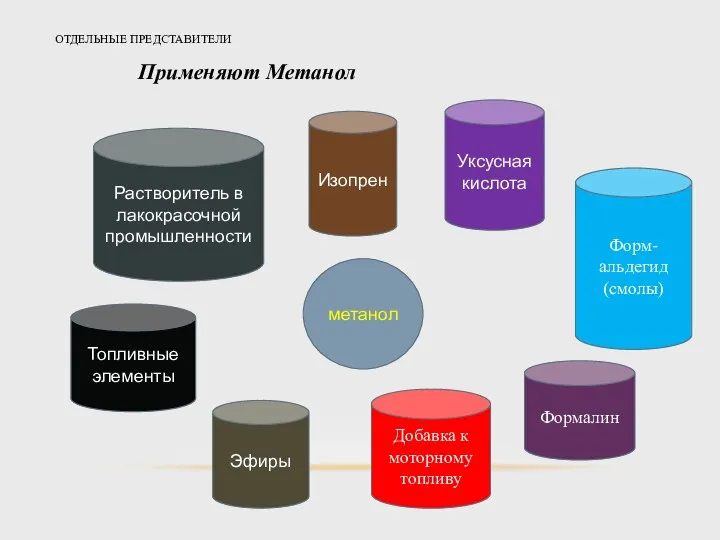
- 18. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Применяют Метанол Растворитель в лакокрасочной промышленности метанол Изопрен Уксусная кислота Топливные элементы Эфиры Добавка
- 19. В газовой промышленности используется для борьбы с образованием гидратов. (При добыче газа гидраты могут образовываться в
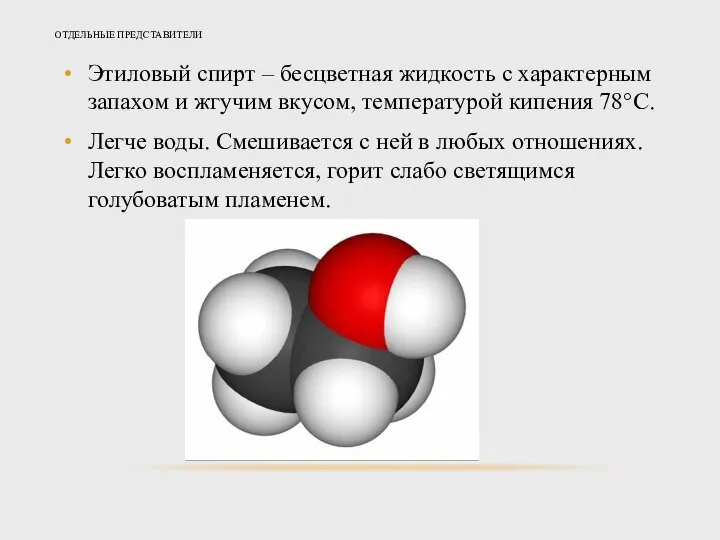
- 20. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт – бесцветная жидкость с характерным запахом и жгучим вкусом, температурой кипения 78°С.
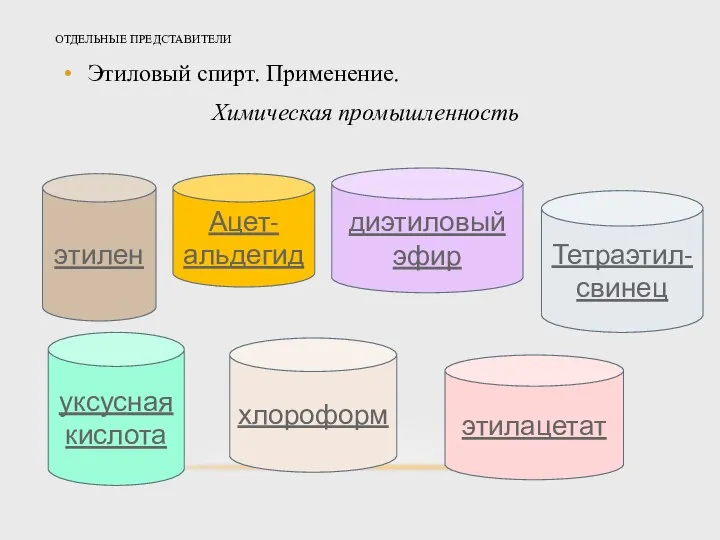
- 21. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. Химическая промышленность этилен Ацет-альдегид диэтиловый эфир Тетраэтил-свинец уксусная кислота хлороформ этилацетат
- 22. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. Растворитель В лакокрасочной промышленности, в производстве товаров бытовой химии (в чистящих
- 23. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. Парфюмерия и косметика Является универсальным растворителем различных веществ и основным компонентом
- 24. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. Этиловый спирт также используется как топливо. Применяется для консервирования биологических препаратов.
- 25. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. В медицине антисептик; подсушивающие и дубящие свойства 96%-го этилового спирта используются
- 26. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Применение. Пищевая промышленность Является основным компонентом спиртных напитков. В небольших количествах содержится
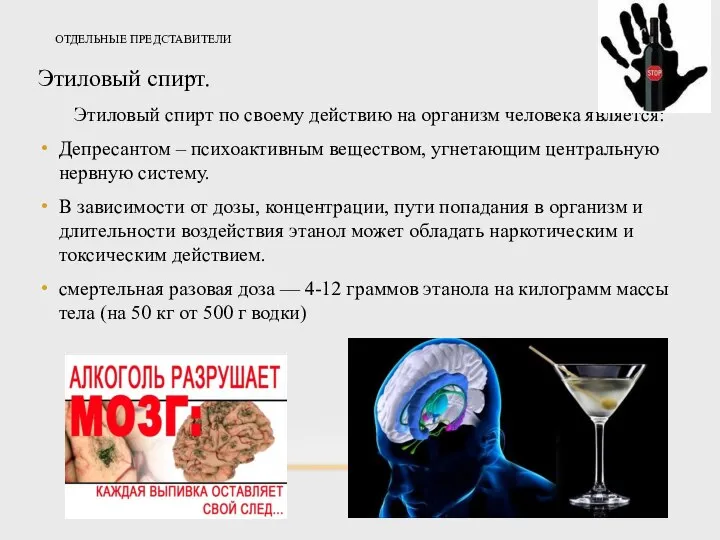
- 27. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этиловый спирт. Этиловый спирт по своему действию на организм человека является: Депресантом – психоактивным
- 28. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ ОДНОАТОМНЫХ СПИРТОВ гомологический ряд
- 29. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ ОДНОАТОМНЫХ СПИРТОВ гомологический ряд
- 30. ИЗОМЕРИЯ Структурная изомерия (или изомерия углеродного скелета) Положения гидроксогруппы
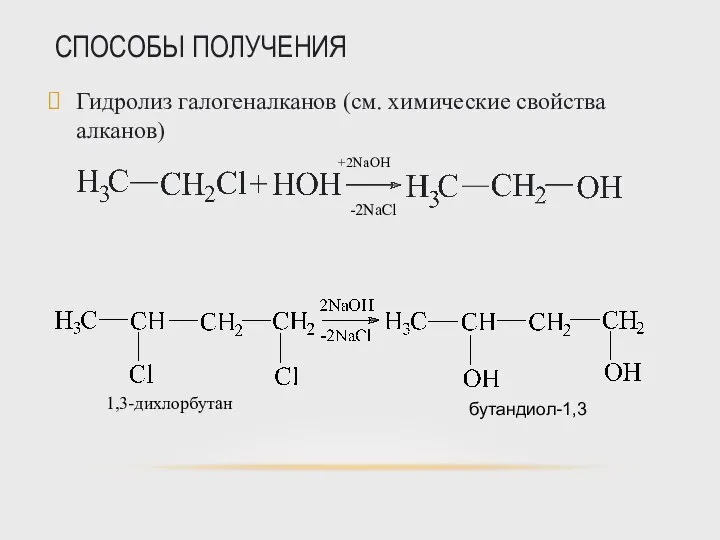
- 31. СПОСОБЫ ПОЛУЧЕНИЯ Гидролиз галогеналканов (см. химические свойства алканов)
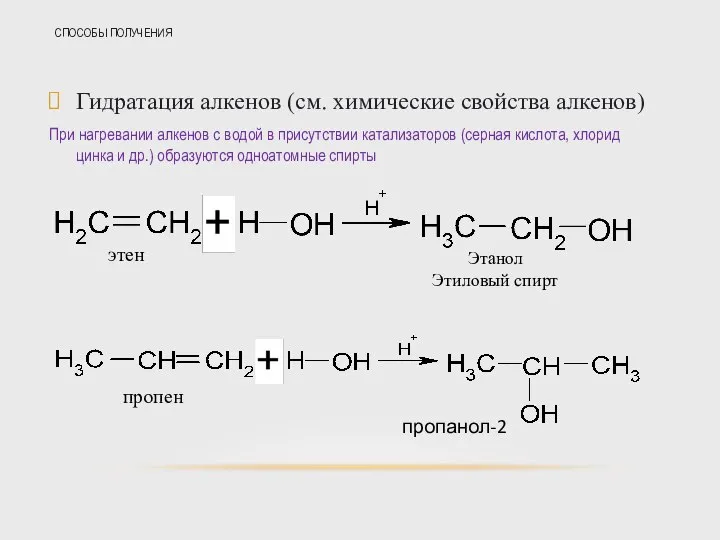
- 32. СПОСОБЫ ПОЛУЧЕНИЯ Гидратация алкенов (см. химические свойства алкенов) При нагревании алкенов с водой в присутствии катализаторов
- 33. СПОСОБЫ ПОЛУЧЕНИЯ Гидратация алкинов (см. химические свойства алкинов) При нагревании алкинов с водой в присутствии катализаторов
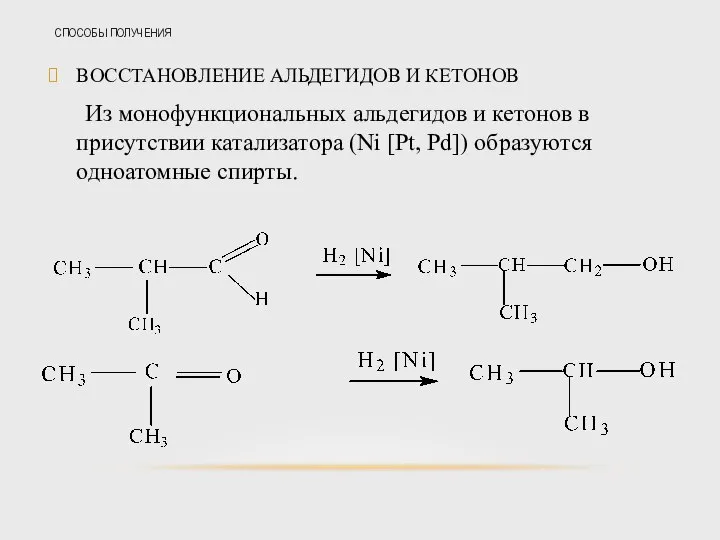
- 34. СПОСОБЫ ПОЛУЧЕНИЯ ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ Из монофункциональных альдегидов и кетонов в присутствии катализатора (Ni [Pt,
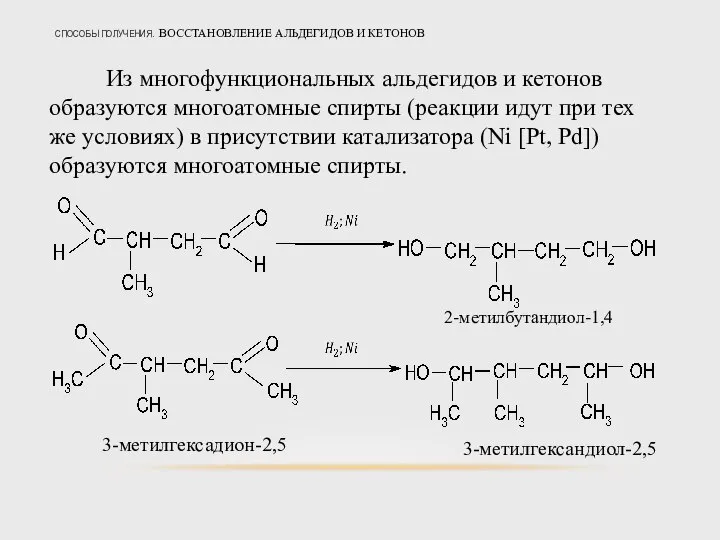
- 35. СПОСОБЫ ПОЛУЧЕНИЯ. ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ Из многофункциональных альдегидов и кетонов образуются многоатомные спирты (реакции идут
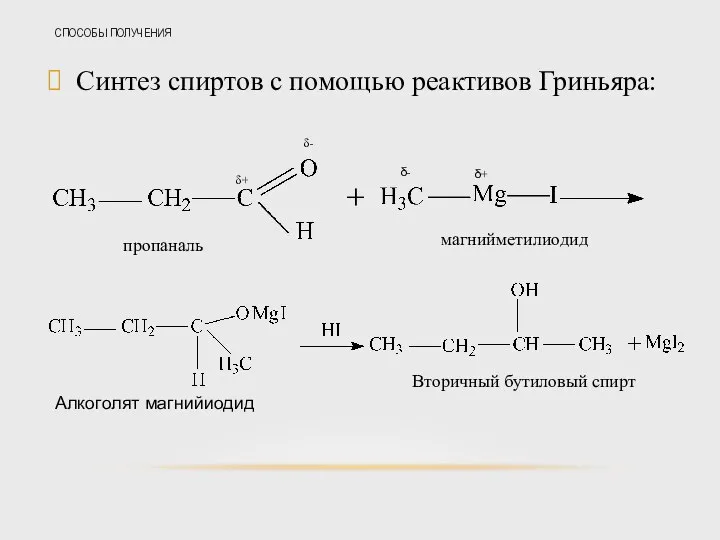
- 36. СПОСОБЫ ПОЛУЧЕНИЯ Синтез спиртов с помощью реактивов Гриньяра:
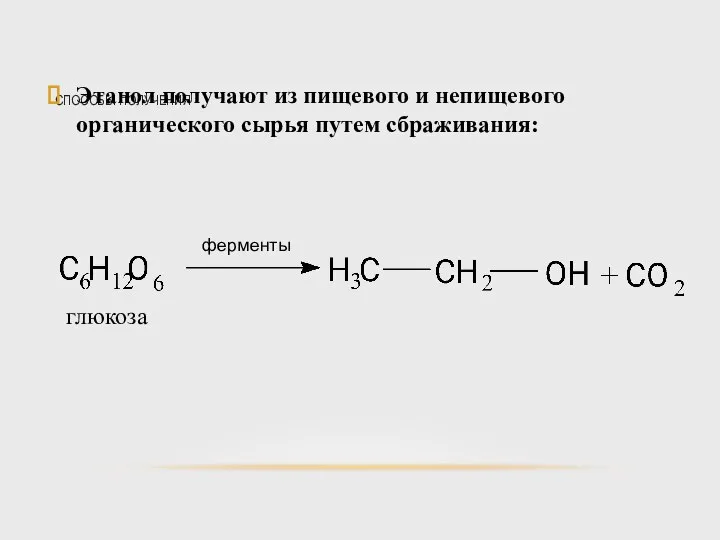
- 37. СПОСОБЫ ПОЛУЧЕНИЯ Этанол получают из пищевого и непищевого органического сырья путем сбраживания:
- 38. СПОСОБЫ ПОЛУЧЕНИЯ Получение смеси спиртов – синтола Условия: Нагревание, высокое давление, катализатор (Fe, Co)
- 39. СПОСОБЫ ПОЛУЧЕНИЯ Кроме того многоатомные спирты получают по реакции Вагнера, гидроксилированием алкенов. В качестве окислителей применяют
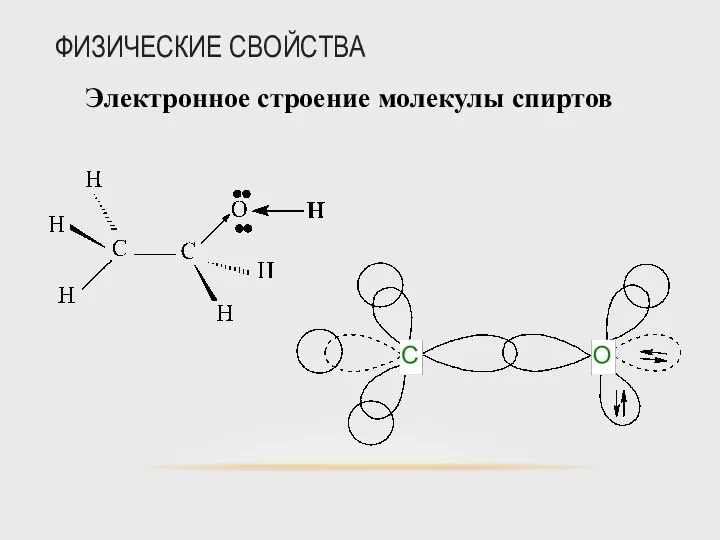
- 40. ФИЗИЧЕСКИЕ СВОЙСТВА Электронное строение молекулы спиртов
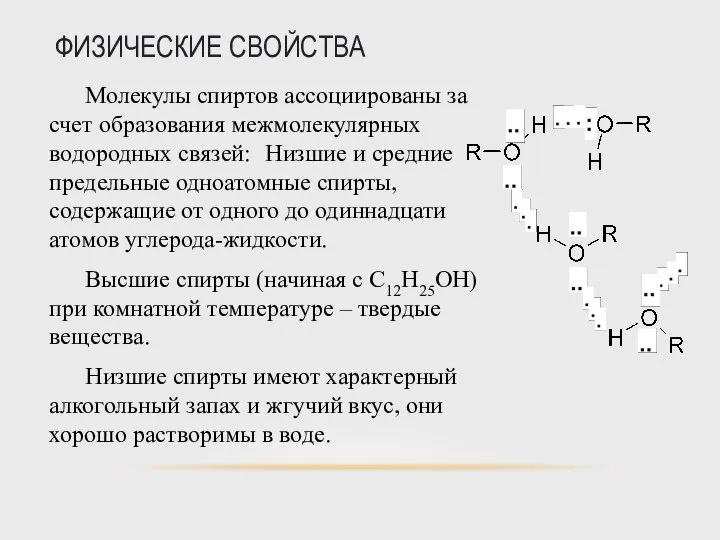
- 41. ФИЗИЧЕСКИЕ СВОЙСТВА Молекулы спиртов ассоциированы за счет образования межмолекулярных водородных связей: Низшие и средние предельные одноатомные
- 42. ХИМИЧЕСКИЕ СВОЙСТВА Спирты очень слабые электролиты (слабее воды) Спирты очень слабые электролиты (слабее воды) Типы реакций
- 43. ХИМИЧЕСКИЕ СВОЙСТВА Реакции протекающие с разрывом связи Образование алкоголятов Замещение гидроксильного атома водорода на металл. (Na,Mg,Al)
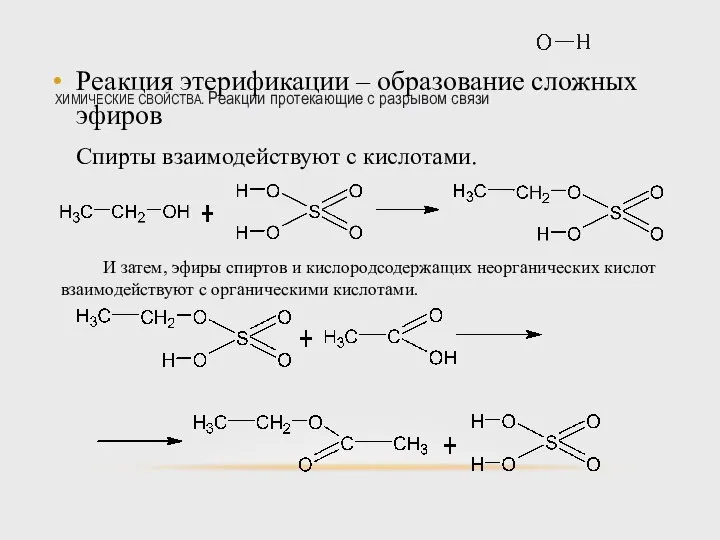
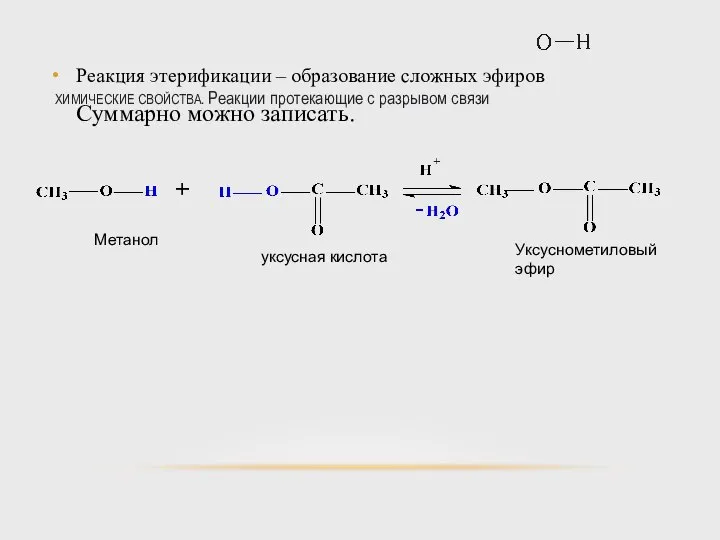
- 44. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции протекающие с разрывом связи Реакция этерификации – образование сложных эфиров Спирты взаимодействуют с
- 45. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции протекающие с разрывом связи Реакция этерификации – образование сложных эфиров Суммарно можно записать.
- 46. ХИМИЧЕСКИЕ СВОЙСТВА Реакции с отщеплением или замещением гидроксильной группы Замещение гидроксила на галоген
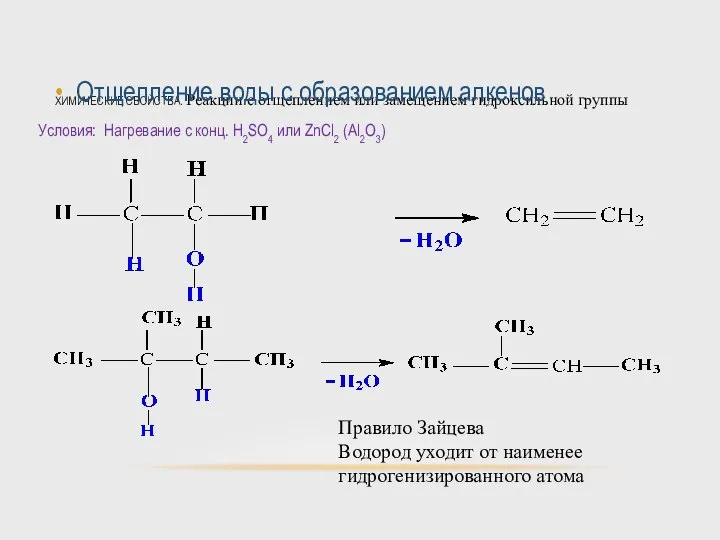
- 47. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы Отщепление воды с образованием алкенов Условия: Нагревание
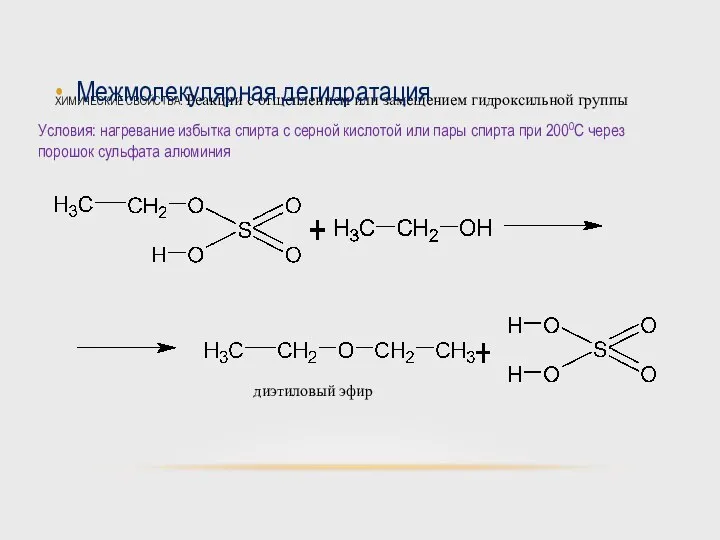
- 48. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы Межмолекулярная дегидратация Условия: нагревание избытка спирта с
- 49. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы Замена гидроксила на аминогруппу Условия: 3000С, Al2O3
- 51. Скачать презентацию

























 Предмет органической химии
Предмет органической химии Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Стратегия успеха 2 (ЕГЭ). Органическая химия
Стратегия успеха 2 (ЕГЭ). Органическая химия Оксид фосфора
Оксид фосфора Вещества и их свойства
Вещества и их свойства Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть
Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть  Кислая, нейтральная и щелочная среда. (Лекция 2)
Кислая, нейтральная и щелочная среда. (Лекция 2) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица
Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица  Химическая кинетика
Химическая кинетика Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу Химические свойства металлов
Химические свойства металлов Презентация по Химии "Полимеразная цепная реакция(ПЦР)" - скачать смотреть
Презентация по Химии "Полимеразная цепная реакция(ПЦР)" - скачать смотреть  Нафта. Переробка нафти Виконала: ліцеїстка ІІІ-І курсу Гринюк Ольга
Нафта. Переробка нафти Виконала: ліцеїстка ІІІ-І курсу Гринюк Ольга  Підготувала учениця 10-Б класу Березянська Альона
Підготувала учениця 10-Б класу Березянська Альона  Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна  Строение периодической системы. Знаки химических элементов
Строение периодической системы. Знаки химических элементов Спирты. Фенолы. Альдегиды. Карбоновые кислоты
Спирты. Фенолы. Альдегиды. Карбоновые кислоты Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17)
Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17) Комплексные соединения
Комплексные соединения Матричные биосинтезы
Матричные биосинтезы Курсовая работа: синтез 3,5-диметилпиразола
Курсовая работа: синтез 3,5-диметилпиразола Практична робота Виведення плям від чаю
Практична робота Виведення плям від чаю  «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА»  Растворы. Первичные понятия
Растворы. Первичные понятия Азот. Нахождение азота в природе
Азот. Нахождение азота в природе Теоретические основы химической технологии
Теоретические основы химической технологии Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии