Содержание
- 2. Основу химического производства составляет ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС – последовательность процессов целенаправленной переработки исходных веществ в продукт, включающие
- 3. Классификация химико-технологических процессов Механические и гидромеханические процессы -протекают без изменения химического и фазового состава обрабатываемого материала.
- 4. Классификация химико-технологических процессов Химические процессы - коренное изменение химического состава в химических реакторах. В химическом производстве
- 5. Математическое моделирование как метод исследования химических процессов и реакторов Моделирование - метод исследования объекта (явления, процесса,
- 6. Модель специально создают, чтобы исследовать выбранные свойства объекта. Для изучения разных свойств объекта может быть создано
- 7. При исследовании процесса на каждой модели исследуются отдельные явления и влияние соответствующих параметров процесса. Учитываемые в
- 8. модель должна предсказывать неизвестные свойства объекта, давать о нем новую информацию. Это может быть достигнуто, во-первых,
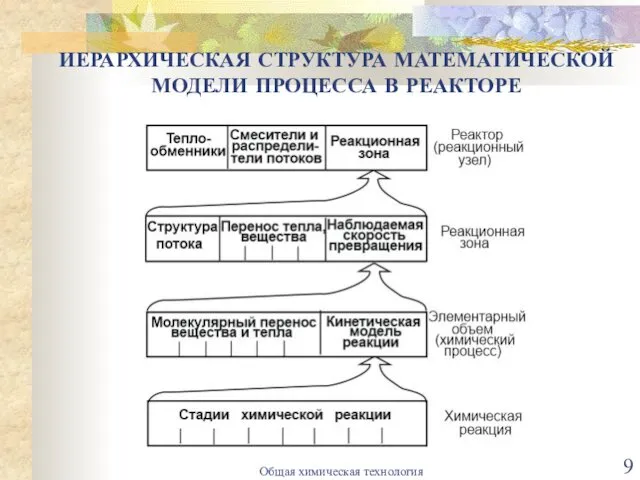
- 9. ИЕРАРХИЧЕСКАЯ СТРУКТУРА МАТЕМАТИЧЕСКОЙ МОДЕЛИ ПРОЦЕССА В РЕАКТОРЕ Общая химическая технология
- 10. Условия процесса состав исходной реакционной смеси (начальные концентрации реагентов – сi0), объём поступающего потока (нагрузка на
- 11. Свойства составляющих процесса – характеристики химического процесса: схема превращения, тип реакций (вид кинетического уравнения), энергия активации,
- 12. ПОКАЗАТЕЛИ ПРОЦЕССА степень превращения х, селективность S, выход продукта Е, профили концентраций, степени превращения и температуры
- 13. СТЕХИОМЕТРИЯ Стехиометрические уравнения показывают, в каких соотношениях вещества вступают в химическое взаимодействие. Общий вид стехиометрического уравнения:
- 14. Алгебраическая форма стехиометрических уравнений Уравнение, связывающее количества прореагировавших веществ, стехиометрическое уравнение в алгебраической форме: ∑ νi
- 15. АЛГЕБРАИЧЕСКАЯ ФОРМА СТЕХИОМЕТРИЧЕСКИХ УРАВНЕНИЙ Используя алгебраическую форму стехиометрического уравнения, получим основное стехиометрическое соотношение между количествами превратившихся
- 16. Стехиометрически независимые уравнения На основании стехиометрической количественной связи между реагентами можно рассчитать состав реакционной смеси в
- 17. БАЗИСНАЯ СИСТЕМА СТЕХИОМЕТРИЧЕСКИХ УРАВНЕНИЙ, однозначно и полно описывающая процесс, должна содержать число стехиометрически независимых уравнений, определяемых
- 18. АЛГОРИТМ ОПРЕДЕЛЕНИЯ СТЕХИОМЕТРИЧЕСКИ ЗАВИСИМЫХ УРАВНЕНИЙ Реагирует n веществ А1, А2, А3 ,..., Аn. Их взаимодействие описано
- 19. Матрицу стехиометрических коэффициентов надо привести к виду с единичными элементами по диагонали 1 а21 а31 …
- 20. СТЕПЕНЬ ПРЕВРАЩЕНИЯ - отношение количества превращенного исходного вещества N0 – N к его начальному количеству N0.
- 21. Количество любого вещества Ni в реагирующей смеси можно определить по формуле: В сложной реакции полнота превращения
- 22. СТЕХИОМЕТРИЯ В ТЕХНОЛОГИЧЕСКИХ РАСЧЕТАХ КОНЦЕНТРАЦИИ КОМПОНЕНТОВ В РЕАКЦИОННОЙ СМЕСИ Стехиометрическое уравнение и степень превращения определяют изменение
- 24. Скачать презентацию




















 Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Ароматичні аміни
Ароматичні аміни Аттестационная работа. Рабочая программа по курсу внеурочной деятельности для обучающихся 7 класса «Химия в профессиях»
Аттестационная работа. Рабочая программа по курсу внеурочной деятельности для обучающихся 7 класса «Химия в профессиях» Угольная кислота и ее производные. Сульфокислоты. (Лекция 12)
Угольная кислота и ее производные. Сульфокислоты. (Лекция 12)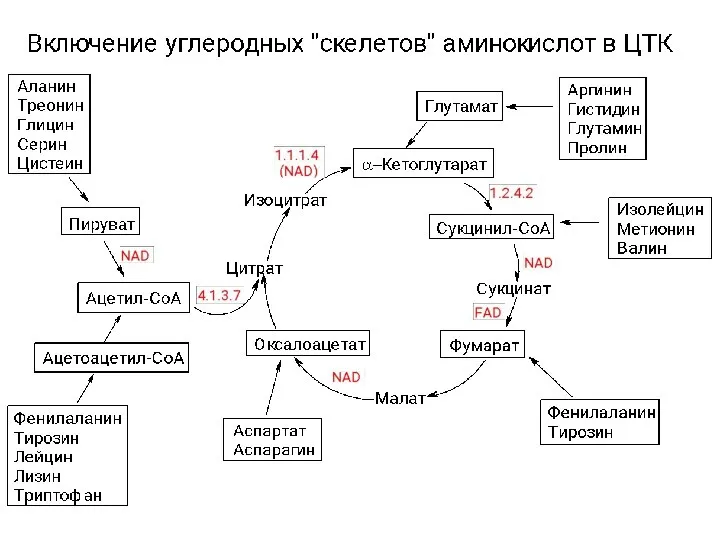 Катаболизм аминокислот
Катаболизм аминокислот Элементы химической кинетики
Элементы химической кинетики Электролитная адсорбция
Электролитная адсорбция Элементы подгруппы алюминия
Элементы подгруппы алюминия Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Этилен. Действие этилена на рост проростков гороха
Этилен. Действие этилена на рост проростков гороха Аттестационная работа. Образовательная программа (элективный курс) Решение задач по химии
Аттестационная работа. Образовательная программа (элективный курс) Решение задач по химии Детонаційна стійкість бензину
Детонаційна стійкість бензину Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Инертные газы
Инертные газы Презентация по Химии "сера" - скачать смотреть
Презентация по Химии "сера" - скачать смотреть  Аттестационная работа. Химия, помощница автолюбителю
Аттестационная работа. Химия, помощница автолюбителю Кристаллохимические радиусы
Кристаллохимические радиусы Органічні сполуки в побуті
Органічні сполуки в побуті  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Содержание ртути и её соединений в воздухе при использовании осветительных ламп
Содержание ртути и её соединений в воздухе при использовании осветительных ламп Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Виды химической связи (8 класс)
Виды химической связи (8 класс) Карбоновые кислоты
Карбоновые кислоты Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ
Молекулярные базы данных. Принцип действия и характеристики основных компьютерных программ Электроизоляционные материалы. Лаки и класки
Электроизоляционные материалы. Лаки и класки